ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Her beskriver vi en metode for å visualisere synaptogenese av granulatneuroner i musens lillehjerne over tidsforløpet av postnatal hjerneutvikling når disse cellene forbedrer sine synaptiske strukturer og danner synapser for å integrere seg i den generelle hjernekretsen.
Abstract
Nevroner gjennomgår dynamiske endringer i deres struktur og funksjon under hjernens utvikling for å danne passende forbindelser med andre celler. Gnagerlillehjernen er et ideelt system for å spore utvikling og morfogenese av en enkelt celletype, cerebellar granulnevronet (CGN), over tid. Her ble in vivo elektroporering av granulatnevronprogenitorer i det utviklende musens lillehjerne brukt til sparsomt å merke celler for påfølgende morfologiske analyser. Effekten av denne teknikken er demonstrert i sin evne til å vise frem viktige utviklingsstadier av CGN-modning, med et spesifikt fokus på dannelsen av dendritiske klør, som er spesialiserte strukturer der disse cellene mottar flertallet av sine synaptiske innganger. I tillegg til å gi øyeblikksbilder av CGN-synaptiske strukturer gjennom cerebellar utvikling, kan denne teknikken tilpasses for å genetisk manipulere granulatneuroner på en celleautonom måte for å studere rollen til ethvert gen av interesse og dets effekt på CGN-morfologi, kloutvikling og synaptogenese.
Introduction
Hjernens utvikling er en langvarig prosess som strekker seg fra embryogenese til postnatal liv. I løpet av denne tiden integrerer hjernen en kombinasjon av inneboende og ekstrinsiske stimuli som former ledningene til synapser mellom dendritter og axoner for til slutt å lede atferd. Gnagerlillehjernen er et ideelt modellsystem for å studere hvordan synapser utvikler seg fordi utviklingen av en enkelt nevrontype, cerebellar granulnevron (CGN), kan spores når den overgår fra en stamcelle til et modent nevron. Dette skyldes delvis det faktum at et flertall av cerebellarcortex utvikler seg postnatalt, noe som muliggjør enkel genetisk manipulering og cellemerking etter fødselen1.
Hos pattedyr begynner CGN-differensiering på slutten av embryonal utvikling når en delmengde av proliferative celler i bakhjernen migrerer over den rombiske leppen for å danne en sekundær germinal sone på overflaten av cerebellum 2,3,4. Selv om de er fullt forpliktet til en granulatnevronprogenitoridentitet (BNP), fortsetter disse cellene å proliferere i den ytre delen av det ytre granulatlaget (EGL) til postnatal dag 14 (P14). Spredning av dette laget resulterer i en massiv utvidelse av lillehjernen da disse cellene gir opphav utelukkende til CGN5. Når nyfødte CGN-er forlater cellesyklusen i EGL, migrerer de innover mot det indre granulatlaget (IGL), og etterlater et axon som vil fordele seg og bevege seg i det molekylære laget av cerebellum, og danne parallelle fibre som synapser på Purkinje-celler6. Plasseringen av disse fibrene i molekyllaget er avhengig av tidspunktet for cellesyklusutgang.
CGN-er som differensierer først, forlater sine parallelle fibre mot bunnen av molekyllaget, mens aksonene til CGN-er som skiller seg senere, er gruppert på toppen 7,8. Når CGN-cellelegemene når IGL, begynner de å utarbeide dendritter og danne synapser med nærliggende hemmende og eksitatoriske nevroner. Det modne dendrittiske treet til en CGN viser en stereotyp arkitektur med fire hovedprosesser. I løpet av CGN-modning danner strukturene på slutten av disse dendrittene en klo som blir beriket med postsynaptiske proteiner 9,10. Disse spesialiserte strukturene, kalt dendrittiske klør, inneholder flertallet av synapsene på granulatneuroner og er viktige for å motta både eksitatoriske innganger fra mosefiberinnerveringer som stammer fra pons, samt hemmende innganger fra lokale Golgi-celler. Når de er fullstendig konfigurert, tillater de synaptiske forbindelsene til CGN-er disse cellene å videresende innganger fra pre-cerebellare kjerner til Purkinje-celler, som projiserer ut av cerebellar cortex til de dype cerebellare kjernene.
In vivo postnatal elektroporering av BNP er fordelaktig i forhold til andre merkingsbaserte metoder, for eksempel virusinfeksjon og generering av transgene muselinjer, fordi uttrykket av ønskede konstruksjoner kan oppnås på en rask tidslinje, og metoden retter seg mot en liten populasjon av celler, som er nyttige for å studere celleautonome effekter. Denne metoden har blitt brukt i tidligere studier for å studere morfologisk utvikling av CGN; Imidlertid har disse studiene fokusert på enten et enkelt tidspunkt eller et kort tidsvindu 9,10,11,12,13. Denne merkemetoden ble parret med bildeanalyse for å dokumentere endringene i CGN-morfologi som forekommer over hele tidsforløpet av CGN-differensiering i løpet av de første tre ukene av postnatallivet. Disse dataene avslører dynamikken i CGN-dendrittutvikling som ligger til grunn for konstruksjon av cerebellarkretser.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
MERK: Alle prosedyrer ble utført under protokoller godkjent av Duke University Institutional Animal Care and Use Committee (IACUC).
1. DNA-forberedelse for in vivo elektroporering eller IVE (1 dag før operasjonen)
- Samle følgende materialer: renset DNA (0,5-25 μg per dyr), 3 M natriumacetat, etanol, Fast Green fargestoff, ultrarent destillert vann, fosfatbufferløsning (PBS) (se materialtabellen).
MERK: For DNA ble en konstruksjon som uttrykker grønt fluorescerende protein (GFP) under en human ubiquitinpromotor oppnådd fra Addgene (FUGW, https://www.addgene.org/14883/). Enhver konstruksjon som uttrykker GFP eller et annet fluorescerende protein under kontroll av en allestedsnærværende promotor, bør fungere. CGN-spesifikk merking med denne teknikken er ikke avhengig av konstruksjonen, men heller av elektroporeringen. - Forbered DNA for elektroporering ved å blande ønsket mengde DNA, 10 volum% av 3 M natriumacetat og 250 volum% av 100 % iskald etanol. Merk at DNA vil utfelle ut av løsningen umiddelbart.
- Fortsett å felle ut DNA-blandingen over natten ved -20 °C eller i en time ved -80 °C.
- Pellet utfelte DNA i en bordplatesentrifuge ved > 16 000 × g og vask to ganger med 70% etanol.
- La DNA-pelleten tørke helt, og rekonstituer i en 1x PBS + 0,02% Fast Green løsning.

Figur 1: Begrensning av injeksjonsdybden til 1,5 mm ved bruk av et inhalasjonskammer. (A) Et segment på 11,2 mm kuttes av en lastepipette ved hjelp av et barberblad. (B) Avstandsstykket monteres på tuppen av Hamilton-sprøyten (total lengde er 1,27 cm eller 0,5 tommer) og festes med enten lim eller parafilm. Den eksponerte spissen skal være 1,5 mm lang. Klikk her for å se en større versjon av denne figuren.
2. In vivo elektroporering av granulatneuronprogenitorer i syv dager gamle postnatale mus
MERK: Alle elektroporasjonsoperasjoner ble utført i en steril og høyt ventilert kirurgisk suite, og alt personell hadde komplett personlig verneutstyr, inkludert hansker, ansiktsmaske, hårpanser, kjole og skodeksler. Alternativt kan operasjonene utføres i ventilert og steril hette.
- Samle følgende materialer: DNA for elektroporering, liten kirurgisk saks, liten kirurgisk pinsett, tilpasset Hamilton sprøyte, bomullsspissapplikator, varmepute, betadin, 70% etanol, 1x PBS, parafilm, vevlim (n-butyl-ester cyanoakrylat), isofluran, elektroporator og pinsett-type elektroder (se materialtabellen).
- Klipp et inhalasjonskammer fra en sterilisert lastespiss slik at det passer over Hamilton-sprøyten for å begrense injeksjonsdybden til 1,5 mm (figur 1A, B). Fest avstandsstykket med lim eller parafilm.
- Bedøv P7-valpen i et isofluran kammer med en leveringshastighet på 0,8 l/min. Bekreft full anestesi ved å overvåke dyret for redusert respirasjon og mangel på tå- eller haleklyperespons (figur 2A).
- Når dyret er fullstendig bedøvet, plasseres valpene på en pidestall utstyrt med en nesekjegle, og gir konstant 4 % isofluran med en leveringshastighet på 0,8 l/min. Rengjør toppen av valpens hode 3 ganger med en steril vattpinne betadin deretter 70% etanol, vekslende mellom de to, for å forberede stedet. La oppløsningen tørke før du fortsetter.
- Bruk en sterilisert saks til å lage et lite snitt med ett kutt som strekker seg over avstanden fra toppen til ørene for å avsløre bakhjernen (figur 2B).
- Finn lillehjernen (figur 2C), stikk den eksponerte spissen av Hamilton-sprøyten gjennom skallen, vinkelrett på hjernen, og injiser 1,5 μl DNA-blanding inn i cerebellarparenkymet ved sakte å skyve det bakre stempelet på sprøyten. Etter levering av DNA-blandingen, trekk nålen sakte tilbake for å forhindre tilbakesøl, og la DNA-løsningen diffundere i 30 s.
- Slå av isofluran og legg valpen på en varmepute på 37 °C. Forbered elektroden av pinsett-type for elektroporering ved å dyppe begge ender i steril 1x PBS.
NOTAT: Fukting av pinsett-type elektroden vil forhindre kontaktforbrenninger på valpens hud under administrering av de elektriske pulser. - Orienter pinsettelektroden over injeksjonsstedet med plussenden vendt nedover og den negative enden over dyrets hode (figur 2D). Administrer fem elektriske pulser fra elektroporatoren med følgende innstillinger: 50 ms, 130 V og 950 ms interpulsintervall.
MERK: Hvis nødvendig, utfør en testinjeksjon for å sikre at injeksjonsstedet er plassert på cerebellar vermis (figur 2E). - Klem snittet lukket, og forsegle såret med et ikke-giftig n-butyl-ester cyanoakrylat vevlim. Rengjør såret med 70% etanol, da ethvert spor av blod øker sannsynligheten for foreldrenes barnedrap og kannibalisme.
- La dyret komme seg på en varmepute på 37 °C før valpen føres tilbake til demningen. Overvåk valpen (e) hvert 30. minutt i minst 2 timer etter operasjonen for å sikre full gjenoppretting.
MERK: Barnedrap av en av foreldrene er ganske vanlig. For å forhindre kannibalisme, hus siren i et annet bur før du starter elektroporeringen, og returner alltid rensede og gjenopprettede valper (dvs . ingen blodflekk, fullt mobil) til det originale buret på det originale sengetøyet. Valper kan også tørkes med avføring fra det opprinnelige buret for å minimere lukten av blod. Bruk av en surrogatdam kan være nødvendig hvis den opprinnelige dammen fortsetter å kannibalisere valpene hennes.

Figur 2: In vivo cerebellar elektroporering av granulatnevronprogenitorer i P7 wildtype musunger. (A) Avkom bedøves med 4% isofluran gitt med en hastighet på 0,8 l / min for å sikre anestesi gjennom injeksjonen av DNA-oppløsningen. Isofluran gis med en hastighet på 0,8 l/min. (B) Etter sterilisering av musen 3 ganger med betadin og 70% etanol, gjøres et snitt som spenner over ørens avstand og avslører bakhjernen. (C) Et forstørret bilde av en hvit avgrensning på kraniet, et landemerke for injeksjonsstedet. DNA-konstruksjon skal injiseres innen 1 mm over merket; Stiplede linjer skisserer avgrensningen, og svart pil angir injeksjonsstedet. Ryggene på cerebellar vermis kan være synlige og kan være nyttige for å finne injeksjonsstedet. (D) Elektrodeorientering av pinsetttype for effektiv elektroporering. Plus (+) enden må være orientert nedover for å trekke negativt ladet DNA inn i cerebellar parenchyma før administrering av elektriske pulser. (E) Testinjeksjon av 1 μL av et 0,02% Fast Green-fargestoff viser at injeksjonen er lokalisert til midten av cerebellar vermis mellom lobuler 5-7. Klikk her for å se en større versjon av denne figuren.
3. Immunhistokjemi av elektroporerte CGNer
- Samle følgende materialer: isofluran, 1x PBS, 4% paraformaldehyd (PFA), 30% sukrose, normalt geitserum, ikke-ionisk vaskemiddel, glassglassglass, glassdeksler, neglelakk, monteringsmedier, Hoechst kjernefysisk fargestoff og passende primære og sekundære antistoffer (se materialfortegnelsen).
- Bedøv forsøksdyret med isofluran og bekreft full anestesi med tå og haleklype.
- Utfør en transkardial perfusjon ved sakte å injisere 1x PBS og 4% PFA i venstre ventrikkel i dyrets hjerte. La blodet renne fra dyret ved å kutte vena cava.
- Fikser hjernen over natten ved å senke den i 4% PFA ved 4 °C. Dagen etter, skyll hjernen raskt med 1x PBS, og overfør hjernen til 30% sukrose i 1x PBS for kryobeskyttelse i minst 24 timer.
- Om nødvendig, skjær hjernen i to langs rostral-caudal aksen, og bekreft ekspresjon av den transfekterte reporterkonstruksjonen ved hjelp av et oppreist fluorescerende dissekerende mikroskop.
MERK: Hold hjernen nedsenket i 1x PBS i en liten tallerken for å forhindre at den tørker ut. - Monter hjernen på en frysende mikrotom, skjær 25 μm sagittale seksjoner, og la seksjoner utfolde seg i en 1: 1-blanding av 1x PBS og glyserol.
MERK: Seksjoner kan oppbevares i denne kryobeskyttelsesmiddeloppløsningen ved -20 °C for langtidsoppbevaring. - Vask seksjoner tre ganger i 1x PBS i 10 minutter hver for å fjerne kryobeskyttelsesmiddel, og blokker vevet i 1x PBS + 10% normalt geitserum + 0,2% ikke-ionisk vaskemiddel på en orbital shaker ved romtemperatur i 1 time.
- Forbered primær antistoffløsning: 1x PBS, 10% normalt geitserum, 0,2% ikke-ionisk vaskemiddel og anti-GFP-antistoff, og sentrifuge løsningen i 5 minutter ved >16 000 × g. Inkuber snitt i antistoffoppløsningen ved 4 °C på en orbital shaker i 48 timer.
- Vask av primær antistoffoppløsning i 15 minutter fem ganger med 1x PBS + 0,2% ikke-ionisk vaskemiddel.
- Forbered sekundær antistoffløsning: 1x PBS, 10% normalt geitserum, 0,2% ikke-ionisk vaskemiddel og et passende sekundært antistoff for å oppdage GFP; sentrifuger løsningen ved > 16 000 × g. Inkuber seksjoner i antistoffoppløsningen på en orbital shaker ved romtemperatur i 2-3 timer. Beskytt seksjonene mot lyseksponering for å forhindre bleking.
- Vask av sekundær antistoffoppløsning tre ganger med 1x PBS + 0,2% ikke-ionisk vaskemiddel i 15 minutter hver gang. Inkuber seksjoner i 1x PBS + Hoechst i 5 minutter for å flekke kjerner.
- Vask av Hoechst løsning med 1x PBS + 0,2% ikke-ionisk vaskemiddel og monter på glassglass. Dekk seksjonene med monteringsmedier, dekk til lysbildene og forsegl lysbildet med neglelakk for å forhindre fordampning.
4. Morfologiske analyser av CGN - tredimensjonal (3D) rekonstruksjon og overflateareal og cellulært volum
- Bilde enkelt elektroporerte CGN-er på et konfokalmikroskop ved 63x objektiv med 2x zoom, og tar z-stack-bilder ved 0,5 μm per stabel. Bilde én celle per bildevindu for å gjøre det enkelt å analysere og rekonstruere.
- Installer Simple Neurite Tracer-plugin-modulen for FIJI ved å bruke følgende lenke (https://imagej.net/Simple_Neurite_Tracer:_Basic_Instructions) for enkelt og effektivt å spore strukturen til elektroporerte CGN-er i tredimensjonalt (3D) rom.
MERK: Det finnes en oppdatert versjon av plugin-modulen (https://imagej.net/SNT). - Analyser nevrittlengde og dendritisk klodannelse på en blindet måte ved hjelp av Simple Neurite Tracer. Last opp enkeltkanals z-stack-bilder av elektroporerte CGN-er til FIJI, og klikk på Plugins | Segmentering | Enkel nevrittsporer (figur 3D).
- Åpne rullegardinmenyen, og velg Opprett ny 3D-visning (figur 3D).
- Bla til bunnen av en dendritt, der den kobles til cellen soma og start en sti ved å klikke på krysset. Spor banen manuelt ved å klikke deg gjennom seksjonene der cellefyllingssignalet lyser sterkest, og trykk på [y] for å beholde sporet. Spor til slutten av dendritten hvis den ikke inneholder en klo eller til bunnen av kloen og bekreft banen ved å trykke på [f] (figur 4D).
- Deretter sporer du kløen ved å starte en bane ved foten av strukturen og spore til slutten av den lengste nevitten. Spor sekundære og tertiære grener ved å holde nede [ctrl] på Windows eller [alt] på et Mac OS og klikke på banen. Bekreft banen ved å trykke på [f].
- Vær oppmerksom på at målinger for sporene er synlige på et eget vindu; Legg sammen alle målingene av klogrenene (primær, sekundær, tertiær) for å oppnå den totale lengden for hver klo.
- For å analysere overflateareal og cellulært volum av elektroporerte CGNer, last ned Imaris celleanalyseprogramvare (https://imaris.oxinst.com/).
MERK: FIJI kan også brukes til å rekonstruere celler i 3D fra z-stack-bilder ved hjelp av lett tilgjengelige og gratis plugin-moduler. I tillegg er det en volumetrisk gjengivelsesfunksjon i Simple Neurite Tracer, men Imaris ble brukt av årsakene som er beskrevet nedenfor. - Last opp z-stack bilde av en elektroporert CGN på Imaris. Få tilgang til verktøysettet for 3D-rekonstruksjon ved å trykke på Surpass.
- Hvis du vil rekonstruere CGN, trykker du på Overflater og velger et interesseområde som omfatter hele cellen i bildevinduet. Når du er ferdig, trykker du på den blå fremoverpilen nederst i høyre hjørne under Opprett.
- Hvis bildet inneholder flere kanaler for forskjellige signaler, velger du kanalen som inneholder den elektriske CGN-en, og trykker på den blå fremoverpilen.
- Bruk glidebryteren til å angi en ønsket terskel som passer mest nøyaktig til signalet til den elektroporerte cellen. Zoom inn nærmere overflaten av cellen for å bestemme terskelverdien nøyaktig. Når du er ferdig, trykker du på den doble grønne pilen for å rekonstruere cellen og få overflatearealet og volumstørrelsen fra metadataene.

Figur 3 Immunhistokjemisk analyse og tredimensjonal rekonstruksjon av elektroporerte granulatnevroner. P7 CD-1-mus ble elektroporert med en konstruksjon som uttrykker GFP. Hjerner ble samlet inn og utsatt for immunhistokjemi, konfokalmikroskopi og 3D-rekonstruksjon for morfologisk analyse. (A) Tidslinje fra elektroporering til bildebehandling av en 10-DPI-mus. (B) Maksimalt projeksjonsbilde av et sagittalt tverrsnitt av elektroporert cerebellum 10-DPI; Hvite linjer avgrenser cerebellare lag, og skala bar er 25 μm. (C) Maksimalt projeksjonsbilde av et enkelt elektroporert granulatnevron 10-DPI og det tilsvarende 3D-sporet, skalastangen er 10 μm. (D) 3D-rekonstruksjoner ble generert ved hjelp av FIJI-pluginet Simple Neurite Tracer. Alle målinger ble sporet gjennom z-stakken, etter cellefyllingssignalet. Aksel- og klomålinger ble sporet separat for hver dendritt; Stiplet linje angir del av dendritt innenfor det nåværende planet. Forkortelser: 3D = tredimensjonal; GFP = grønt fluorescerende protein; DPI = dager etter injeksjon; PSD-95 = postsynaptisk tetthetsprotein 95; BNP = granulatneuronprogenitorer; PFA = paraformaldehyd. Klikk her for å se en større versjon av denne figuren.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results

Figur 4: Analyse av granulatnevronmorfologi under lillehjernens utvikling. (A) Maksimale projeksjonsbilder av elektroporerte CGN-er fra 3-DPI til 14-DPI (postnatal alder P10 til P21), kjerner (blå) og GFP (grønn); Pilspisser indikerer individuell dendritt, og skalastangen er 10 μm. (B) Gjennomsnittlig antall dendritter. (C) Gjennomsnittlig dendrittlengde målt fra basen av soma til spissen av dendritten. (D) Fraksjon av dendritter som inneholder en klo; En verdi på 1,00 er 100%, det vil si at alle dendritter har klo. (E) Total lengde på dendrittisk klo. N > 30 celler per tilstand, samlet fra minst 4 dyr per tilstand; alle målinger ble analysert ved enveis ANOVA og enten en Dunnetts multippel sammenligningstest (B, C og D) eller en Tukeys multippel sammenligningstest (E), **** angir signifikans med p <0,0001 over tid; feil barer er S.E.M. Forkortelser: GFP = grønt fluorescerende protein; DPI = dager etter injeksjon; PSD-95 = postsynaptisk tetthetsprotein 95; CGN = cerebellære granulatneuroner; ANOVA = variansanalyse; S.E.M. = standardfeil av gjennomsnittet. Klikk her for å se en større versjon av denne figuren.
For å studere utviklingen av granulatnevronmorfologi in vivo, ble en konstruksjon som uttrykker GFP under kontroll av en human ubiquitinpromotor (FUGW) elektroporert inn i det utviklende lillehjernen av CD-1-mus og hjerner samlet 3-, 5-, 7-, 10- og 14-dager etter injeksjon (DPI). Sparsom merking av celler ved elektroporering i kombinasjon med konfokalmikroskopi fanger øyeblikksbilder av CGN i perioder med dendritisk beskjæring, vekst og modning. For å kvantitativt analysere og spore veksten av CGN-synaptiske strukturer, ble hver dendrit sporet ved hjelp av FIJI-plugin Simple Neurite Tracer (SNT). SNT er en enkel, rask, effektiv og lett tilgjengelig metode for å måle nevritt- og klolengde i tredimensjonalt (3D) rom. Omvendt ble Imaris brukt til 3D-rekonstruksjon av CGN-er for å oppnå overflateareal og volummålinger fordi programmet gir rask og nøyaktig gjengivelse av hver celle, og dens terskelegenskaper er i stand til å isolere merkede celler fra nærliggende merkede celleavfall.
Nyfødte CGN gjennomgår en frodig fase med dendritisk vekst etterfulgt av raffinement fra P10 til P14 (3- til 7-DPI) som resulterer i beskjæring av mer enn 50% av overflødige dendritter (figur 4B). Denne hendelsen sammenfaller med den gradvise forlengelsen av de gjenværende arborene (figur 4C) og dannelsen av klolignende strukturer på slutten av hver dendrit (figur 4D), noe som indikerer at disse utviklingsprosessene skjer samtidig. Imidlertid, mens klør finnes på omtrent 75% av dendritter av P14 (7-DPI), fortsetter disse strukturene å øke i størrelse til P21 (14-DPI) (figur 4E).
Endringene i dendritt- og klomorfologi kan gjenspeile enten en generell endring i total cellestørrelse eller en omfordeling av cellemembran. For å løse dette spørsmålet ble hvert merket granulatnevron rekonstruert i Imaris for å kvantifisere det totale somatodendrittiske overflatearealet og volumet. CGN-størrelsen forble relativt konstant over utviklingen (figur 5A, B), men ved P14 viser CGN-er en signifikant volumreduksjon på 20 % sammenlignet med P10, P12 og P17 (3-, 5- og 10-DPI) (figur 5B). Disse dataene antyder at membrangjenvinning fra tilbaketrukne dendritter kan være spesielt viktig for å tillate utvidelse av dendrittiske endinger i klør og peker på P14 (7-DPI) som et sentralt tidspunkt i overgangen fra beskjæring til synapseutvikling.

Figur 5: Analyse av granulatnevronstørrelse under cerebellar utvikling. Elektroporerte CGN-er ble rekonstruert i Imaris for å bestemme cellestørrelsen. (AB) Overflateareal og volumetrisk analyse av granulatneuroner (dvs. cellesoma og dendritter) under cerebellar utvikling. N > 30 celler per tilstand, samlet fra minst 4 dyr per tilstand. Alle målinger ble analysert ved enveis ANOVA og en Dunnetts multippel sammenligningstest, ** angir signifikans med p <0,005; feil barer er S.E.M. Forkortelser: DPI = dager etter injeksjon; CGN = cerebellære granulatneuroner; ANOVA = variansanalyse; S.E.M. = standardfeil av gjennomsnittet. Klikk her for å se en større versjon av denne figuren.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Cerebellar granulatneuroner er de mest tallrike nevronene i pattedyrhjernen, og utgjør nesten 60-70% av den totale nevronpopulasjonen i gnagerhjernen 1,14. Lillehjernen har blitt mye brukt for å belyse mekanismer for cellulær proliferasjon, migrasjon, dendrittdannelse og synapseutvikling 6,9,10,11,15,16,17,18,19,20 . Videre har flere tiår med elektrofysiologiske studier bidratt til å etablere rollen til granulatneuroner i langsiktig cerebellar plastisitet, som ligger til grunn for kretsens involvering i lært motorisk atferd21,22,23. Dermed er granulatnevroner et utmerket modellsystem for å undersøke viktige spørsmål angående synapse og kretsutvikling.
Målet med denne studien er å markere en teknikk som utnytter lillehjernen til å spore morfologien til en enkelt nevrontype in vivo. Elektroporering av lillehjernen retter seg mot delende celler; Dermed er det teknisk i stand til å merke både granulatneuronprogenitorer og glialceller, men fordi granulnevronprogenitorer er så mange, er den elektroporerte populasjonen i stor grad nevronal selv uten behov for celletypespesifikke promotorer. I tillegg kan denne teknikken tilpasses genetisk manipulere gener in vivo for å studere deres roller i CGN-utvikling. Dette kan oppnås ved transfeksjon av et plasmid som uttrykker enten korthårnål eller småforstyrrende RNA for å slå ned gener eller et plasmid som uttrykker Cre recombinase i en transgen musestamme for å skjære ut regioner flankert av LoxP-steder og slå ut det tiltenkte genet av interesse10,24.
Elektroporering har både styrker og svakheter for genetiske studier. Det tilbyr en raskere metode for å manipulere gener sammenlignet med tradisjonelle transgene strategier, selv om sparsomheten til elektroporasjonen begrenser bruken av atferdsstudier, som krever et stort antall genetisk modifiserte celler for å se effekter. En annen begrensning er at den bare pålitelig retter seg mot granulatneuroner mellom lobuler 5 og 7, og dette skyldes delvis hvordan cerebellum er orientert på injeksjonsstedet. Innenfor det elektroporerte området gir imidlertid denne metoden et relativt stort antall individuelt merkede celler, noe som gir potensial for statistisk robuste målinger. For eksempel var det ikke bare mulig å følge dendrittutviklingen over tid, men også subtile omfordelinger av membran mellom dendrittene og klørne kunne måles, og utvide tidligere publiserte data20. CGN-klør er spesielt interessante å studere da utvidelse av disse dendritiske strukturene gir ekstra eiendom for granulatneuroner for å danne både eksitatoriske forbindelser med mosefiberterminaler og unipolare børsteceller, samt hemmende forbindelser med nærliggende Golgi-celler. Derfor kan det være nyttig å kombinere disse dendritiske målingene med immunhistokjemisk merking av spesifikke pre- og postsynaptiske proteiner for å fremme studiet av cerebellar kretsdannelse og synapsemodning.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Forfatterne oppgir ingen interessekonflikter.
Acknowledgments
Arbeidet ble støttet av NIH-tilskudd R01NS098804 (AEW), F31NS113394 (UC) og Duke Universitys Summer Neuroscience Program (DG).
Materials
| Name | Company | Catalog Number | Comments |
| Betadine | Purdue Production | 67618-150-17 | |
| Cemented 10 µL needle | Hamilton | 1701SN (80008) | 33 gauge, 1.27 cm (0.5 in), 4 point style |
| Chicken anti-GFP | Millipore Sigma | AB16901 | Our lab uses this antibody at a 1:1000 concentration |
| Cotton-tip applicator | |||
| Donkey anti-chicken Cy2 | Jackson ImmunoResearch | 703-225-155 | Our lab uses this antibody at a 1:500 concentration |
| Ethanol (200 proof) | Koptec | V1016 | |
| Electroporator ECM 830 | BTX Harvard Apparatus | 45-0052 | |
| Fast Green FCF | Sigma | F7252-5G | |
| FUGW plasmid | Addgene | 14883 | |
| Glass slides | VWR | 48311-703 | Superfrost plus |
| Glycerol | Sigma-Aldrich | G5516 | |
| Heating pad | Softheat | ||
| Hoescht 33342 fluorescent dye | Invitrogen | 62249 | |
| Imaris | Bitplane | ||
| Isoflurane | Patterson Veterinary | 07-893-1389 | |
| Micro cover glass | VWR | 48382-138 | |
| Nail polish | Sally Hansen | Color 109 | |
| Normal goat serum | Gibco | 16210064 | |
| O.C.T. embedding compound | Tissue-Tek | 4583 | |
| Olympus MVX10 Dissecting Scope | Olympus | MVX10 | |
| P200 pipette reach tip | Fisherbrand | 02-707-138 | Used for needle spacer |
| Parafilm | Bemis | PM-996 | |
| PBS pH 7.4 (10x) | Gibco | 70011-044 | |
| Simple Neurite Tracer | FIJI | https://imagej.net/Simple_Neurite_Tracer:_Basic_ Instructions |
|
| Sucrose | Sigma | S0389 | |
| Surgical tools | RWD Life Science | Small scissors and tweezers | |
| Triton X-100 | Roche | 11332481001 | non-ionic detergent |
| Tweezertrodes | BTX Harvard Apparatus | 45-0489 | 5 mm, platinum plated tweezer-type electrodes |
| Ultrapure distilled water | Invitrogen | 10977-015 | |
| Vectashield mounting media | Vectashield | H1000 | |
| Vetbond tissue adhesive | 3M | 1469SB | |
| Zeiss 780 Upright Confocal | Zeiss | 780 |
References
- Altman, J., Bayer, S. A. Development of the cerebellar system : in relation to its evolution, structure, and functions. , CRC Press. (1997).
- Rahimi-Balaei, M., Bergen, H., Kong, J., Marzban, H. Neuronal migration during development of the cerebellum. Frontiers in Cellular Neuroscience. 12, 484 (2018).
- Alder, J., Cho, N. K., Hatten, M. E. Embryonic precursor cells from the rhombic lip are specified to a cerebellar granule neuron identity. Neuron. 17 (3), 389-399 (1996).
- Hatten, M. E., Heintz, N. Mechanisms of neural patterning and specification in the developing cerebellum. Annual Review of Neuroscience. 18, 385-408 (1995).
- Ben-Arie, N., et al. Math1 is essential for genesis of cerebellar granule neurons. Nature. 390 (6656), 169-172 (1997).
- Borghesani, P. R., et al. BDNF stimulates migration of cerebellar granule cells. Development. 129 (6), 1435-1442 (2002).
- Espinosa, J. S., Luo, L. Timing neurogenesis and differentiation: insights from quantitative clonal analyses of cerebellar granule cells. Journal of Neuroscience. 28 (10), 2301-2312 (2008).
- Markwalter, K. H., Yang, Y., Holy, T. E., Bonni, A. Sensorimotor coding of vermal granule neurons in the developing mammalian cerebellum. Journal of Neuroscience. 39 (34), 6626-6643 (2019).
- Shalizi, A., et al. PIASx is a MEF2 SUMO E3 ligase that promotes postsynaptic dendritic morphogenesis. Journal of Neuroscience. 27 (37), 10037-10046 (2007).
- Shalizi, A., et al. A Calcium-regulated MEF2 sumoylation switch controls poststynaptic differentiation. Science. 311 (5763), 1012-1017 (2006).
- Konishi, Y., Stegmuller, J., Matsuda, T., Bonni, S., Bonni, A. Cdh1-APC controls axonal growth and patterning in the mammalian brain. Science. 303 (5660), 1026-1030 (2004).
- Holubowska, A., Mukherjee, C., Vadhvani, M., Stegmuller, J. Genetic manipulation of cerebellar granule neurons in vitro and in vivo to study neuronal morphology and migration. Journal of Visualized Experiments: JoVE. (85), e51070 (2014).
- Yang, Y., et al. Chromatin remodeling inactivates activity genes and regulates neural coding. Science. 353 (6296), 300-305 (2016).
- Herculano-Houzel, S. Coordinated scaling of cortical and cerebellar numbers of neurons. Frontiers in Neuroanatomy. 4, 12 (2010).
- Wilson, P. M., Fryer, R. H., Fang, Y., Hatten, M. E. Astn2, a novel member of the astrotactin gene family, regulates the trafficking of ASTN1 during glial-guided neuronal migration. Journal of Neuroscience. 30 (25), 8529-8540 (2010).
- Kokubo, M., et al. BDNF-mediated cerebellar granule cell development is impaired in mice null for CaMKK2 or CaMKIV. Journal of Neuroscience. 29 (28), 8901-8913 (2009).
- Schwartz, P. M., Borghesani, P. R., Levy, R. L., Pomeroy, S. L., Segal, R. A. Abnormal cerebellar development and foliation in BDNF-/- mice reveals a role for neurotrophins in CNS patterning. Neuron. 19 (2), 269-281 (1997).
- Segal, R. A., Pomeroy, S. L., Stiles, C. D. Axonal growth and fasciculation linked to differential expression of BDNF and NT3 receptors in developing cerebellar granule cells. Journal of Neuroscience. 15 (7), Pt 1 4970-4981 (1995).
- Zhou, P., et al. Polarized signaling endosomes coordinate BDNF-induced chemotaxis of cerebellar precursors. Neuron. 55 (1), 53-68 (2007).
- Dhar, M., Hantman, A. W., Nishiyama, H. Developmental pattern and structural factors of dendritic survival in cerebellar granule cells in vivo. Scientific Reports. 8 (1), 17561 (2018).
- Ito, M. Synaptic plasticity in the cerebellar cortex and its role in motor learning. Canadian Journal of Neurological Sciences. 20, Suppl 3 70-74 (1993).
- Jorntell, H., Hansel, C. Synaptic memories upside down: bidirectional plasticity at cerebellar parallel fiber-Purkinje cell synapses. Neuron. 52 (2), 227-238 (2006).
- Nakanishi, S. Genetic manipulation study of information processing in the cerebellum. Neuroscience. 162 (3), 723-731 (2009).
- Chang, C. H., et al. Atoh1 controls primary cilia formation to allow for SHH-triggered granule neuron progenitor proliferation. Developmental Cell. 48 (2), 184-199 (2019).
Tags
Nevrovitenskap utgave 172 Neuronal utvikling cerebellum dendritt synapse granulatneuron elektroporeringErratum
Formal Correction: Erratum: Utilizing In Vivo Postnatal Electroporation to Study Cerebellar Granule Neuron Morphology and Synapse Development
Posted by JoVE Editors on 04/06/2023.
Citeable Link.
An erratum was issued for: Utilizing In Vivo Postnatal Electroporation to Study Cerebellar Granule Neuron Morphology and Synapse Development. A figure was updated.
Figure 2 was updated from:
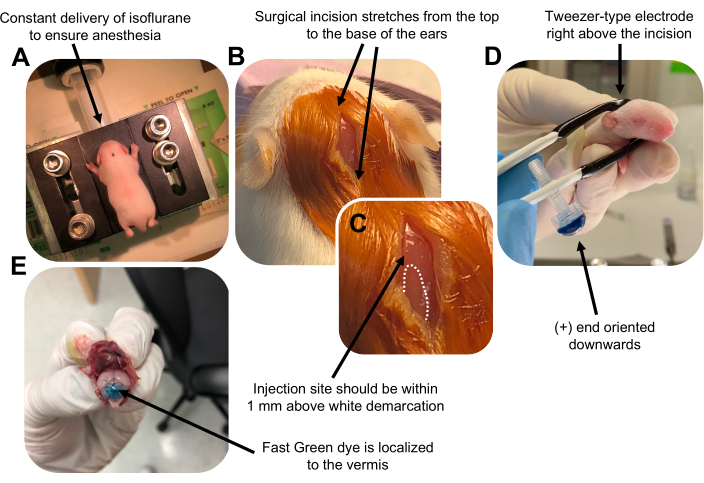
Figure 2: In vivo cerebellar electroporation of granule neuron progenitors in P7 wildtype mouse pups. (A) Pups are anesthetized with 4% isoflurane delivered at a rate of 0.8L/min to ensure anesthesia throughout the injection of the DNA solution. Isoflurane is delivered at a rate of 0.8 L/min. (B) After sterilizing the mouse 3 times with betadine and 70% ethanol, an incision is made that spans the distance of the ears, revealing the hindbrain. (C) A magnified image of a white demarcation on the cranium, a landmark for the injection site. DNA construct should be injected within 1 mm above the mark; dotted lines outline the demarcation, and black arrow denotes the injection site. The ridges of the cerebellar vermis may be visible and can be useful for finding the injection site. (D) Tweezer-type electrode orientation for efficient electroporation. Plus (+) end must be oriented downwards to pull negatively charged DNA into the cerebellar parenchyma prior to administration of electrical pulses. (E) Test injection of 1 µL of a 0.02% Fast Green dye shows injection is localized to the middle of the cerebellar vermis between lobules 5-7. Please click here to view a larger version of this figure.
to:
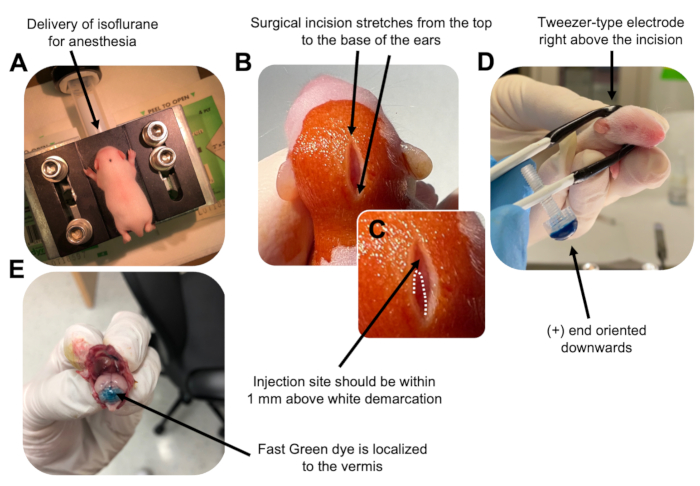
Figure 2: In vivo cerebellar electroporation of granule neuron progenitors in P7 wildtype mouse pups. (A) Pups are anesthetized with 4% isoflurane delivered at a rate of 0.8L/min to ensure anesthesia throughout the injection of the DNA solution. Isoflurane is delivered at a rate of 0.8 L/min. (B) After sterilizing the mouse 3 times with betadine and 70% ethanol, an incision is made that spans the distance of the ears, revealing the hindbrain. (C) A magnified image of a white demarcation on the cranium, a landmark for the injection site. DNA construct should be injected within 1 mm above the mark; dotted lines outline the demarcation, and black arrow denotes the injection site. The ridges of the cerebellar vermis may be visible and can be useful for finding the injection site. (D) Tweezer-type electrode orientation for efficient electroporation. Plus (+) end must be oriented downwards to pull negatively charged DNA into the cerebellar parenchyma prior to administration of electrical pulses. (E) Test injection of 1 µL of a 0.02% Fast Green dye shows injection is localized to the middle of the cerebellar vermis between lobules 5-7. Please click here to view a larger version of this figure.



