ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
이 프로토콜은 기존의 비침습적 이미지 양식에 대한 실용적이고 비용 효율적이며 빠른 대안으로 로봇 초음파 (미국)를 보여줍니다.
Abstract
설치류의 생체 내 이미징에 대한 일반적인 양식에는 양전자 방출 단층 촬영 (PET), 컴퓨터 단층 촬영 (CT), 자기 공명 영상 (MRI), 및 초음파 (미국)가 포함됩니다. 각 방법에는 가용성, 사용 용이성, 비용, 크기 및 이온화 방사선 또는 자기장의 사용을 포함한 제한 및 이점이 있습니다. 이 프로토콜은 설치류 신장과 심장의 생체 내 이미징, 후속 데이터 분석 및 가능한 연구 응용 프로그램에 대한 3D 로봇 미국의 사용을 설명합니다. 로봇 미국의 실용적인 응용 프로그램은 낭종, 종양 및 혈관의 측정뿐만 아니라 총 신장 부피 (TKV)의 정량화입니다. 해상도가 다른 양식만큼 높지는 않지만 로봇 US는 보다 실용적인 높은 처리량 데이터 수집을 허용합니다. 더욱이, 미국 M 모드 이미징을 사용하여, 심장 기능은 정량화될 수 있다. 신장은 심장 출력의 20%-25%를 수신하기 때문에, 심장 기능을 평가하는 것은 신장 생리학 및 병리생리학의 이해에 중요합니다.
Introduction
생체 내 설치류 이미징의 가장 일반적인 양식은 양전자 방출 단층 촬영 (PET), 광학 이미징 (OI), 컴퓨터 단층 촬영 (CT), 자기 공명 영상 (MRI), 및 초음파 (미국)를 포함한다. 이러한 기술은 생체 내 이미지에서 고해상도를 제공하므로 조사관은 비침습적으로 질병 모델을 정량적으로 평가하고 세로로 따를 수 있습니다. 각 이미징 양식에는 한계가 있지만 전임상 연구를 위한 귀중한 도구도 제공합니다.
여기서, 연구 결과는 미국 시스템을 상세히 하고 로봇 및 3D 설치류 화상 진찰을 위한 프로토콜을 제시합니다. 미국 파도는 일반적으로 휴대용 트랜스듀서라는 프로브에 의해 생성됩니다. 음파가 조직과 상호 작용할 때 다시 반사되고 에코가 이미지2로 재구성됩니다. 여기에 설명된 프로토콜은 로봇으로 제어된 트랜스듀서를 사용하고 정량적 평가를 위해 신속한 3D 재구성을 허용하는 소프트웨어를 사용하여 신장 및 심장 이미징에 초점을 맞출 것입니다.
로봇 미국은 조사관이 높은 처리량 과 세로 연구를 수행 할 수 있도록 빠르고 신뢰할 수 있으며 비 침습적 인 이미징 양식입니다. 휴대용 미국 방법에 비해, 로봇 미국 방법은 시간 효율적입니다, 최대 세 마리의 동물을 몇 분 만에 스캔 할 수 있기 때문에. 신장 측정을 위한 높은 처리량은 시간당 최대 20마우스가 심상일 수 있다는 것을 건의합니다. 로봇 트랜스듀서는 음향 막 아래에 위치하며 2도의 자유도를 가진 동물과 독립적으로 이동합니다(그림 1A). 이를 통해 초보 사용자는 고품질 이미지를 얻을 수 있지만 핸드헬드 미국 메서드는 사용자 오류에 더 취약합니다. 결합 된 소프트웨어는 효율적이고 실시간 3D 신장 재건을 허용합니다. 이전에는 자기 공명 영상(MRI)이 우수한 연조직 대비, 방사능 부족 및 침투 깊이로 인해 비침습적 이미징을 위한 유행 방법이 되었습니다. 그러나 MRI는 종종 긴 획득 시간이 필요하며 수행하기 위해 비용이 많이 듭니다. 미국은 총 신장 부피(TKV)3을 평가하는 MRI에 대한 신뢰할 수 있고 신속한 대안으로 평가되고 있다.
Protocol
이 프로토콜의 모든 단계는 메이요 클리닉 (로체스터, MN) 동물 사용 지침을 준수하고 메이요 클리닉 기관 동물 관리 및 사용위원회에 의해 승인되었습니다.
1. 동물 모델
- 상업적인 근원에서 마우스를 가져옵니다.
참고: C57BL/6J(연령 = 18개월, n =22(7명의 남성, 15마리)) (재료표) 및 Pkd1(RC/RC) (연령 = 18개월; n= 9(남성 3명, 암컷 6개))4 가 연구에 사용되었다.
2. 제모
- 마취실에서 기화 이소플루란(2%-3%)을 사용하여 동물을 마취한다. 발가락 핀치를 수행하여 동물이 충분히 마취되었는지 확인하십시오. 마우스가 명백한 공기 굴리기없이 약 60-90 호흡 / 분의 속도로 호흡하고 있는지 확인하십시오.
참고: 기화 이소플루란은 동물의 마취 수준을 제어하고 미세 조정할 수 있기 때문에 선택되었습니다. 100% 산소를 혼합한 이소플루란을 활용하였다. - 전기 면도기를 사용하여 미국 측정을 위해 원하는 피부 영역을 면도합니다.
참고 : 이 연구에서는 신장과 심장 측정에 중점을 두어 동물의 가슴과 허리를 면도했습니다. - 면팁 어플리케이터로 동물의 면도피부에 탈모 크림을 발라주세요. 마른 종이 타월을 사용하여 30-60 s 후에 크림을 닦으십시오. 그런 다음 젖은 거즈 패드를 사용하여 디필 크림 잔류물을 계속 닦아냅니다. 스캔을 시작하기 전에 제모가 완료되었는지 확인하십시오.
참고: 남은 모발은 이미지 품질을 방해합니다. 완전한 제모는 매우 중요합니다. 그러나, 동물의 피부를 손상 방지 하기 위해 1 분 이내에 탈모 크림을 닦아 필요가 있다. 동물에 남은 탈모 크림은 미국 기계의 이미징 멤브레인을 얼룩지게 할 수 있습니다. 젖은 거즈 패드를 사용하여 동물의 적절한 청소를 보장합니다.
3. 동물 포지셔닝
- 미국 베이의 내부 난방 요소에 대한 미국 기계와 스위치를 켭니다. 사용될 해당 미국 베이에 적합한 마취 밸브를 켭니다.
참고: 미국 이미징 미국 소프트웨어를 시작하기 전에 미국 컴퓨터를 켜야 합니다. - 막을 덮을 충분한 물로 베이를 채웁니다. 마취된 동물을 코 콘에 놓습니다.
- 심장 측정의 경우 동물을 경향이 있는 위치에 놓고 약 30°의 각도를 오른쪽으로 각도로 배치합니다.
- 신장 측정을 위해 동물을 직선 및 척추 위치에 놓습니다. 동물의 몸을 부드럽게 평평하게 하여 동물과 멤브레인 사이의 공기 주머니를 최소화합니다(그림 1B).
참고: 동물의 몸과 함께 손가락을 실행하면 피부에 닿는 기포가 제거되어 이미징을 방해할 수 있습니다. 미국 배지로 물 또는 미국 식염수 젤을 사용; 그러나 물은 여기에서 논의된 급속한 화상 진찰을 용이하게 합니다.
4. 초음파 측정
- 이미징 미국 소프트웨어에서 미국 인수를 선택하고 계측기를 초기화할 수 있도록 합니다.
- B 모드를 이용한 신장 이미징.
- 적절한 대화 상자에서 스터디 이름을 입력합니다.
- 적절한 대화 상자에 동물 ID를 입력합니다.
참고: 최대 3마리의 동물을 순차적으로 이미지화할 수 있습니다. - 3D 로 표시된 탭을 클릭하여 3D 스캐닝을 초기화합니다.
- 라이브 카메라 피드를 사용하여 관심 영역(ROI) 상자를 이동하여 신장을 포함합니다.
참고: ROI의 크기는 이미지 대상의 크기에 따라 조정할 수 있습니다. ROI의 크기를 늘리면 스캔 시간이 약간 증가합니다(그림 1C). ROI 크기에 따라 스캐너는 트랜스듀서에 필요한 패스 수를 자동으로 조정하여 전체 ROI를 스캔합니다. - 원하는 이미지 유형에 따라 선형 배열 또는 Wobbler를 선택하여 변환기를 선택합니다. 빠른 스캔 에서 선택하거나 트랜스듀서에 최적화됩니다 .
참고: 선형 배열은 더 빠르며 일반적으로 적절한 이미징을 제공합니다. 리니어 어레이로 원하는 이미지 품질을 얻을 수 없는 경우 흔들림 변환기를 활용할 수 있습니다. 흔들림 변환기는 더 높은 주파수 파장을 사용하므로 이미지에 더 많은 정의를 제공합니다. 빠른 스캔 옵션은 더 빠른 속도로 호흡 보정없이 중간 품질의 이미지를 수집합니다. 최적화된 옵션에는 약간 더 많은 시간이 필요하지만 더 나은 화질을 제공하고 호흡 보정을 허용합니다. 이 원고는 최적화된 선형 어레이 사전 설정을 사용하는 데 중점을 둡니다. - 라이브 뷰를 클릭하여 원하는 보기 영역의 라이브 이미지를 확인합니다.
- 트랜스듀서를 이동하려면 원형 이동 버튼을 클릭한 다음 이미지를 그리려면 마우스 영역을 클릭합니다. 미리 결정된 단계 크기로 방향 화살표를 사용하여 트랜스듀서 위치를 미세하게 조정합니다.
- 컨트롤 패널 창 옆의 화살표를 클릭하여 설정 트레이를 엽니다. 스캔 프로토콜을 클릭하여 스캔 설정을 엽니다.
- 이상적인 초점 깊이를 결정하고 TGC(시간 이득 보정)의 슬라이더를 조정하여 신장을 가장 잘 볼 수 있도록 이미지 대비를 변경합니다. 원하는 설정을 달성한 후 화살표를 다시 클릭하여 설정 트레이를 닫습니다.
- 정적 획득 버튼을 눌러 3D 스캐닝을 시작합니다.
참고: 스캔 진행 은 소프트웨어 왼쪽 하단의 진행률 막대를 통해 표시됩니다. - 스캔이 완료되면 파란색 다운로드 화살표를 클릭하여 미리 보기 모드에서 스캔을 열어 이미지 품질을 확인합니다. 창 상단의 빨간색 화살표를 드래그하여 스캔의 3D 프레임을 이동합니다. 확대/축소하려면 Ctrl 키를 길게 잡고 마우스의 스크롤 단추를 사용합니다.
- 추가 동물을 스캔하려면 동물 ID 대화 상자를 새로 고치고 새 ID를 입력한 다음 위의 단계를 반복합니다.
참고: 스캔이 완료되면 동물을 건조시키고 홈 케이지로 되돌려 놓습니다.
- M 모드를 이용한 심장 이미징.
참고 : M 모드는 특정, 선택한 초음파 라인을 따라 초음파 파의 디스플레이입니다.- M 모드 탭을 클릭하여 심장 이미징을 활성화합니다.
참고: 한 번에 한 동물만 이미지화할 수 있습니다. - 동물이 심장 검사(2.2단계)에 적합한 위치에 있는지 확인합니다. ROI를 심장의 대략적인 위치로 이동합니다.
- 하트 파인더 버튼을 눌러 하트를 찾습니다. 히트 맵을 사용하여 트랜스듀서의 위치를 최적화합니다. 순환 이동 버튼으로 변환기를 왼쪽 심실(그림 2A)으로 이동합니다.
- 라이브 뷰로 이동하여 화살표 버튼을 사용하여 유두 근육 사이에 트랜스듀서를 배치합니다(그림 2B). 트랜스듀서의 적절한 배치를 확인하려면 라이브 M 모드 추적(그림 2D)을 봅니다.
- 트랜스듀서가 적절한 위치에 있으면 서열 획득을 클릭합니다. 파란색 다운로드 화살표를 클릭하여 완료된 스캔을 봅니다.
- M 모드 탭을 클릭하여 심장 이미징을 활성화합니다.
5. 신장 분석 (분석역학)
- 이미지 분석 탭을 열고 로드 볼륨 단추를 선택하여 이미지 파일/폴더를 입력합니다.
- 세분화
- 모든 비행기에서 신장을 찾기 위해 다양한 평면을 나타내는 컬러 라인을 이동합니다.
- 새 세분화를 추가하려면 추가 를 클릭합니다. 파일에 대한 태그 이름을 제공합니다.
- Surface Cut 버튼을 사용하여 여러 평면에서 신장의 바깥쪽 가장자리 주위에 점을 추가합니다. 전체 신장을 통해 세분화를 생성하려면 적용을 클릭합니다(그림 3A).
- 각 평면의 다른 프레임을 스크롤하여 편집 을 클릭하고 점을 올바른 위치로 드래그하여 부정확한 영역을 편집합니다.
- 또는 신장이 불규칙한 모양이면 Draw 함수를 사용하여 신장 주위의 불규칙한 모양의 흔적을 만듭니다. 가장자리 주변의 점을 클릭하거나 왼쪽 클릭을 길게 길게 잡아 트레이스 프리핸드를 그립니다.
- 그리기 버튼으로 추적을 완료하려면 마우스로 마우스를 마우스로 마우스로 마우스오른쪽 단추로 클릭합니다. 여러 프레임을 스크롤하고 추적 프로세스를 반복합니다.
- 관심 영역 전체에 걸쳐 프레임을 추적할 때까지 반복합니다.
- 그리기 함수를 사용하는 경우 슬라이스 채우기를 선택하여 추적을 확인하고 조정합니다. 초기화를 클릭하여 미리 보기를 봅타입니다. 미리 보기를 허용하면 적용을 클릭합니다. 그렇지 않은 경우 취소를 클릭하고 추적을 수정합니다.
참고: 지우기 버튼을 사용하면 추적 내의 영역을 삭제할 수 있습니다. 매끄러운 버튼은 트레이스의 들쭉날쭉한 가장자리를 부드럽게 합니다. - 이미지 분석이 만족스러울 때 저장 을 선택하여 원본 이미지 파일에 분석을 저장합니다.
- 측량
- 캘리퍼스 함수를 사용하여 이미지 내의 피처를 측정합니다. 캘리퍼스 버튼을 클릭하고 측정할 거리의 두 점을 클릭합니다(그림 3B).
- 화면 상단의 디스크 버튼을 클릭하여 측정을 저장합니다.
- 세분화
6. 심장 분석
- 분석할 파일을 입력하려면 볼륨로드 를 선택합니다.
- 추가 옵션을 선택합니다.
- 포인트 배치 도구를 사용하여 심장 조직의 각 층에 대한 슬레스톨과 이아스톨을 추적합니다. 심장 조직의 다른 층으로 계속. 편집 함수를 사용하여 추적을 수정합니다(그림 2C,D).
참고: M 모드 추적이 매우 명확하면 추가(자동) 버튼을 사용하여 각 레이어의 추적을 자동으로 생성합니다. - 적용을 선택하여 심장 매개 변수를 계산합니다. 정량화 탭을 보고 내보내기 통계를 선택하여 모든 데이터를 *.csv 파일로 내보냅니다(그림 2E).
Representative Results
신장 분석 결과
표면적 및 부피 데이터는 신장의 세분화로부터 획득됩니다. 이 정보는 실험 및 제어 모델을 비교하거나 시간이 지남에 따라 변경 사항을 추적하는 데 사용할 수 있습니다. 캘리퍼스 도구는 이상(즉, 낭종, 종양)과 시간이 지남에 따라 길이를 변경하는 방법을 신속하게 측정하는 데 유용합니다. 그림 3 은 세분화 및 캘리퍼 방법을 모두 사용하여 낭종 볼륨을 정확하게 측정할 수 있음을 시사합니다. 도 4 는 연령일치 대조군과 실험(Pkd1RC/RC) 마우스 사이의 총 신장 부피(TKV)의 명확한 차이를 나타낸다. 이러한 볼륨 렌더링의 3D 시각화는 3D 공간 내의 회전을 포함하여 시스템 내에서 수행될 수 있다(그림 5). 이러한 3D 재구성은 TKV(mm3)를 계산하는 데 사용됩니다. 그림 4) 뿐만 아니라 개별 큰 낭종 볼륨.
심장 분석 결과
M 모드 이미지 의 분석에서 많은 유용한 매개 변수를 획득합니다. 이러한 데이터는 해당 시점에서 왼쪽 심실(LV) 심장 기능의 좋은 스냅샷을 제공합니다. 데이터 출력에는 LV 내부 직경, LV 후방 벽, LV 전방 벽 직경, 배출 분수, 분수 단축, 뇌졸중 볼륨, 심박수, 심장 출력, LV 볼륨 및 LV 질량이 포함됩니다. 심장 분석의 성공은 M 모드 이미지에서 레이어의 정확한 세분화에 따라 달라집니다. 대부분의 심혈관 결과는 후방 및 전방 내막 층의 피크 수축기 및 확장기 상에 의해 계산됩니다. 후방 상피 층은 밝은 흰색으로 나타나고 후방 내막 층과 유사한 패턴을 따릅니다. 후방 내막 층의 추적은 가장 낮은 윤곽에 배치되어야 합니다. 전방 내막 층은 해당 레이어의 가장 높은 윤곽을 따라 추적되어야 합니다. 전방 상근 층은 동물의 위치 지정이 발생하기 쉽기 때문에 이미지 의 하단에 선형으로 나타납니다(도 2D). 도 6 은 실험마우스와 대조군 마우스 간의 심장 출력에 유의한 차이가 없는 한 연구의 예를 나타낸다. 신장 화상 진찰과 마찬가지로 3D 심장 시각화가 가능합니다. 그럼에도 불구하고, 심장 주기의 4D 시각화(보충 도 1)는 조사자가 평가된 동물의 형태학적 및 사이클 동적 이상을 시각화하고 정확하게 찾아낼 수 있게 합니다.
형태학 평가
빠르고 저렴한 평가를 위해, 미국은 효과적으로 생리 학적 매개 변수를 세로로 모니터링 할 수 있습니다. 그러나, 많은 연구 결과는 낭종의 수 그리고 크기, 석회화 (신장 결석), 혈관화, 또는 섬유증의 정도를 더 미세한 형태학적 특성을 추가로 결정하기를 원합니다. 도 7 은 정상적인 마우스 신장을 낭포성 마우스 신장과 적당히 석회화된 마우스 신장과 비교한다. 미국 중심 주파수(선형 어레이가 있는 10MHz)를 35MHz(흔들림 증폭기)로 증가시킴으로써, 증가하는 디테일의 그림을 얻을 수 있다.

그림 1: 초음파 시스템 및 마우스 배치. (A) 초음파 시스템 및 트랜스듀서의 위치의 다이어그램. (B) 초음파 플랫폼에 스핀 위치에 있는 마우스의 보기. (C) 관심 영역(ROI)의 예는 동물 용 아이디가 있는 관심 영역(신장)에 대한 장소에 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 2: 생리적 파라미터를 얻기 위한 심장 초음파 이미징. (A) 심장 파인더 히트맵 이미지를 사용하여 M-모드 이미징을 위한 좌심실에 트랜스듀서를 배치한다. 좌심실의 트랜스듀서 위치는 큰 녹색 점으로 표시됩니다. (B) 유두 근육(점선 상자)에 올바르게 배치하면 트랜스듀서를 볼 수 있습니다. (C) 심장 매개 변수를 측정하는 데 필요한 레이어의 예 보기입니다. (D) 패널 C.로 지정된 레이어가 있는 라이브 M-모드 이미지 보기(상하층: 후방 에피카얼, 후방 내막, 전방 내막, 전방 에피칼) (E) 심장 측정에서 생성된 통계의 예 출력. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 세분화 및 캘리퍼 도구를 사용하여 신장과 낭종을 측정 합니다. (A) 신장(파란색과 주황색 차광)과 아래에 나열된 볼륨이 있는 큰 낭종(노란색)의 예 분절(축보기). 가려지지 않은 미국을 볼 수 있도록 분할되지 않은 뷰가 아래에 표시됩니다. (B) 캘리퍼를 예로 사용하여 아래 측정값을 가진 그림 3A 에서 동일한 낭종(sagittal view)을 측정합니다. 볼륨은 타원에 대한 수식을 사용하여 계산되었다 (볼륨 = (4/3)π x x x b x c, 여기서 a, b, c는 상대 x, y, z, 각각). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: WT 및 낭포성 마우스 신장의 TKV 분포. 야생형(WT) (C57BL/6J) 및 병든(Pkd1RC/RC) 마우스용 TV의 표현. n = 22 (WT) n = 9 (Pkd1RC / RC); 두 꼬리 t-테스트 결과: p < 0.0001. 상자는 25-75 번째 백분 위수 값을 표시하고 수염은 1.5 배 중간 분기 범위를 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 세분화된 신장과 낭종의 애니메이션 3D 재구성. 소프트웨어를 사용하여 신장과 낭종의 3D 프로젝션은 3D 공간에서 회전하거나 흔들 수 있습니다(파란색 = 왼쪽 신장; 노란색 = 큰 낭종; 주황색 = 오른쪽 신장). 이 그림을 다운로드하려면 여기를 클릭하십시오.

그림 6: 미국 측정에서 심장 생리 학적 매개 변수. WT 및 병이 있는 (Pkd1RC/RC) 마우스에 대한 심장 출력(mL/min)의 표현. n = 22 (WT) n = 9 (Pkd1RC / RC). 낮은 표고 된 데이터는 배출 분획, 뇌졸중 볼륨, 심박수 (HR) 또는 심장 출력 (CO)에서 이 두 그룹에 대한 유의한 차이가 없다는 것을 보여줍니다. 두 꼬리 t-테스트 결과: p > 0.05. 상자에는 25-75번째 백분 위수 값이 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 7: 정상 및 2개의 병리학의 미국 처진 단면도비교. (A) 야생형(C57BL/6J 균주) 신장(TKV = 143.202 mm3). (B) 증가 된 TKV와 낭포성 신장 (Pkd1RC / RC 마우스) (TKV = 333.158 mm3). 낭종은 노란색 화살표로 표시됩니다. (C) 혈관 석회화를 가진 신장 (모델 = 저밀도 지단백 수용체 결핍, 아폴리포폴단백질 B100 전용 마우스는 12 개월 동안 서양 식단을 공급) (TKV = 127.376 mm3). 신장 돌은 녹색 화살표로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 도 1: 미국 측정에서 4D 심장 사이클 영화. 소프트웨어를 사용하여, 박동 심장의 표현은 3D 미국에서 캡처하고 심장 주기를 통해 투영된다. 녹색 화살표는 대동맥 판막을 나타냅니다. (모델 = 저밀도 지단백 수용체 결핍, 아폴리포폴단백질 B100 전용 마우스, 12개월 동안 서양 식단을 공급). 이 모델은 미국의 석회화의 음향 반사도가 커짐에 따라 심장과 밸브를 쉽게 시각화할 수 있도록 혈관 석회화를 생성합니다. 유사한 4D 재건은 WT 마우스로 가능합니다; 그러나 캡처된 음향 대비는 높지 않습니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
Discussion
초음파는 음파를 이용하며 음파 전파에 대한 장벽은 이미지 품질을 방해합니다. 따라서, 이미지화될 영역의 완전한 제모가 중요하다. 또한 동물의 피부에 화상/자극을 일으키고 스캐너의 투명한 멤브레인을 변색시킬 수 있으므로 탈모 크림을 완전히 제거하는 것이 중요합니다. 베이의 적절한 수위는 최적의 음파 전파를 위해 필요하며, 따라서 가장 높은 이미지 해상도를 얻는 데 필요합니다. 그러나 동물이 발생하기 쉬운 위치에 있을 때 동물의 주물이 수위 이상인지 동물이 물 흡입의 위험이 있는지 확인하십시오. 이미징 파라미터의 최적화, 특히 초점 깊이는 고품질 이미지를 얻는 데 매우 중요합니다. 개별 동물에 대한 매개 변수수정이 필요할 수 있습니다.
로봇 미국은 전통적인 핸드 헬드 미국 양식에 비해 많은 장점을 제공합니다. 먼저 시스템은 간단한 포인트 앤 클릭 카메라 기반 인터페이스를 사용합니다. 이 기능은 기존 US의 복잡성을 해결하고 초보 사용자가 작동하더라도 일관된 데이터를 생성합니다6. 둘째, 이 시스템은 전통적인 미국 젤이 아닌 물을 음향 매체로 사용할 수 있게 한다. 이전에는 미국 젤을 사용하여 고품질 이미지 수집을 방해하는 거품형성을 허용했습니다. 또한, 미국 젤은 지저분하고 청소에 대한 도전을 제공합니다. 또한, 물은 열램프에 의해 따뜻해지고 동물의 체온을 유지하는 데 도움이됩니다. 셋째, 로봇 미국은 빠므로 호흡기 운동에서 얻은 아티팩트는 문제가 되지 않습니다. 이미징 속도가 증가하면 높은 처리량 데이터 수집을 실제 완료할 수 있습니다. 넷째, 로봇 미국은 3D 이미지를 획득하여 물체의 3D 재구성을 간단하게 만듭니다(그림 4). MRI 및 기타 양식은 비용이 많이 들고 시간이 많이 소요되며 항상 사용할 수 있는 것은 아닙니다. 중요한 것은, 로봇 미국 시스템은 테이블이나 벤치에 적합하고 더 비용 효율적입니다. 마지막으로, 사전 작업은 로봇 미국이 MRI3와 같은 더 비싼 양식에 비교 가능한 측정 데이터를 제공할 수 있음을 입증했습니다.
이 작업에 설명된 로봇 미국 시스템의 이미지 품질과 해상도는 제안된 응용 프로그램(그림 7)에 적합했지만, 향후 이미지 품질을 개선할 수 있는 몇 가지 방법이 있습니다. 예를 들어, 고주파 트랜스듀서(예: 50-70 MHz)를 사용하면 더 나은 기능 정의가 있는 고해상도 이미지가 생성됩니다. 더 높은 주파수를 활용하면 침투 깊이가 좋지 만 마우스 신장과 같은 피상 기관의 생체 이미징 에 충분해야합니다. 다른 이미징 양식과 마찬가지로, 콘트라스트 에이전트는 특정 기능을 향상시키기 위해 사용될 수 있습니다. 미국의 경우 일반적으로 음파를 반사하는 것을 사용하는 것을 의미합니다. 지질이 매우 작은 가스 거품을 둘러싸고있는 내트라바스 내 마이크로 버블은 그러한 에이전트 중 하나입니다. 미크론 크기의 가스 기포는 반사성이 높으며 따라서 혈관7의 고해상도로 변환되는 두 번째 뚜렷한 신호를 제공합니다. 이 음향 대비 기술은 매우 유용 할 수 있지만, 그것은 몇 가지 단점이있을 수 있습니다. 첫째, 마이크로 버블은 신선하게 만들어져야하며 5-10 분 동안 만 생체 내에서 유지해야합니다. 둘째, 생체 내 혈관 주사는 일반적으로 주사를 위한 꼬리 베일 카테터삽입을 필요로 하고, 이것은 기술적으로 도전적일 수 있습니다. 특정 상황에서 는 맥동 정권, 마이크로 버블 이미징 자체는 신장 혈관 손상으로 이어질 수 있습니다8.
또한 사용되는 특정 미국 시스템의 몇 가지 일반적인 제한이 있습니다. 첫째, 로봇 섀시에 하나의 선형 어레이(18MHz 중심)만 포함되어 있으므로 현재 더 높거나 낮은 주파수 프로브로 전환할 수 없습니다. 이는 시스템으로 평가할 수 있는 모델(더 크거나 작음)에 영향을 미칠 수 있습니다. 계측기의 향후 반복에는 전임상 동물 모델의 전체 범위를 커버하기 위해 여러 선형 어레이가 포함되어야 합니다. 둘째, 동물 피사체에 대한 트랜스듀서 각도는 제어할 수 없습니다. 따라서 도플러와 같은 각도 의존적 이미징 기술을 수행하거나 특정 장기의 대체 평면 뷰(예: 신장의 긴 축 보기)를 달성하려면 동물의 재배치가 필요하며 달성하기 어려울 수 있습니다. 이 과제를 개선하기 위해 로봇 운동에 자유도를 추가할 수 있습니다. 셋째, 때때로, 우리는 피상적 인 특징과 경계의 시각화를 모호하게 할 수있는 트랜스듀서에서 동물을 분리 하는 음향 막에서 발생 하는 반향 유물을 관찰 했다. 이러한 경우, 젤 스탠드오프를 사용하여 동물을 막에서 멀리 끌어올리면 상황을 해결할 수 있다. 마지막으로, 열램프를 통한 온도 조절은 부정확하므로 이미징하는 동안 동물의 핵심 체온에 주의를 기울여야 합니다. 통합 된 가열 패드와 같은 더 많은 제어 된 가열 메커니즘은 항상성 관리 및 이미징 처리량을 향상시킬 가능성이 있습니다.
로봇 미국의 사용은 연구의 다양한 분야에 적용 할 수있다. 이 기술은 총 조직 구조의 시각화를 가능하게 합니다, 따라서 여기에서 제시된 것과 같이 종양 진행 및 잠재적인 치료 6,9를 추적하는 데 사용될 수 있습니다. 이미지의 특정 특징을 세분화하는 기능은 다낭성 신장 질환 (PKD)3의 모델을 연구하기위한 매력적인 도구입니다. M 모드 이미지는 심장 생리학의 생체 내 평가를 가능하게 하는 많은 중요한 심장 매개 변수의 간단한 정량화를 허용합니다. 신장이 심장 출력10의 20%-25%를 수신하기 때문에 신장 병리학의 세로 평가 도중 심장 기능을 이해하는 것이 중요합니다. 이러한 미국 프로토콜을 통해, 우리는 미국 화상 진찰이 생체 내 및 세로 신장 연구 결과에 대한 실용적일 뿐만 아니라 점점 더 많은 미국 도구가 전임상 연구에서 마우스의 형태학적 평가뿐만 아니라 생리적 평가를 가능하게 한다는 것을 보여주기 위해 노력했습니다.
Disclosures
몇몇 저자는 고용되거나, 상당한 재정적 이해관계를 가지고 있거나, SonoVol, Inc.(CJM, RCG, TJC)가 허가한 특허에 대한 공동 발명가입니다.
Acknowledgments
이 작품은 NIH (R43-DK126607, TJC, TLK, MFR)와 마요 재단에 의해 지원되었다.
Materials
| Name | Company | Catalog Number | Comments |
| Electric Razor | Braintree Scientific, Inc | CLP-9868 14 | |
| C57bk6j | The Jackson laboratory | https://www.jax.org/ | |
| Cotton gauze pads | Fisher Scientific | ||
| Cotton tipped applicators | Fisher Scientific | ||
| Depilatory cream | N/a | N/a | This study used Nair |
| Heat lamp | Included with SonoVol Vega system | ||
| Robotic Ultrasound System | SonoVol Inc | SonoVol Vega system includes anesthesia system | |
| SonoEQ Software | SonoVol | Included with SonoVol Vega system | |
| TERRELL Isoflurane | Piramal Critical Care, Inc | NDC 66794-019-10 |
References
- Cunha, L., et al. Preclinical imaging: an essential ally in modern biosciences. Molecular Diagnostics & Therapy. 18 (2), 153-173 (2014).
- Ultrasound. NIBIB. , Available from: https://www.nibib.nih.gov/science-education/science-topics/ultrasound#pid-936 (2016).
- Beaumont, N. J., et al. Assessing polycystic kidney disease in rodents: Comparison of robotic 3d ultrasound and magnetic resonance imaging. Kidney360. 1 (10), 1128-1136 (2020).
- Hopp, K., et al. Functional polycystin-1 dosage governs autosomal dominant polycystic kidney disease severity. The Journal of Clinical Investigation. 122 (11), 4257-4273 (2012).
- Weiss, R. M., Ohashi, M., Miller, J. D., Young, S. G., Heistad, D. D. Calcific aortic valve stenosis in old hypercholesterolemic mice. Circulation. 114 (19), 2065-2069 (2006).
- Czernuszewicz, T. J., et al. A new preclinical ultrasound platform for widefield 3D imaging of rodents. Review of Scientific Instruments. 89 (7), 075107 (2018).
- Chong, W. K., Papadopoulou, V., Dayton, P. A. Imaging with ultrasound contrast agents: current status and future. Abdominal Radiology (NY). 43 (4), 762-772 (2018).
- Nyankima, A. G., Kasoji, S., Cianciolo, R., Dayton, P. A., Chang, E. H. Histological and blood chemistry examination of the rodent kidney after exposure to flash-replenishment ultrasound contrast imaging. Ultrasonics. 98, 1-6 (2019).
- Rojas, J. D., et al. Ultrasound measurement of vascular density to evaluate response to anti-angiogenic therapy in renal cell carcinoma. IEEE Transactions on Biomedical Engineering. 66 (3), 873-880 (2019).
- Boron, W. F., Boulpaep, E. L. Medical Physiology. 3rd edn. , Elsevier. (2017).
Tags
의학 문제 174Erratum
Formal Correction: Erratum: Use of 3D Robotic Ultrasound for In Vivo Analysis of Mouse Kidneys
Posted by JoVE Editors on 10/06/2021.
Citeable Link.
An erratum was issued for: Use of 3D Robotic Ultrasound for In Vivo Analysis of Mouse Kidneys. An author name was updated, along with the Protocol and Representative Results sections.
The name of an author was updated from:
Ryan C. Gesser
to:
Ryan C. Gessner
Step 3.1 of the Protocol was updated from:
Turn on the US machine and the heat lamp above the US platforms. Turn on the appropriate anesthesia valves for the corresponding US bays that will be used.
to:
Turn on the US machine and the switch for the internal heating element for the US bays. Turn on the appropriate anesthesia valves for the corresponding US bays that will be used.
Figue 1 in the Representative Results was updated from:
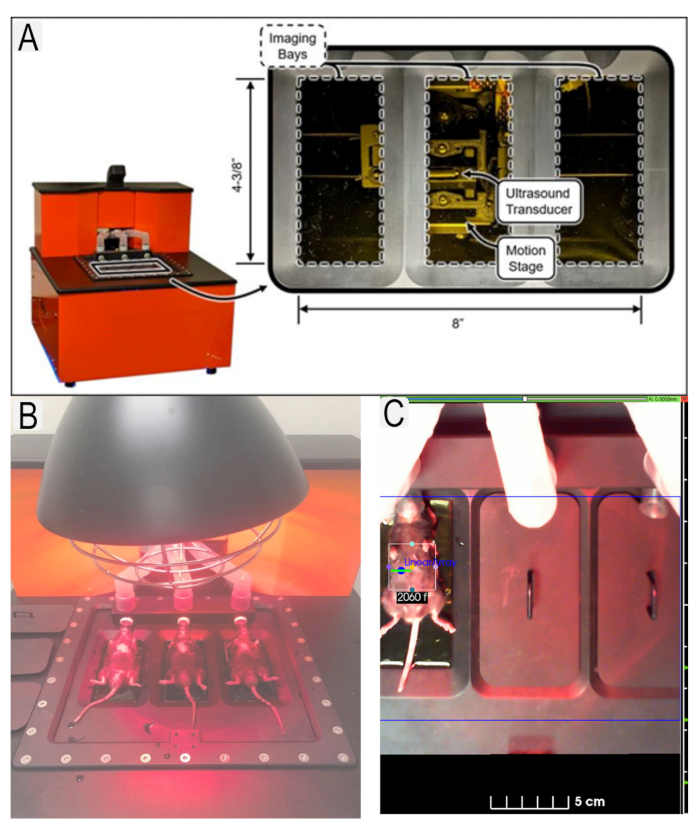
Figure 1: Ultrasound system and mouse placement. (A) Diagram of ultrasound system and location of transducers. (B) View of mice in supine position on ultrasound platform with heat lamp. (C) Example of region of interest (ROI)s in place for area of interest (kidneys) with animal IDs. Please click here to view a larger version of this figure.
to:

Figure 1: Ultrasound system and mouse placement. (A) Diagram of ultrasound system and location of transducers. (B) View of mice in supine position on ultrasound platform. (C) Example of region of interest (ROI)s in place for area of interest (kidneys) with animal IDs. Please click here to view a larger version of this figure.



