13.3: Hız Yasasının Konsantre Hali
Bir reaksiyonun hızı, reaktanların konsantrasyonlarından etkilenir. Hız yasaları (diferansiyel hız yasaları) veya hız denklemleri, bir kimyasal reaksiyonun hızı ile reaktanlarının konsantrasyonu arasındaki ilişkiyi tanımlayan matematiksel ifadelerdir.
Örneğin, a ve b'nin stokiyometrik katsayılar olduğu genel bir reaksiyon olan aA + bB ⟶ Ürünler; oran yasası şu şekilde yazılabilir:
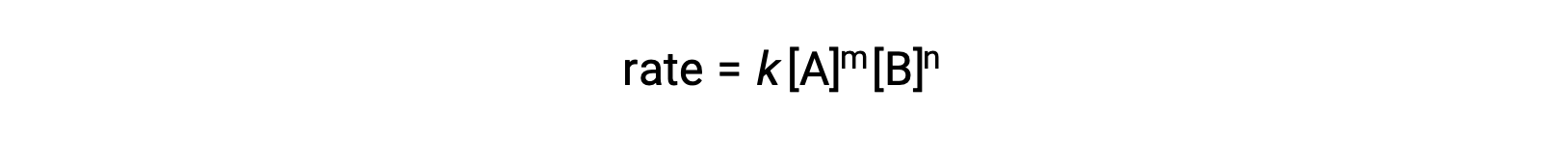
[A] ve [B], reaktanların molar konsantrasyonlarını temsil eder ve k, belirli bir sıcaklıkta belirli bir reaksiyon için spesifik olan hız sabitidir.
m ve n üsleri reaksiyon sıralarıdır ve genellikle pozitif tamsayılardır, ancak kesirler, negatif veya sıfır da olabilirler.
Hız sabiti k ve reaksiyon sıraları m ve n, reaktanların konsantrasyonları değiştikçe bir reaksiyon hızının nasıl değiştiği gözlemlenerek deneysel olarak belirlenir. Hız sabiti k, reaktan konsantrasyonlarından bağımsızdır, ancak sıcaklığa göre değişir.
Bir hız yasasındaki reaksiyon sıraları, hızın reaktan konsantrasyonlarına matematiksel bağımlılığını tanımlar. Genel oran yasasına (hız = k[A]m[B]n) bakıldığında, reaksiyon B'ye göre A ve n mertebesine göre m mertebesidir.Örneğin, m = 1 ve n = 2 ise, reaksiyon A'da birinci mertebedir ve ikinci B. Genel reaksiyon sırası, her reaktan için sıraların toplamıdır. Buradaki örnek oran yasası için, reaksiyon genel olarak üçüncü derecedir (1 + 2 = 3).
Oran yasalarının belirlenmesine yönelik yaygın bir deneysel yaklaşım, başlangıç oranlarının yöntemidir. Bu yöntem, farklı başlangıç reaktan konsantrasyonları kullanılarak gerçekleştirilen çoklu deneysel denemeler için reaksiyon hızlarının ölçülmesini içerir. Bu denemeler için ölçülen hızların karşılaştırılması, birlikte bir oran yasasını formüle etmek için kullanılan reaksiyon sıralarının ve ardından hız sabitinin belirlenmesine izin verir.
Hız yasaları bazı reaktanlar için kesirli sıralar gösterebilir ve bazen bir reaktantın konsantrasyonundaki bir artış reaksiyon hızında bir düşüşe neden olduğunda negatif reaksiyon sıraları gözlemlenir. Hız yasalarının yalnızca deneyle belirlendiğini ve reaksiyon stokiyometrisi ile güvenilir bir şekilde tahmin edilmediğini unutmamak önemlidir.
Reaksiyon sırası, reaksiyon hızı ile reaktanların veya ürünlerin konsantrasyonu arasındaki ilişkiyi belirler.
• Sıfır dereceli bir reaksiyonda, reaktanların konsantrasyonu, reaksiyon boyunca sabit kalan reaksiyon hızı üzerinde herhangi bir etkiye sahip değildir.
• Birinci dereceden bir reaksiyonda, reaksiyon hızı, reaktan konsantrasyonundaki değişiklikle doğrudan ve doğrusal orantılıdır. Reaktan konsantrasyonu azaldıkça, reaksiyon hızı da orantılı olarak azalır.
• İkinci dereceden veya daha yüksek dereceden reaksiyonlarda, reaksiyon hızı, reaktanların üstel değeriyle orantılıdır. Bu nedenle, reaksiyon ilerledikçe ve reaktanların konsantrasyonu azaldıkça, reaksiyon hızı üssel olarak azalır.
Bu metin bu kaynaktan uyarlanmıştır Openstax, Chemistry 2e, Section 12.3: Rate Laws.


