Summary
Aqui nós apresentamos um método para validar a cauda veia injeções em ratos utilizando infravermelho fluorescência dados de imagem de corantes incorporados agentes ou sondas biológicas. A cauda é fotografada antes e após a injeção, o sinal fluorescente é quantificado, e é feita uma avaliação da qualidade da injeção.
Abstract
Administração intravenosa (IV) dos agentes para a veia da cauda de ratos pode ser difícil e inconsistente. Otimizando a cauda veia injeções é uma parte fundamental de muitos procedimentos experimentais onde os reagentes precisam ser introduzidos directamente na corrente sanguínea. Involuntariamente, a injeção pode ser subcutânea, possivelmente alterando os resultados científicos. Utilizando uma sonda biológica baseada em Nanoemulsão com uma tintura (NIRF) fluorescente infravermelho incorporada, este método oferece a capacidade de uma bem sucedido cauda veia da injeção in vivo. de imagem Com o uso de um gerador de imagens NIRF, imagens são tiradas antes e após a injeção do agente. Uma injeção IV aceitável é qualitativamente ou quantitativamente determinada com base na intensidade do sinal NIRF no local da injeção.
Introduction
A via de administração dos agentes em pequenos animais serve como um ponto crítico de muitas experiências. Ele determina onde o agente está para ser entregue e, posteriormente, o que acontecerá com o agente posteriormente. Embora outras vias podem ser usadas para agente administração1, via venosa de entrega é uma rota preferencial para determinados agentes. Injeção IV permite que os agentes ser injetado diretamente na corrente sanguínea, ignorando os efeitos do tecido de primeira passagem e a necessidade de absorption1 estranhos de soluto. Isto também permite direcionamentos células na corrente sanguínea de2,3 e entrega direta para todos os tecidos dentro do sistema circulatório. Em roedores, várias veias podem ser consideradas, incluindo a jugular, a safena e a veia da cauda.
Neste método, um NIRF tingir contendo uma sonda biológica — neste caso, uma Nanoemulsão (figura 1A),3,4,5,6— é injetado na veia lateral da cauda de ratos. Este particular Nanoemulsão contendo NIRF tenha sido usado anteriormente para a imagem e faixa neuroinflammation in vivo e ex vivo7,8 em um modelo de rato9 de dor neuropática2,3,4, 5,10,11. Imagem é realizada antes e após a injeção com um Imageador de fluorescência NIR pré-clínicos (ver Tabela de materiais). Isto serve como uma ferramenta para validar a qualidade da administração do agente. Imagem latente antes do cauda veia injeção serve como base para a obtenção de uma imagem de linha de base.
Cada vez mais em estudos com animais, administrada por via intravenosa Nanoemulsões estão sendo utilizados como sondas biológicas e direcionamento agentes12,13,14,15. É um desafio comprovado para administrar um agente através da veia de cauda16,17— seja uma droga, um vetor viral ou outra sonda — e para garantir que todo o conteúdo da injeção com êxito entrou na corrente sanguínea e não o de tecidos circundantes17. Portanto, um método de Visualizar e avaliar a qualidade de uma bem sucedida injeção é benéfico.
Normalmente, uma lâmpada de calor ou água quente é usada para aquecer a cauda, o que provoca a dilatação da veia, permitindo sua visualização antes da injeção. Enquanto isso garante fácil entrada na veia, não há uma forma quantitativa de discernir se o composto entrou na corrente sanguínea em sua totalidade18,19,20,21. Isso se torna mais difícil ainda em cepas de animais onde a veia contrasta fracamente com a pele, como nos ratos pretos. Normalmente, o investigador pode calibrar uma injeção de falha por experimentando resistência durante a injeção e, em alguns casos, visualizando uma protuberância na cauda, indicando um vazamento subcutâneo da agente22,23.
Neste estudo, imagem latente de NIRF da Nanoemulsão injetado na veia lateral da cauda de ratos vivos é realizada em um pequeno animal NIRF sistema de imagem (consulte a Tabela de materiais). Ratos são alimentados com um especial purificado dieta (veja a Tabela de materiais) para reduzir a fluorescência de intestino inespecífica. Aquisição de imagem simultânea de luz branca e 800 nm de fluorescência é capturada usando o Imageador NIRF e software associado. A intensidade relativa da fluorescência é medida na cauda os Estados pre-injeção e injeção de pós. A intensidade de fluorescência para a região de interesse (ROI) no local da injeção é gravada e dividida pela área do ROI. Avaliações qualitativas podem ser feitas em que as injeções são aceitáveis. Opcionalmente, mais análise quantitativa pode ser realizada estabelecendo limiares para injeções aceitáveis e atribuindo as medições de ROI em grupos, em que ponto pode ser calculada a significância estatística.
Utilizando esta estratégia de validação após injeções de veia da cauda, o padrão de um estudo de pesquisa melhora devido a maior coerência da administração do agente. Este método de avaliação da qualidade de injeção de veia da cauda pode ser facilmente personalizado para diferentes agentes injetáveis incluir infravermelho sondas fluorescentes comercialmente fornecidas por várias empresas.
Protocol
Todos os protocolos foram realizados em conformidade com as diretrizes do guia para o cuidado e o uso de animais de laboratório do National Institutes of Health e institucional Cuidado Animal e Comissão de utilização (IACUC) na Universidade de Duquesne.
1. preparação e anestesia
Nota: São utilizadas técnicas assépticas para a totalidade do processo. Novos materiais estéreis e autoclavados instrumentos esterilizados são apenas para ser usado. Equipamentos de proteção individual (luvas estéreis, gorro de cabelo, máscara cirúrgica, scrubs) precisa ser usado para evitar contaminação.
- Utilizaram-se ratos Sprague-Dawley macho adulto pesando 250 – 300 g neste protocolo. Aclimatar os ratos para as condições de vida padrão, mantê-los em um ciclo 12 h luz/12 h escuro e fornecer comida e água ad libitum. O animal de casa socialmente, mantê-los na cama de papel e fornecer um especial dieta (veja a Tabela de materiais) para evitar a autofluorescência durante a imagem latente.
- Com o uso de uma almofada de aquecimento corretamente colocado, anestesia o animal sob um isoflurano inicial de 5% em 20% de oxigênio, seguido por um nível de manutenção não inferior a 1,5% de isoflurano e não mais de 3%, a menos que o animal acorda ou mantém o sentimento.
- Confirme a anestesia adequada através de uma falta de resposta à cauda pitadas. Monitore o fluxo de sangue também através de sinais vitais durante o procedimento.
2. aquisição de imagem pre-injeção
- Imagem do animal em um Imageador de fluorescência NIR pré-clínicos posicionando o animal lateralmente para expor o local da injeção na cauda lateral para estabelecer uma base de fluorescência na cauda (Figura 1C, E). Realize uma aquisição de imagem simultânea de ambos uma luz branca (vista do corpo) e perto de canais infravermelhos usando o Imageador NIRF e software associado, com tabelas de pesquisa vinculado (LUT).
- Imagem latente, a seguir mover o animal de volta para a mesa cirúrgica e colocá-lo sob anestesia injectável de veia da cauda.
Nota: Continuar a acompanhar os sinais vitais do animal e verificar novamente a anesthetization adequada através de pitada de cauda.
3. cauda veia injeção com agente NIRF-contendo
-
Com o animal na posição de bruços, Oriente a cauda com o lado dorsal voltada para cima. Dilate a vasculatura de cauda em água quente por um período mínimo de 1 min. Oriente a cauda da veia para que o lado lateral (direito ou esquerdo) viraram 30° (no sentido horário ou anti-horário) expor a veia da cauda direita ou esquerda (Figura 1B).
- Uma vez que uma veia lateral da cauda foi localizada (que aparece escura com dilatação), desinfectar a cauda inteira com almofadas do álcool, repetindo 2x.
- Em uma dosagem apropriada, baseada no projeto de estudo, começa injeções na região vértebras coccígeas distal da cauda e movendo-se mais proximal se a colocação da agulha apropriada falhar.
- Introduza uma agulha estéril de 25-27 G, chanfro, na veia lateral da cauda, com a cauda em um ângulo de 180°, inserindo a agulha paralela à cauda levantada. Observe o flashback de sangue na borda da agulha para garantir o correto posicionamento. Se nenhum flashback é aparente, mova lentamente a ponta da agulha (sem removê-lo da cauda) para encontrar a veia de inserção. Se colocados por via subcutânea, sem flashback de sangue irá ocorrer.
- Insira a seringa com os materiais injetáveis na orla da agulha. Quando o posicionamento adequado é alcançado, o fluido injetável não incorrerá em resistência após a injeção. A injeção vai avançar suavemente e facilmente. Uma vez injetado, remover a agulha e a seringa, aplique pressão com gaze estéril pelo menos 1 min assegurar a coagulação e marcar o local da injeção com uma caneta na cauda, garantindo que é visível na imagem de luz branca.
Nota: Nenhum hematoma ou lesão será visível no local da injeção. - Se a ponta da agulha se move durante a inserção de seringa, retire a agulha e repita o procedimento de entrada da agulha mais proximal na veia da cauda ipsilateral. Não reutilize a mesma agulha, se um ponto diferente de reentrada é tentado.
Nota: Alternativamente, a injeção pode ser realizada com cateter IV com um indicador de fluxo sanguíneo (ver Tabela de materiais). Isto tem o benefício de confirmação visual do cateter durante a punção venosa. Introduza o cateter, bisel lateral, o ângulo descrito anteriormente. Observe o flashback alerta em todo o comprimento do indicador de fluxo de sangue para garantir o correto posicionamento. Ligeira pressão traseira pode ser usado para puxar o sangue para a seringa para confirmar a colocação apropriada no vaso antes de injetar. Novamente, nenhuma resistência será sentida.
4. aquisição de imagens pós-injeção de
- Realize a avaliação da qualidade após injeção de veia de cauda em um gerador de imagens de fluorescência NIR pré-clínicos na mesma orientação como a imagem de pre-injeção de linha de base. Garantir que o animal é anestesiado ainda corretamente — e o será para a duração da imagem — antes de colocá-lo na câmera.
Nota: Um sistema de imagens contendo um conexões de anestesia housingwith gaveta e uma máscara para o animal deve ser usado se estiver disponível. - Oriente o animal de lado lateral para expor o local da injeção (conforme marcado) na cauda lateral. Verificar se um sinal NIRF está presente apenas no local da injeção. Isto indica uma injeção de veia de cauda bem sucedida (Figura 1D).
Nota: Se o sinal está dispersa por toda a cauda inteira, considera-se ser subcutâneo e, portanto, sem sucesso (Figura 1-F). A Figura 2 mostra exemplos adicionais de injeções falhou.
5. quantificação de imagem
Nota: Quantificação de imagem pode ser executada com o software de imagem que acompanha a câmera NIR, se essa função está disponível. Alternativamente, outro software de análise de imagem comercialmente disponível pode ser usado24.
- Na imagem pós-injeção, desenhe um região de interesse em torno da área da fluorescência no local da injeção,2,6.
- Medir a área e intensidade de fluorescência relativo e registro como área/intensidade. Comparar imagens de pré-injeção de pós-injeção e linha de base também qualitativamente ou quantitativamente por meio de análise estatística adequada (dependente de grupos de estudo e condições).
Nota: O pesquisador pode decidir sobre limiares que discriminam bem de injeções ruins ou atribuir um percentual de qualidade para a injeção.
Representative Results
Ratos foram injetados com Nanoemulsão contendo NIRF na veia lateral da cauda, e imagens pré e pós-injeção foram tiradas com a câmera de pequenos animais (Tabela de materiais), conforme descrito no protocolo. Pós-injeção imagens qualitativamente são avaliados em relação à qualidade de injeção e colocadas na 'boa injeção' (n = 7) e 'injeção de ruim' (n = 4) grupos. Avaliação qualitativa foi realizada observando-se a intensidade de fluorescência área pós-injeção. Em uma injeção ideal, o sinal NIRF limita-se ao local da injeção. Nenhum sinal será visto se a injeção é bem sucedida porque o agente foi totalmente deslocado para a corrente sanguínea. Uma injeção de má qualidade exibe um sinal NIRF que se dispersa ao longo do comprimento da cauda.
Imagens foram analisadas com o software que acompanha do Imageador NIRF. Regiões de interesse foram desenhados no site de imagens da pre-injeção (Figura 1C, E) e ao redor da área de fluorescência em imagens pós-injeção (Figura 1D, F). Imagens onde a fluorescência era visível em todo o comprimento da cauda foram consideradas inaceitáveis e removidas a partir da análise (Figura 2). Medições da área e fluorescência intensidade foram registradas. Valores de intensidade de fluorescência/área foram calculados e plotagem (Figura 1G). Diferença significativa (unpaired t-teste) em fluorescência intensidade entre imagens pré e pós-injeção foi observada no grupo 'injeção ruim' (Figura 1G) (p = 0.0024).
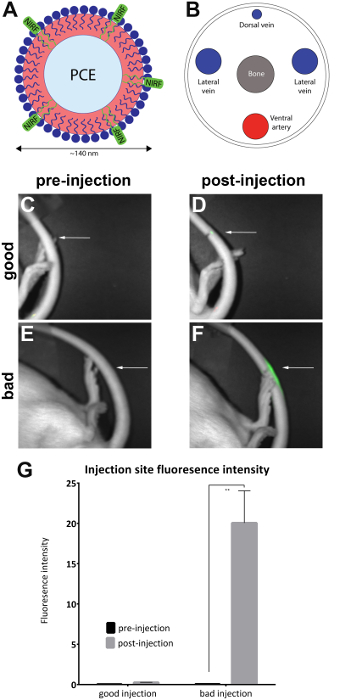
Figura 1 : NIRF com base em imagens da veia da cauda e Nanoemulsão. (A), A sonda biológica baseada em Nanoemulsão contendo corante NIRF foi injectada na veia de cauda (B), o lateral e fotografada em um gerador de imagens NIRF. (C e D) pré e postinjection imagens de uma injeção de bom. (E e F) pré e postinjection imagens de uma injeção de ruim. As setas brancas indicam o ponto de injeção. É possível avaliar qualitativamente o sucesso de uma boa injeção em comparação com uma injeção ruim, avaliando a extensão do sinal NIRF no local da injeção. Injeções de inaceitáveis exibir fluorescência em todo o comprimento da cauda e foram retiradas da análise (Figura 2). (G) as imagens também podem ser analisadas para revelar uma medida quantitativa da intensidade de fluorescência, com limiares para a qualidade de injeção atribuído pelo investigador. As barras de erro no gráfico refletem o SEM. Para o grupo de 'boa injeção', n = 7. Para o grupo 'injeção ruim', n = 4. Há uma diferença estatística na intensidade de fluorescência no grupo 'injeção mal' ao comparar imagens pré e postinjection (unpaired t-teste; p = 0.0024). Clique aqui para ver uma versão maior desta figura.

Figura 2 : Exemplos de injeções maus. (A) sinal fluorescente visto em parte da cauda. (B) sinal fluorescente visto ao longo de todo o comprimento da cauda. (C) sinal fluorescente fortemente dispersa na zona caudal do corpo do animal e cauda inteira. Clique aqui para ver uma versão maior desta figura.
Discussion
Laboratórios de pesquisa incorrer em custos significativos, como resultado da má administração dos agentes de testes. Injeções de veia da cauda são uma técnica difícil de dominar para atingir a taxa de sucesso consistente, com os mais experientes dos Tecnólogos muitas vezes incorrer em erros de má administração. Não há nenhuma maneira confiável para confirmar uma injeção bem sucedida. Este protocolo oferece uma solução para este problema, dando um método qualitativo e quantitativo para validar o sucesso de uma injeção de veia da cauda murino-pesquisadores. Aqui, uma Nanoemulsão com rótulo NIRF7,8,25 incorpora o agente de escolha (no caso, uma droga) e é fotografada no local da injeção em um sistema de imagem pequeno-animal NIRF. Há também a opção de desenvolver um agente não baseados em Nanoemulsão e usar o mesmo princípio de imagem NIRF incorporando corantes comercialmente disponíveis do infravermelho. Além disso, ready-to-use agentes de imagem com uma variedade de aplicações, tais como imagens de tumor, metabólico da imagem latente, cela tráfico, e apoptose também está disponíveis comercialmente. A injeção é realizada utilizando uma agulha estéril ou, alternativamente, um cateter IV; Isso depende da preferência do pesquisador. Além disso, cauda automatizado veia injectores26 têm sido utilizados para ajudar neste processo e são compatíveis com esta metodologia. No entanto, esta tecnologia não ainda se tornou comercialmente disponível.
Há passos importantes no método de injeção de veia de cauda que garantem uma maior taxa de administração agente correto. Primeiro, a cauda deve ser limpos com álcool para remover qualquer sujeira ou detritos, permitindo que os pesquisadores para melhor Visualizar a veia. Dilatando a veia submergindo a cauda na água morna também é um passo muito importante no método, pois permite uma maior área de superfície para a injeção. Injetar em um ponto mais distal da veia da cauda permite algum erro, no caso em que várias tentativas são necessárias. Injeção deve ser tentada em uma posição mais proximal na cauda como a veia da cauda aumenta de tamanho, como é abordado o aspecto caudal do corpo do animal. Além disso, a veia da cauda contralateral pode ser usada se a colocação da agulha falhar em mais de três a cinco sites na veia da cauda ipsilateral.
Uma administração bem sucedida de um agente de teste resulta em pouco ou nenhum sinal NIRF no ponto de injeção. Se a resistência não é sentida durante a administração da injeção e há pouca ou nenhuma fluorescência na cauda, então a injeção pode ser gravada tanto sucesso. Se sentir resistência durante a injeção, e há um rasto de NIRF sinal ao longo de um comprimento da cauda, em seguida, a injeção é registrada como vencida e é provável parcialmente subcutâneo. Fluorescência são tomadas imagens pré e pós-injeção, e a qualidade da injeção é avaliada pela observação qualitativa ou quantitativamente analisando o sinal de fluorescência no local da injeção. O software que acompanha o tonalizador de fluorescência NIR é frequentemente capaz de realizar esta análise.
O método pode ser adaptado de diversas maneiras. É aplicável à cauda veia injeção em camundongos e ratos. A maioria das impressoras a fluorescência NIR pequeno-animal será capazes de acomodar murino roedores. Níveis de anestesia precisam ser ajustada dependendo do peso do animal, em conformidade com o protocolo IACUC do laboratório de pesquisa. Outra modificação possível é a preparação de uma sonda não baseados em Nanoemulsão incorporando um corante infravermelho para agente formulado do pesquisador ou através da compra de um agente de imagem ready-to-use, sob medida para uma aplicação específica biológica.
Se um rato é relativamente grande, muitas vezes pode ser difícil para posicioná-la no tonalizador de pequenos animais. Assim, recomenda-se uma imagem de teste com o animal na gaveta antes de injetar, e um campo de visão apurada onde a cauda é visível. É útil para fita a cauda para a gaveta da câmera, para garantir que ele não se move durante a imagem latente.
Métodos alternativos, buscando avaliar a qualidade da veia de cauda injeções em pequenos animais limitam-se a utilização de reagentes que não interfira com procedimentos experimentais simultâneos e exigem a eutanásia de postinjection os animais de rotulagem 12,13. Alguns reagentes podem afetar os resultados do estudo e a avaliação terapêutica dos animais envolvidos, então recomenda-se cuidado em delineamento experimental.
Este método pode, no futuro, ser refinado com avanços na tecnologia de imagem pequeno-animal, bem como melhorias no infravermelhas sondas fluorescentes. Sondas biológicas com um corante de infravermelho incorporada, projetado para uma variedade de diferentes aplicações, podem ser usadas na fase de administração agente de um projeto de estudo para validar a qualidade de uma injeção, conforme descrito no presente método2,3 ,,27,28,29,30,31,32.
Disclosures
Os autores não têm nada para divulgar.
Acknowledgments
Princesa e J.M.J. projetaram conjuntamente a abordagem experimental para avaliar Nanoemulsões no modelo de rato de lesão crônica de constrição para efeitos na dor neuropática. J.M.J. concebida e projectada a abordagem de entrega de drogas global macrófago-alvo com Nanoemulsões, Nanoemulsão composição e processos de fabricação. J.M.J. produzido a Nanoemulsão, que era ainda mais fabricada por L.L. sob a orientação de J.M.J. A estabilidade da Nanoemulsão foi avaliada pela assistência J.M.J., L.L. e S.P. Animal, cirurgia, comportamento, injeções de veia da cauda, e imagem latente de NIRF foram realizadas conjuntamente pelo M.S. e A.M.S. sob a orientação de princesa O manuscrito foi escrito e preparado por M.S., e o protocolo foi escrito por A.M.S.
Imagem latente ótica NIR realizou-se no sistema da imagem latente de pequeno Animal na Universidade de Duquesne (suportado pela Pittsburgh tecido engenharia iniciativa Seed subvenção). J.M.J. reconhece apoio do número de prêmio DOD FA8650-17-2-6836, NIDA prêmio número 1R21DA039621-01, número de prêmio NIBIB R21EB023104-02 e AFMSA prêmio número FA8650-17-2-6836. Princesa e J.M.J reconhece apoio de Pittsburgh tecido engenharia iniciativa Seed subvenção. Princesa também reconhece o Hunkele temida doença Award, o Samuel e Emma invernos Foundation, Charles Henry Leach II fundo e o prêmio realce pesquisa Universal do Commonwealth. Princesa e J.M.J. reconhece o apoio do reitor Duquesne University Inaugural interdisciplinar consórcios bolsa de investigação, que suporta o consórcio de pesquisa de dor crônica.
Materials
| Name | Company | Catalog Number | Comments |
| 100% Oxygen air tank | AirGas Heathcare | n/a | For ventilation of animal. |
| 70% Ethanol | Multiple sources | n/a | |
| Alcohol Pads | Henry Schein | 112-6131 | |
| Artificial Tears | Henry Schein | 100-2634 | This protects the rats eyes while it is anesthetized. |
| Beaker | Multiple sources | n/a | This holds warm water to dilate the tail veins. |
| Distilled water | Multiple sources | n/a | |
| Exhaust Fans | Hazard Technologies | n/a | For ventilation of lab, if it is not built in. |
| Face Mask | Multiple sources | n/a | |
| Gas Chamber with tubing and face mask | Multiple sources | n/a | |
| Gauze Pads | Henry Schein | 100-2634 | |
| Hair Bonnet | Multiple sources | n/a | |
| Heating Lamp | Multiple sources | n/a | |
| Heating Pad | Multiple sources | n/a | |
| Isoflurane | Southmedic Inc. | ND66794-013-25 | |
| Padded Bench Cloth | Box Board Products Inc. | 026755100I | |
| Pearl Small Animal Imager | Li-COR Biosciences | ||
| Pearl Trilogy Small Animal Imaging System | LI-COR Biosciences | n/a | Quote available via manufacturers web site. Other manufacturers such as Perkin Elmer (VisEn Medical FMT) offer preclinical NIR fluoresence imagers. |
| Scrubs, lab coat, shoe covers | Multiple sources | n/a | |
| Sharps container | Multiple sources | n/a | |
| special diet | Research Diets, Inc, New Brunswick, NJ | ||
| Sprague-Dawley rats | Hilltop Animals, Springdale, PA | ||
| Sterile injection cap | Multiple sources | n/a | |
| Sterile needle, 27 G | Multiple sources | n/a | |
| SURFLO IV Catheter, 24 G, yellow | TERUMO | SR+OX2419C1 | This is an alternative to using a sterile needle. It provides additional indication of correct venous insertion. |
| Surgical gloves | Multiple sources | n/a | |
| Surgical Tape | Multiple sources | n/a |
References
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: routes of administration and factors to consider. Journal of the American Association for Laboratory Animal Science: JAALAS. 50 (5), 600-613 (2011).
- Janjic, J. M., et al. Low-dose NSAIDs reduce pain via macrophage targeted nanoemulsion delivery to neuroinflammation of the sciatic nerve in rat. Journal of Neuroimmunology. 318, 72-79 (2018).
- Patel, S. K., Beaino, W., Anderson, C. J., Janjic, J. M. Theranostic nanoemulsions for macrophage COX-2 inhibition in a murine inflammation model. Clinical Immunology. 160 (1), 59-70 (2015).
- Patel, S. K., Janjic, J. M. Macrophage targeted theranostics as personalized nanomedicine strategies for inflammatory diseases. Theranostics. 5 (2), 150-172 (2015).
- Patel, S. K., Zhang, Y., Pollock, J. A., Janjic, J. M. Cyclooxgenase-2 inhibiting perfluoropoly (ethylene glycol) ether theranostic nanoemulsions-in vitro study. PLOS ONE. 8 (2), 55802 (2013).
- Liu, L., Bagia, C., Janjic, J. M. The First Scale-Up Production of Theranostic Nanoemulsions. BioResearch Open Access. 4 (1), 218-228 (2015).
- Patel, S. K., Patrick, M. J., Pollock, J. A., Janjic, J. M. Two-color fluorescent (near-infrared and visible) triphasic perfluorocarbon nanoemuslions. Journal of Biomedical Optics. 18 (10), 101312 (2013).
- O'Hanlon, C. E., Amede, K. G., O'Hare, M. R., Janjic, J. M. NIR-labeled perfluoropolyether nanoemulsions for drug delivery and imaging. Journal of Fluorine Chemistry. 137, 27-33 (2012).
- Bennett, G. J., Xie, Y. K. A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man. Pain. , (1988).
- Vasudeva, K., et al. In vivo and systems biology studies implicate IL-18 as a central mediator in chronic pain. Journal of Neuroimmunology. 283, 43-49 (2015).
- Vasudeva, K., et al. Imaging neuroinflammation in vivo in a neuropathic pain rat model with near-infrared fluorescence and (1)(9)F magnetic resonance. PLOS ONE. 9 (2), 90589 (2014).
- Cheng, Y., Liu, M., Hu, H., Liu, D., Zhou, S. Development, Optimization, and Characterization of PEGylated Nanoemulsion of Prostaglandin E1 for Long Circulation. AAPS PharmSciTech. 17 (2), 409-417 (2016).
- Fofaria, N. M., Qhattal, H. S., Liu, X., Srivastava, S. K. Nanoemulsion formulations for anti-cancer agent piplartine--Characterization, toxicological, pharmacokinetics and efficacy studies. International Journal of Pharmaceutics. 498 (1-2), 12-22 (2016).
- Ganta, S., et al. EGFR Targeted Theranostic Nanoemulsion for Image-Guided Ovarian Cancer Therapy. Pharmaceutical Research. 32 (8), 2753-2763 (2015).
- Shah, L., Kulkarni, P., Ferris, C., Amiji, M. M. Analgesic efficacy and safety of DALDA peptide analog delivery to the brain using oil-in-water nanoemulsion formulation. Pharmaceutical Research. 31 (10), 2724-2734 (2014).
- Maruyama, H., et al. High-level expression of naked DNA delivered to rat liver via tail vein injection. Journal of Gene Medicine. , (2002).
- Hibbitt, O. C., et al. Delivery and long-term expression of a 135 kb LDLR genomic DNA locus in vivo by hydrodynamic tail vein injection. Journal of Gene Medicine. , (2007).
- Sebestyén, M. G., et al. Mechanism of plasmid delivery by hydrodynamic tail vein injection. I. Hepatocyte uptake of various molecules. Journal of Gene Medicine. , (2006).
- Budker, V. G., et al. Mechanism of plasmid delivery by hydrodynamic tain vein injection. II. Morphological studies. Journal of Gene Medicine. , (2006).
- Lecocq, M., et al. Uptake by mouse liver and intracellular fate of plasmid DNA after a rapid tail vein injection of a small or a large volume. Journal of Gene Medicine. , (2003).
- Park, S., Park, H. -M., Sun, S. -H. Single-dose Intravenous Injection Toxicity of Water-soluble Danggui Pharmacopuncture (WDP) in Sprague-Dawley Rats. Journal of Pharmacopuncture. 21 (2), 104-111 (2018).
- Zhang, X., et al. Activatable fluorescence detection of epidermal growth factor receptor positive mediastinal lymph nodes in murine lung cancer model. PLOS ONE. 13 (6), 0198224 (2018).
- Liu, G., et al. Tracking of transplanted human umbilical cord-derived mesenchymal stem cells labeled with fluorescent probe in a mouse model of acute lung injury. International Journal of Molecular Medicine. 41 (5), 2527-2534 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Janjic, J. M., Srinivas, M., Kadayakkara, D. K., Ahrens, E. T. Self-delivering nanoemulsions for dual fluorine-19 MRI and fluorescence detection. Journal of the American Chemical Society. 130 (9), 2832-2841 (2008).
- Chang, Y. -C., et al. An Automated Mouse Tail Vascular Access System by Vision and Pressure Feedback. IEEE/ASME Transactions on Mechatronics. 20 (4), 1616-1623 (2015).
- Chen, Q., et al. Theranostic imaging of liver cancer using targeted optical/MRI dual-modal probes. Oncotarget. 8 (20), 32741-32751 (2017).
- Tansi, F. L., et al. Activatable bispecific liposomes bearing fibroblast activation protein directed single chain fragment/Trastuzumab deliver encapsulated cargo into the nuclei of tumor cells and the tumor microenvironment simultaneously. Acta Biomaterialia. 54, 281-293 (2017).
- Li, S., Johnson, J., Peck, A., Xie, Q. Near infrared fluorescent imaging of brain tumor with IR780 dye incorporated phospholipid nanoparticles. Journal of Translational Medicine. , (2017).
- Gao, M., Yu, F., Lv, C., Choo, J., Chen, L. Fluorescent chemical probes for accurate tumor diagnosis and targeting therapy. Chemical Society Reviews. , (2017).
- Wang, R., Han, X., You, J., Yu, F., Chen, L. Ratiometric Near-Infrared Fluorescent Probe for Synergistic Detection of Monoamine Oxidase B and Its Contribution to Oxidative Stress in Cell and Mice Aging Models. Analytical Chemistry. 90 (6), 4054-4061 (2018).
- Han, X., Song, X., Yu, F., Chen, L. A Ratiometric Near-Infrared Fluorescent Probe for Quantification and Evaluation of Selenocysteine-Protective Effects in Acute Inflammation. Advanced Functional Materials. 27 (28), 1700769 (2017).



