ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
संपर्क अतिसंवेदनशीलता (सीएचएस) एलर्जी संपर्क जिल्द की सूजन (एसीडी) का एक प्रयोगात्मक मॉडल है। सीएचएस छाती और पेट की मुंडा त्वचा को चित्रित करके प्रतिक्रियाशील हैप्टेन के साथ संवेदीकरण पर आधारित है, बाद में एक पतला हैप्टेन के साथ कान की त्वचा की चुनौती के साथ, सूजन प्रतिक्रिया का कारण बनता है जिसका विभिन्न तरीकों से मूल्यांकन किया जाता है।
Abstract
संपर्क अतिसंवेदनशीलता (सीएचएस) एलर्जी संपर्क जिल्द की सूजन (एसीडी) का एक प्रयोगात्मक मॉडल है जिसका अध्ययन चूहों में किया जा सकता है। इस अध्ययन का उद्देश्य एक उद्देश्य प्रयोगशाला विधि प्रस्तुत करना है जो चूहों में सीएचएस प्रतिक्रिया का अध्ययन करने में मदद कर सकता है, जिसे विभिन्न परीक्षणों द्वारा मापा और परिमाणित किया जा सकता है। सीएचएस को प्रेरित करने के लिए, दिन "0" पर, चूहों को एसीटोन-इथेनॉल मिश्रण में हैप्टेन 2,4,6-ट्रिनिट्रोक्लोरोबेंजीन (टीएनसीबी) के साथ पेट की त्वचा पेंटिंग द्वारा पहले से मुंडा स्थान पर संवेदनशील बनाया गया था, जबकि नकारात्मक नियंत्रण चूहों को वाहन अकेले-एसीटोन-इथेनॉल मिश्रण के साथ संवेदनशील बनाया गया था। दिन "4" पर, आधारभूत कान की मोटाई को परीक्षण और नियंत्रण समूहों दोनों में पतला टीएनसीबी के साथ दोनों कानों को चित्रित करके सीएचएस (चुनौती) की प्राप्ति से पहले एक माइक्रोमीटर के साथ मापा गया था। 24 घंटे के बाद, कान की सूजन को माइक्रोमीटर के साथ मापा गया था। सीएचएस एक टी सेल-मध्यस्थता प्रतिरक्षा प्रतिक्रिया का एक उदाहरण है जो सूजन वाले ऊतक में सूजन का कारण बनता है, एक ही हैप्टेन के साथ त्वचा की चुनौती के बाद 24 घंटे तक पहुंच जाता है। संवर्धित कान के वजन, मायलोपरोक्सीडेज (एमपीओ) गतिविधि, कान के अर्क में प्रो-भड़काऊ साइटोकिन एकाग्रता, हिस्टोलॉजिकल परीक्षा में एडिमेटस डर्मिस के मोटा होने में वृद्धि और कान संवहनी पारगम्यता के साथ सहसंबद्ध कान की सूजन में वृद्धि। नियंत्रण चूहों की तुलना में परीक्षण समूह के सीरा में टीएनपी-विशिष्ट आईजीजी 1 एंटीबॉडी की एकाग्रता में भी वृद्धि हुई थी। इसके अतिरिक्त, सीएचएस को पहले टीएनसीबी के साथ संवेदनशील दाताओं से प्राप्त सीएचएस-प्रभावक कोशिकाओं के साथ सफलतापूर्वक स्थानांतरित किया जा सकता है। सीएचएस-इफेक्टर कोशिकाओं को भोले प्राप्तकर्ता चूहों में अंतःशिरा रूप से प्रशासित किया गया था, जिन्हें बाद में उसी पतला हैप्टेन के साथ चुनौती दी गई थी। कान की सूजन को 24 घंटे बाद माइक्रोमीटर से मापा गया।
Introduction
एलर्जी संपर्क जिल्द की सूजन (एसीडी) औद्योगिक देशों में एक सामान्य त्वचा भड़काऊ बीमारी है जो हैप्टेंस नामक कम आणविक भार रसायनों के संपर्क में आने के परिणामस्वरूप टाइप IV अतिसंवेदनशीलता प्रतिक्रिया के कारण होती है। मनुष्यों में संपर्क संवेदीकरण पैदा करने वाले पदार्थों में भारी धातु आयन (क्रोमियम, निकल, लोहा, कोबाल्ट), तारपीन, सुगंध, रंजक और सौंदर्य प्रसाधनों में मौजूद संरक्षक (जैसे, पी-फेनिलेनेडियामाइन), कुछ दवाएं (जैसे, नियोमाइसिन, बेंजोकेन), β-लैक्टम एंटीबायोटिक्स (यानी, पेनिसिलिन), पौधों द्वारा उत्पादित रसायन (पेंटाडेका) शामिल हैं . एसीडी एटिओलॉजिकल एजेंट बहुत अधिक हैं क्योंकि अकेले उद्योग में 100,000 से अधिक रसायनों का उपयोग किया जाता है, और हर साल 2,000 नए संश्लेषित होते हैं। आज तक, 3,700 से अधिक अणुओं की पहचान की गई है जो संपर्क हैप्टेंस / एलर्जी हो सकते हैं3. संपर्क अतिसंवेदनशीलता प्रतिक्रिया (सीएचएस) एसीडी का एक प्रयोगात्मक मॉडल है जिसका अध्ययन चूहों, गिनी सूअरों और चूहों में किया जा सकता है और कार्बनिक सॉल्वैंट्स 4,5,6 में भंग प्रतिक्रियाशील रासायनिक हैप्टेंस के सामयिक त्वचा अनुप्रयोग से प्रेरित किया जा सकता है। इस अध्ययन का उद्देश्य एक उद्देश्य प्रयोगशाला पद्धति का वर्णन करना है जो चूहों में सीएचएस प्रतिक्रिया का अध्ययन करने में मदद कर सकता है, जिसे विभिन्न परीक्षणों द्वारा मापा और परिमाणित किया जा सकता है।
सीएचएस में संवेदीकरण (प्रेरण) और प्रभावक (चुनौती) चरण होते हैं। पशु मॉडल में, हैप्टेंस पहले नियोएंटिजन बनाने के लिए शरीर में प्रोटीन के लिए सहसंयोजक रूप से बांधते हैं। संवेदीकरण चरण के दौरान, सक्रिय केराटिनोसाइट्स प्रो-भड़काऊ साइटोकिन्स-ट्यूमर नेक्रोसिस फैक्टर α (टीएनएफ-α) और इंटरल्यूकिन 1β (आईएल -1β)7 का उत्पादन करके त्वचा डेंड्राइटिक कोशिकाओं (एसडीसी) के प्रवास और परिपक्वता को बढ़ावा देते हैं। एपिडर्मल लैंगरहैंस कोशिकाएं (एलसी) सीएचएस प्रेरण और प्रभावक चरणों 8 के दौरान एंटीजन पेश करतीहैं। संवेदीकरण के दौरान हैप्टेन के संपर्क में आने वाले एलसी नियामक और प्रभावकारी कोशिकाओं दोनों के प्रेरण को बढ़ावादेते हैं 9. कई अध्ययनों से बढ़ते सबूत बताते हैं कि सीएचएस प्रतिक्रियाओं को सीडी 4 + एमएचसी कक्षा द्वितीय-प्रतिबंधित टीएच 1 कोशिकाओं द्वारा मध्यस्थता की जा सकती है, स्थानीय रूप से इंटरफेरॉन-γ (आईएफएन-γ) को एक विशिष्ट भड़काऊ घुसपैठ, सीडी 8 + एमएचसी वर्ग I-प्रतिबंधित टीसी 1 लिम्फोसाइटों को नियोजित करने के लिए जारी किया जा सकता है जो आईएफएन-γ भी जारी कर सकते हैं लेकिन ज्यादातर केराटिनोसाइट्स को साइटोटॉक्सिक क्षति की मध्यस्थता कर सकते हैं, और अब इंटरल्यूकिन भी 17 (आईएल -17) 11.
विभिन्न प्रजातियों को नियोजित करने वाले कई अलग-अलग सीएचएस मॉडल1 2,13,14 और हैप्टेंस विकसित किए गए हैं (विभिन्न हैप्टेंस, सॉल्वैंट्स और आवेदन के समय की विस्तृत तुलना तालिका 1 में संक्षेप में दी गई है)। माउस, अक्सर इस्तेमाल की जाने वाली प्रयोगशाला प्रजाति, सीएचएस का अध्ययन करने में कुछ फायदे प्रदान करती है। अन्य प्रजातियों की तुलना में चूहों के बीच अधिक उपभेद, नॉकआउट (केओ), और ट्रांसजेनिक जानवर हैं, जो उन्हें एक बहुत ही आकर्षक जानवर बनाता है15. इसके अलावा, सीएचएस मॉडल को कई जानवरों की आवश्यकता होती है, और चूहे यहां अधिक किफायती होते हैं। पशु मॉडल सभी पहलुओं में एसीडी की नकल नहीं करते हैं; विशेष रूप से, वे क्रस्टिंग और डिस्क्वामेशन दिखाते हैं, जो मनुष्यों के लिए आम नहीं है16,17. पुरानी बीमारी की विशेषताएं प्रजनन करने के लिए चुनौतीपूर्ण हैं, मुख्यतः क्योंकि वर्णित मॉडल लंबे समय तक हैप्टेन के आवेदन को नहीं मानता है। हालांकि, यहां यह पुष्टि की गई है कि एसीडी के कई महत्वपूर्ण पहलुओं को पुन: पेश किया जाता है। यह भी दिखाया गया है कि, मनुष्यों की तरह, ये विशेषताएं स्थानीय एलर्जी प्रतिक्रियाओं से जुड़ी हैं। हैप्टेन की पसंद, इसके विलायक, और इस प्रोटोकॉल में उल्लिखित इसके आवेदन को इस तथ्य से निर्धारित किया गया था कि परिणामों की पुष्टि कई इन विट्रो परीक्षणों द्वारा की गई है और वर्तमान संस्करण स्थापित होने तक कई वर्षों तक प्रयोगशाला में इसका परीक्षण और संशोधन किया गया था। म्यूरिन मॉडल सेल सबसेट या साइटोकिन्स के विश्लेषण की अनुमति देते हैं जो एसीडी के विकास में शामिल हैं और नए उपचारों के प्रीक्लिनिकल आकलन के लिए आवश्यक हैं।
Subscription Required. Please recommend JoVE to your librarian.
Protocol
इस लेख में प्रस्तुत सभी प्रयोग क्राको में पशु परीक्षण पर पहली स्थानीय नैतिक समिति के दिशानिर्देशों के अनुसार आयोजित किए गए थे। वर्णित सभी प्रक्रियाओं को स्थानीय सिफारिशों के अनुसार किया गया था, विशेष रूप से एक संवेदनाहारी के रूप में केटामाइन / ज़ाइलाज़िन का उपयोग करने के बारे में, पदार्थ / हैप्टेन को लागू करने के लिए कान के दोनों किनारों का उपयोग करना, कान को काटना, और नेत्रगोलक हटाने से रक्त एकत्र करना। सी (हैप्लोटाइप एच -2डी), सीबीए / जे (एच -2के), और सी 57 बीएल / 6 (एच -2बी) नर और मादा चूहों, 6-12 सप्ताह पुराने, का उपयोग वर्तमान अध्ययन के लिए किया गया था ( सामग्री की तालिका देखें)। सांख्यिकीय महत्व के लिए, यह सबसे अच्छा है यदि चूहों के प्रत्येक समूह में 10-12 जानवर होते हैं।
1. पशु तैयारी
- सभी प्रक्रियाओं से पहले और बाद में 70% इथेनॉल समाधान के साथ ऑपरेटिंग टेबल को साफ करें। यदि चूहों का उपयोग करते हुए बाँझ स्थितियों की आवश्यकता होती है, तो जैव सुरक्षा कैबिनेट में सभी ऑपरेशन करें।
2. पहचान के लिए चूहों को चिह्नित करना
- रेजर ब्लेड के साथ त्वचा को शेविंग करके चूहों को लेबल करें: # 0 - अचिह्नित, # 2 - दाएं सामने के पंजे पर, # 3 - दाईं ओर, # 4 - दाएं हिंद पंजा पर, # 5 - पूंछ के आधार पर, # 6 - बाएं हिंद पंजा पर, # 7 - बाईं ओर, # 8 - बाएं सामने के पंजे पर।
नोट: प्रेरित प्रतिक्रिया के कारण, चूहों को कान छिद्रण या टैगिंग द्वारा शास्त्रीय रूप से चिह्नित नहीं किया जा सकता है। लेबलिंग करते समय चूहों को संवेदनाहारी नहीं किया गया था।
3. सीएचएस का प्रेरण
नोट: इस प्रक्रिया को चित्र 1 में दर्शाया गया है।
- नीचे दिए गए चरणों का पालन करते हुए संवेदीकरण (प्रेरण) करें।
- दिन "0" पर, पानी के साथ ग्रे साबुन लगाने और रेजर ब्लेड के साथ शेविंग करके छाती और पेट (वर्ग 2 सेमी x 2 सेमी) पर चूहों को दाढ़ी दें।
नोट: हैप्टेन लगाने से पहले, 6 घंटे तक प्रतीक्षा करें ताकि त्वचा चिढ़ न हो। - एसीटोन-इथेनॉल मिश्रण (अनुपात 1: 3) या अकेले वाहन (एसीटोन-इथेनॉल) में 5% हैप्टेन: 2,4,6-ट्रिनिट्रोक्लोरोबेंजीन (टीएनसीबी, सामग्री की तालिका देखें)। कांच की शीशी में उपयोग करने से ठीक पहले समाधान तैयार करें और एल्यूमीनियम पन्नी के साथ शीशी को कवर करके इसे प्रकाश से बचाएं।
- उसी दिन, पहले मुंडा स्थान पर 5% हैप्टेन के 150 μL लागू करके चूहों को संवेदनशील बनाएं। नियंत्रण चूहों के समूह में, गैर-विशिष्ट भड़काऊ प्रतिक्रिया का आकलन करने के लिए अकेले वाहन लागू करें। जानवर को पिंजरे में वापस डालने से पहले, 30 एस तक प्रतीक्षा करें, हैप्टेन को सूखने दें।
सावधानी: दस्ताने का प्रयोग करें; टीएनसीबी ज्यादातर लोगों में गंभीर एलर्जी की प्रतिक्रिया का कारण बनता है।
- दिन "0" पर, पानी के साथ ग्रे साबुन लगाने और रेजर ब्लेड के साथ शेविंग करके छाती और पेट (वर्ग 2 सेमी x 2 सेमी) पर चूहों को दाढ़ी दें।
- एलिसिटेशन (चुनौती) और कान की सूजन माप करें।
- दिन "4" पर, एसीटोन-इथेनॉल मिश्रण (अनुपात 1: 1) में 0.4% हैप्टेन: टीएनसीबी तैयार करें। कांच की शीशी में उपयोग करने से ठीक पहले समाधान तैयार करें और शीशी को एल्यूमीनियम पन्नी के साथ कवर करके प्रकाश से बचाएं।
- गहरी संज्ञाहरण के लिए केटामाइन (90-120 मिलीग्राम / किग्रा) और ज़ाइलाज़िन (5-10 मिलीग्राम / किग्रा) (सामग्री की तालिका देखें) के मिश्रण के इंट्रापेरिटोनियल (आईपी) इंजेक्शन के साथ चूहों को संवेदनाहारी करें। सुनिश्चित करें कि माउस पैर की अंगुली चुटकी द्वारा कम से कम 5 मिनट के लिए पूरी तरह से संवेदनाहारी है।
- प्रयोगात्मक समूहों से अनजान एक पर्यवेक्षक द्वारा एक माइक्रोमीटर ( सामग्री की तालिका देखें) के साथ कान की मोटाई (0 एच माप, बेसलाइन) को मापें।
- दोनों समूहों (परीक्षण और नियंत्रण) में कान के दोनों किनारों पर 0.4% हैप्टेन के 10 μL लागू करें। जानवर को पिंजरे में वापस डालने से पहले, 30 एस तक प्रतीक्षा करें और हैप्टेन को सूखने दें।
- दिन "5" पर, हैप्टेन आवेदन के बाद 24 घंटे, 24 घंटे माप के लिए चरण 3.2.2-3.2.3 दोहराएं।
- हैप्टेन के साथ चुनौती से पहले और बाद में ऑरिकल मोटाई में अंतर की गणना करके सीएचएस प्रतिक्रिया का मूल्यांकन करें: 24 घंटे कान की मोटाई (μm) - 0 h कान की मोटाई (μm)। प्रत्येक कान को एक अलग माप के रूप में गिनें। अगला, माध्य (एसईएम) (तालिका 2, चित्रा 3) की मानक त्रुटि ± माइक्रोमीटर (μm) में कान की सूजन व्यक्त करें।
4. कान की बायोप्सी
- कान की मोटाई के 24 घंटे माप के बाद सीधे (जब माउस अभी भी गहरी संज्ञाहरण के तहत है), कैंची के साथ जितना संभव हो उतना खोपड़ी के करीब कान काट लें। बायोप्सी पंच का उपयोग करके 6 मिमी व्यास पंच बनाकर कानों के डिस्टल साइड से बायोप्सी इकट्ठा करें ( सामग्री की तालिका देखें)।
- कान के वजन (चरण 4.2) को मापें और इसके अतिरिक्त एक ही कान बायोप्सी पर निम्नलिखित परीक्षणों में से एक करें: मायलोपेरोक्सीडेज (एमपीओ) परख (चरण 4.3) या कान के अर्क में साइटोकिन एकाग्रता के इन विट्रो माप (जैसे, आईएफएन -γ, आईएल -17 ए, टीएनएफ -α [चरण 4.4])।
नोट: रक्त संग्रह से पहले कान काट लें। इस प्रक्रिया के बाद, चूहों को इच्छामृत्यु दी जानी चाहिए (उदाहरण के लिए, ग्रीवा अव्यवस्था द्वारा)।
- कान के वजन (चरण 4.2) को मापें और इसके अतिरिक्त एक ही कान बायोप्सी पर निम्नलिखित परीक्षणों में से एक करें: मायलोपेरोक्सीडेज (एमपीओ) परख (चरण 4.3) या कान के अर्क में साइटोकिन एकाग्रता के इन विट्रो माप (जैसे, आईएफएन -γ, आईएल -17 ए, टीएनएफ -α [चरण 4.4])।
- विश्लेषणात्मक संतुलन पर प्रत्येक कान बायोप्सी के वजन को मापने और मिलीग्राम (मिलीग्राम) (चित्रा 4) में व्यक्त करते हैं।
- नीचे दिए गए चरणों का पालन करते हुए एक एमपीओ परख करें।
- 50 एमएमओएल फॉस्फोरेट बफर केएच 2 पीओ4/ना2एचपीओ 4 में 0.5% हेक्साडेसिलट्रिमिथाइलमोनियम ब्रोमाइड को भंगकरके होमोजेनाइजेशन बफर तैयार करें और पीएच को 6.0 में समायोजित करें (कमरे के तापमान, आरटी पर उपयोग करें)।
- 5 मिमी व्यास स्टेनलेस स्टील मोती के साथ एक होमोजेनाइज़र का उपयोग करके 10 मिनट के लिए तैयार बफर के 500 μL के साथ 2 एमएल माइक्रोसेंट्रिफ्यूज ट्यूबों में बायोप्सी को समरूप करें ( सामग्री की तालिका देखें)। अगला, 4 डिग्री सेल्सियस पर 15 मिनट के लिए नमूना ठंडा करें और इसे अतिरिक्त 10 मिनट के लिए होमोजेनाइज करें।
नोट: माइक्रोसेंट्रिफ्यूज ट्यूबों में एक गोल तल होता है ताकि मोती आसानी से स्थानांतरित हो सकें। - 30 मिनट के लिए -20 डिग्री सेल्सियस पर होमोजेनेट्स फ्रीज करें। पिघलना और भंवर (सुनिश्चित करें कि नमूने पिघल गए हैं)। इस प्रक्रिया को 3x दोहराएं।
- 4 डिग्री सेल्सियस पर 30 मिनट के लिए 3,000 एक्स जी पर होमोजेनेट्स अपकेंद्रित्र। एक पिपेट के साथ सतह पर तैरनेवालों की कटाई करें। प्रोटीन के प्रति 1 मिलीग्राम इकाइयों (यू) में एमपीओ गतिविधि व्यक्त करें।
नोट: प्रोटोकॉल यहाँ रोका जा सकता है। नमूने 3 महीने के लिए -20 डिग्री सेल्सियस पर स्थिर हैं। - एमपीओ गतिविधि को मापने के लिए, सतह पर तैरनेवाला के 20 μL और एमपीओ सब्सट्रेट के 200 μL (केएच 2 पीओ 4/एनए2एचपीओ4 बफर के 50 एमएमओएल में ऑर्थो-डायनिसिन डाइहाइड्रोक्लोराइड के 0.167 मिलीग्राम / एमएल) को 5 एक्स 10−4% एच202 के साथ बफर करके एक एंजाइमेटिक प्रतिक्रिया करें और96-अच्छी तरह से फ्लैट-बॉटम प्लेटों में जोड़ें। आरटी पर 20 मिनट के लिए प्लेटों सेते हैं।
- एमपीओ सब्सट्रेट के 200 μL में 0.008 U से 0.5 U तक सांद्रता पर एमपीओ मानक के 20 μL का उपयोग करके मानक वक्र तैयार करें। अकेले एमपीओ सब्सट्रेट के साथ रिक्त नमूना तैयार करें।
सावधानी: ऑर्थो-डायनिसिन डायहाइड्रोक्लोराइड के साथ काम करते समय मास्क का उपयोग करें।
नोट: प्लेटों को पॉलीप्रोपाइलीन से बना होना चाहिए, जिसमें कम बाध्यकारी क्षमता होती है ताकि प्रोटीन या डीएनए बाध्य न हों। - ω = 460 एनएम की तरंग दैर्ध्य पर ऑप्टिकल घनत्व (ओडी) को मापें। एंजाइमी प्रतिक्रिया 10 मिनट के लिए स्थिर है। मानक वक्र से परीक्षण किए गए नमूनों में एमपीओ गतिविधि पढ़ें।
- प्रोटीन एकाग्रता को मापने के लिए, सतह पर तैरनेवाला के 20 μL का उपयोग करें, प्रोटीन निर्धारण के लिए एक बिकिनकोनिनिक एसिड किट के साथ एक परीक्षण करें ( सामग्री की तालिका देखें), और λ = 562 एनएम (चित्रा 5) पर आयुध डिपो को मापें।
- कान निकालने में साइटोकिन्स के इन विट्रो माप प्रदर्शन।
- 5 मिमी व्यास स्टेनलेस स्टील मोती के साथ एक होमोजेनाइज़र का उपयोग करके 10 मिनट के लिए ऊतक प्रोटीन निष्कर्षण अभिकर्मक (टी-पीईआर) के 500 μL के साथ 2 एमएल माइक्रोसेंट्रिफ्यूज ट्यूबों में आरटी पर कान बायोप्सी को होमोजेनाइज करें (दो मोती / अगला, 4 डिग्री सेल्सियस पर 15 मिनट के लिए नमूना ठंडा करें और इसे अतिरिक्त 10 मिनट के लिए होमोजेनाइज करें।
नोट: माइक्रोसेंट्रिफ्यूज ट्यूबों में एक गोल तल होता है ताकि मोती आसानी से स्थानांतरित हो सकें। - 4 डिग्री सेल्सियस पर 30 मिनट के लिए 3,000 एक्स जी पर होमोजेनेट्स अपकेंद्रित्र।
नोट: प्रोटोकॉल यहाँ रोका जा सकता है। नमूने 6 महीने के लिए -80 डिग्री सेल्सियस पर स्थिर हैं। - निर्माता के निर्देशों (चित्रा 6) का पालन करते हुए व्यावसायिक रूप से उपलब्ध एलिसा सेट (जैसे, आईएफएन -γ) (सामग्री की तालिका देखें) का उपयोग करके साइटोकिन स्तरों का आकलन करें।
- 5 मिमी व्यास स्टेनलेस स्टील मोती के साथ एक होमोजेनाइज़र का उपयोग करके 10 मिनट के लिए ऊतक प्रोटीन निष्कर्षण अभिकर्मक (टी-पीईआर) के 500 μL के साथ 2 एमएल माइक्रोसेंट्रिफ्यूज ट्यूबों में आरटी पर कान बायोप्सी को होमोजेनाइज करें (दो मोती / अगला, 4 डिग्री सेल्सियस पर 15 मिनट के लिए नमूना ठंडा करें और इसे अतिरिक्त 10 मिनट के लिए होमोजेनाइज करें।
5. कान के ऊतकों की ऊतक विज्ञान
- कान की मोटाई के 24 घंटे माप के बाद सीधे, जब माउस अभी भी गहराई से संवेदनाहारी है, कैंची (चरण 4.1) के साथ जितना संभव हो सके खोपड़ी के करीब कान काट लें।
नोट: इस प्रक्रिया के बाद, चूहों को इच्छामृत्यु दी जानी चाहिए (उदाहरण के लिए, गर्भाशय ग्रीवा अव्यवस्था द्वारा)। - नीचे दिए गए चरणों का पालन करते हुए ऊतक ब्लॉकों के पैराफिन एम्बेडिंग करें।
- हटाने के तुरंत बाद, कान को 24 घंटे के लिए 10% फॉर्मलिन के ~ 10 एमएल में रखें।
- कानों को एक ऊतक प्रसंस्करण कैसेट में रखें। निर्जलीकरण चक्र (अल्कोहल 70%, 90%, 100%, आरटी पर प्रत्येक 30 मिनट), समाशोधन चक्र (जाइलीन 3x, आरटी पर 30 मिनट प्रत्येक), और मोम घुसपैठ चक्र (पैराफिन 3x, 56 डिग्री सेल्सियस पर 30 मिनट प्रत्येक) के लिए एक स्वचालित प्रोसेसर ( सामग्री की तालिका देखें) में कैसेट रखें।
- स्वचालित प्रोसेसर से कैसेट निकालें, और आवश्यकता पड़ने तक वार्मिंग प्लेट पर रखें। मोम मोल्ड को गर्म मोम (डिस्पेंसर से) के साथ भरें।
- गर्म संदंश के साथ कैसेट से वर्गों को निकालें और उन्हें मोल्ड में रखें; अगला, मोल्ड के शीर्ष पर कैसेट बेस रखें और फिर अधिक मोम से भरें। इसे ठंडे पानी में 30 मिनट के लिए ठंडी प्लेट पर रखें ताकि पैराफिन नमूने से युक्त एक ब्लॉक बनाने के लिए जम जाए।
- अनुभागों ~ 5 μm मोटी कटौती करने के लिए एक रोटरी माइक्रोटोम ( सामग्री की तालिका देखें) का उपयोग करें। उन्हें चपटा करने के लिए एक गर्म स्नान में वर्गों को फ्लोट करें। एक ग्लास माइक्रोस्कोप स्लाइड पर वर्गों उठाओ। अनुभागों स्लाइड का पालन सुनिश्चित करने के लिए उन्हें आरटी पर सूखने की अनुमति दें।
नोट: धुंधला होने के दौरान ऊतक वर्गों के नुकसान को रोकने के लिए चिपकने वाली सामग्री या प्रोटीन कोटिंग्स को लागू करने की आवश्यकता को समाप्त करने वाली स्लाइड्स का उपयोग करें।
- हेमटॉक्सिलिन और ईओसिन (एच एंड ई) धुंधला प्रदर्शन करें।
- निम्नलिखित के साथ 17 धुंधला व्यंजन तैयार करें: जाइलीन (चार व्यंजन), 100% इथेनॉल (पूर्ण शराब) (चार व्यंजन), 90% इथेनॉल, 80% इथेनॉल, 70% इथेनॉल, 50% इथेनॉल, पीबीएस (तीन व्यंजन), हेमटॉक्सिलिन समाधान, ईओसिन समाधान। नीचे दिए गए चरणों के अनुसार स्लाइड्स को एक डिश से दूसरे में स्थानांतरित करें, और आरटी पर सभी प्रदर्शन करें।
नोट: प्रत्येक डिश में प्रक्रिया को लगभग 10x दोहराया जा सकता है (उदाहरण के लिए, यदि 20-स्लाइड डिश का उपयोग किया जाता है, तो तरल पदार्थ को बदले बिना 200 दाग बनाए जा सकते हैं)। - इनक्यूबेटर में 30 मिनट के लिए 65 डिग्री सेल्सियस पर इनक्यूबेशन द्वारा वर्गों को डिपैराफिनाइज करें। 30 मिनट के लिए जाइलीन में स्लाइड विसर्जित करें। 30 मिनट के लिए नई जाइलीन में 1x दोहराएं।
- 5 मिनट के लिए 100% इथेनॉल में स्लाइड विसर्जित करें। 5 मिनट के लिए नए 100% इथेनॉल में 1x दोहराएं। प्रत्येक कमजोर पड़ने में 2 मिनट के लिए इथेनॉल पंक्ति, 90%, 80%, 70%, और 50% में स्लाइड विसर्जित करें।
- 5 मिनट के लिए फॉस्फेट-बफर खारा (पीबीएस) में स्लाइड विसर्जित करें। स्लाइड के ऊतक और पीछे की ओर से अतिरिक्त तरल को मिटा दें।
- 7-8 मिनट के लिए हेमटॉक्सिलिन समाधान ( सामग्री की तालिका देखें) में वर्गों को दाग दें। रिवर्स साइड से 30 सेकंड के लिए बहते पानी में धोएं ताकि वर्गों को नुकसान न पहुंचे। चरण 5.3.4 दोहराएँ।
- 30 एस के लिए ईओसिन समाधान ( सामग्री की तालिका देखें) के साथ अनुभागों को दाग दें। चरण 5.3.5 में वर्णित के रूप में धो लें और फिर चरण 5.3.4 दोहराएं।
- 2 मिनट के लिए 100% इथेनॉल (पूर्ण शराब) में स्लाइड विसर्जित करें। 2 मिनट के लिए नए 100% इथेनॉल में 1x दोहराएं।
- 5 मिनट के लिए जाइलीन में स्लाइड विसर्जित करें। 5 मिनट के लिए नई जाइलीन में 1x दोहराएं।
- आरटी पर 15 मिनट के लिए अनुभागों को सूखने दें एक कवरस्लिप पर बढ़ते माध्यम ( सामग्री की तालिका देखें) की एक बूंद जोड़ें और फिर इसे अनुभाग के शीर्ष पर रखें।
- निम्नलिखित के साथ 17 धुंधला व्यंजन तैयार करें: जाइलीन (चार व्यंजन), 100% इथेनॉल (पूर्ण शराब) (चार व्यंजन), 90% इथेनॉल, 80% इथेनॉल, 70% इथेनॉल, 50% इथेनॉल, पीबीएस (तीन व्यंजन), हेमटॉक्सिलिन समाधान, ईओसिन समाधान। नीचे दिए गए चरणों के अनुसार स्लाइड्स को एक डिश से दूसरे में स्थानांतरित करें, और आरटी पर सभी प्रदर्शन करें।
- 20x या 40x के आवर्धन के तहत एक प्रकाश माइक्रोस्कोप के तहत अनुभाग की जांच करें, और छवियों (चित्रा 7) पर कब्जा।
6. संवहनी पारगम्यता परीक्षण
नोट: वैकल्पिक रूप से कान की मोटाई माप के लिए, एक संवहनी पारगम्यता परीक्षण किया जा सकता है।
- दिन "0" (चरण 3.1.1-3.1.3) पर चूहों को संवेदनशील बनाएं, और फिर, दिन "4" पर, चूहों को संवेदनाहारी करें (चरण 3.2.2) और सीधे कानों पर हैप्टेन लागू करें (चरण 3.2.4), 0 एच कान माप को छोड़कर।
- 23 घंटे के बाद चुनौती पर, चूहों को संवेदनाहारी करें (चरण 3.2.2)।
- डलबेको के फॉस्फेट-बफर खारा (डीपीबीएस) में 1% इवांस ब्लू डाई ( सामग्री की तालिका देखें) के अंतःशिरा (यानी) 8.3 μL /
- इवांस नीले इंजेक्शन के बाद चूहों को फिर से गहरी संज्ञाहरण (चरण 3.2.2) -1 घंटे संवेदनाहारी करें।
- कान बायोप्सी ले लीजिए (चरण 4.1)।
नोट: इस प्रक्रिया के बाद, चूहों को इच्छामृत्यु दी जानी चाहिए (उदाहरण के लिए, गर्भाशय ग्रीवा अव्यवस्था द्वारा)। - ऊतक से डाई निकालें, फॉर्मामाइड के 1 मिलीलीटर युक्त ट्यूबों में कान के घूंसे रखें, और 18 घंटे के लिए 5% सीओ2 के वातावरण में 37 डिग्री सेल्सियस पर सेते हैं।
- आरटी पर 3 मिनट के लिए 3,000 एक्स जी पर बायोप्सी अपकेंद्रित्र एक विंदुक के साथ सतह पर तैरनेवाला ले लीजिए।
- फॉर्मामाइड युक्त रिक्त के खिलाफ 96-अच्छी तरह से फ्लैट-बॉटम प्लेटों में λ = 565 एनएम की तरंग दैर्ध्य पर आयुध डिपो को मापें। रंग 24 घंटे के लिए स्थिर है। मानक वक्र से परीक्षण नमूनों की एकाग्रता पढ़ें (इवांस नीले रंग की सांद्रता का उपयोग डाई / एमएल फॉर्मामाइड के 0.2-30 μg से लेकर) (चित्रा 8)।
नोट: प्लेटों को पॉलीप्रोपाइलीन से बना होना चाहिए, जिसमें कम बाध्यकारी क्षमता होती है ताकि प्रोटीन या डीएनए बाध्य न हों।
7. सीरम संग्रह और एंटी-टीएनपी इम्युनोग्लोबुलिन (आईजीजी 1) एंटीबॉडी माप
- कान बायोप्सी (चरण 4.1) एकत्र करने के बाद, जब माउस अभी भी गहरी संज्ञाहरण के तहत है, चिमटी के साथ नेत्रगोलक को हटा दें, माउस पर कोमल दबाव डालें, और रेट्रो-ऑर्बिटल साइनस से ट्यूब में रक्त इकट्ठा करें (सीरम प्राप्त करने के लिए जेल के साथ शीशी, सामग्री की तालिका देखें)। रक्त एकत्र करने का एक वैकल्पिक तरीका सिरिंज के साथ हृदय को पंचर करना और रक्त एकत्र करना हो सकता है।
नोट: कानों को हटाने के बाद रक्त एकत्र किया जाना चाहिए। रक्त मापदंडों में संभावित अंतर के कारण पूरे अध्ययन में रक्तस्राव की एक ही विधि का उपयोग किया जाना चाहिए18. इस प्रक्रिया के बाद, चूहों को इच्छामृत्यु दी जानी चाहिए (उदाहरण के लिए, गर्भाशय ग्रीवा अव्यवस्था द्वारा)। - कम से कम 6x पलटें, रक्त के थक्के के लिए 30 मिनट प्रतीक्षा करें, और फिर आरटी पर 10 मिनट के लिए 1,300-2,000 एक्स जी पर अपकेंद्रित्र करें।
नोट: प्रोटोकॉल यहाँ रोका जा सकता है। नमूना 6 महीने के लिए -20 डिग्री सेल्सियस पर स्थिर है। - एमएल के संगीत कार्यक्रम में डीपीबीएस में भंग 2,4,6-ट्रिनिट्रोफेनिल (टीएनपी-बीएसए) के साथ संयुग्मित गोजातीय सीरम एल्बुमिन के 50 μL के साथ एक 96-अच्छी तरह से फ्लैट-बॉटम प्लेट कोट करें। इसके बाद, गोजातीय सीरम एल्बुमिन (बीएसए) के साथ दूसरी प्लेट को अकेले डीपीबीएस (पृष्ठभूमि) में 10 μg / एमएल की एकाग्रता पर भंग करें। 4 डिग्री सेल्सियस पर रात भर सेते हैं।
नोट: माउस सीरम में बीएसए के खिलाफ एंटीबॉडी (एबीएस) होते हैं, इसलिए नमूनों को दोनों प्लेटों पर परीक्षण करने की आवश्यकता होती है, और अगला, एक गणना की जानी चाहिए (ओडी टीएनपी-बीएसए - ओडी बीएसए)। - प्लेटों को डीपीबीएस के 300 μL के साथ धो लें जिसमें 0.05% ट्वीन 20 हो। 3x दोहराएं।
- परख पतला (एडी) तैयार करें: 1% बीएसए युक्त डीपीबीएस। आरटी पर 1 घंटे के लिए एडी के साथ कुओं को फिर से धोएं (चरण 7.4)।
- एक आंतरिक मानक (आईएसटीडी) तैयार करें: टीएनसीबी (चरण 3.1.1-3.1.3) के साथ चूहों को संवेदनशील बनाएं, और, संवेदीकरण के 10 दिन बाद, सभी दाताओं (चरण 7.1 और चरण 7.2) से सीरम एकत्र करें और मतदान करें।
- मानक वक्र ( तालिका 3 में वर्णित) बनाने के लिए एडी के साथ पतला आईएसटीडी की वर्गीकृत सांद्रता के प्लेट 50 μL में जोड़ें। सीरम नमूनों की प्लेट 50 μL में जोड़ें। दोनों प्लेटों (टीएनपी-बीएसए और बीएसए लेपित) पर प्रत्येक नमूना और मानक वक्र का परीक्षण करें। आरटी पर 2 घंटे के लिए सेते हैं प्लेटों धो लें (चरण 7.4)।
- बायोटिनिलेटेड एंटी-माउस आईजीजी 1 मोनोक्लोनल एंटीबॉडी के 50 μL जोड़ें (एमएबी, सामग्री की तालिका देखें) एडी के साथ 1:250 पतला और आरटी पर 1 घंटे के लिए सेते हैं।
- हॉर्सरैडिश पेरोक्सीडेज स्ट्रेप्टाविडिन के 50 μL जोड़ें (एचआरडी स्ट्रेप्टाविडिन, सामग्री की तालिका देखें) एडी के साथ 1:2000 पतला, और अंधेरे में आरटी पर 30 मिनट के लिए सेते हैं। प्लेट को धो लें (चरण 7.4)।
- टीएमबी सब्सट्रेट के 50 μL जोड़ें ( सामग्री की तालिका देखें) और अंधेरे में आरटी पर 30 मिनट के लिए सेते हैं।
- 1एम एच 2एसओ4 के 25 μL जोड़कर एंजाइमी प्रतिक्रिया को रोकें; प्रतिक्रिया 30 मिनट के लिए स्थिर है।
- α = 450 एनएम की तरंग दैर्ध्य और 570 एनएम की पृष्ठभूमि पर आयुध डिपो को मापें (पृष्ठभूमि को प्रत्येक 450 एनएम माप से घटाया जाना चाहिए)। परिणाम प्रस्तुत करते समय, नमूनों और मानक वक्र के लिए टीएनपी-बीएसए से बीएसए माप घटाएं। फिर, मानक वक्र (चित्रा 9) के अनुसार एंटीबॉडी की इकाई (यू) की गणना करें।
8. सीएचएस-प्रभावक कोशिकाओं का दत्तक हस्तांतरण
नोट: इस प्रक्रिया को चित्रा 2 में दर्शाया गया है।
- दाताओं (एक दाता: 1 प्राप्तकर्ता के अनुपात में): दिन "0" पर टीएनसीबी के साथ चूहों को संवेदनशील बनाएं (चरण 3.1.1-3.1.3)।
- दिन "4" पर, चूहों-गहरी संज्ञाहरण (चरण 3.2.2) को संवेदनाहारी करें।
- एक्सिलरी और वंक्षण लिम्फ नोड्स (एएलएन) और प्लीहा (एसपीएल) संदंश के साथ अलग करें। एक शीशी में एएलएन और दूसरे में एसपीएल को एक साथ पूल करें।
नोट: प्रत्येक एक्सिला में पेक्टोरल मांसपेशी के पीछे एक एक्सिलरी लिम्फ नोड होता है। कूल्हे क्षेत्र में एक वंक्षण लिम्फ नोड तीन रक्त वाहिकाओं के बगल में स्थित है। प्लीहा आंत और पेट के पीछे शरीर के बाईं ओर स्थित है19. बाँझ परिस्थितियों को बनाए रखने के लिए जैव सुरक्षा कैबिनेट में बाँझ उपकरणों के साथ काम करें। इस प्रक्रिया के बाद, चूहों को इच्छामृत्यु दी जानी चाहिए (उदाहरण के लिए, ग्रीवा अव्यवस्था द्वारा)। - दो माइक्रोस्कोप स्लाइड के पाले सेओढ़ लिया सिरों के बीच ऊतक मैश. 70 μm के ताकना आकार के साथ एक सेल छलनी के माध्यम से सेल निलंबन पास करें ( सामग्री की तालिका देखें)।
- 1% भ्रूण गोजातीय सीरम (एफबीएस) के साथ पूरक डीपीबीएस के साथ कोशिकाओं को धो लें। 4 डिग्री सेल्सियस पर 10 मिनट के लिए 300 एक्स जी पर अपकेंद्रित्र। सतह पर तैरनेवाला डिकेंट और डीपीबीएस के 1-5.0 एमएल में शेष सेल गोली को फिर से निलंबित करें।
- ट्रिपैन ब्लू के साथ हेमोसाइटोमीटर20 का उपयोग करके लाइव कोशिकाओं की गणना करें, और ट्रिपैन ब्लू के 90-990 μL (सेल नंबर के आधार पर) के साथ सेल निलंबन के 10 μL मिलाएं। सेल नंबर (10x-100x) की गणना करते समय कमजोर पड़ने को ध्यान में रखें।
- डीपीबीएस के 200 μL में एएलएन और एसपीएल (अनुपात 1: 1): 8.0 x 106 तक7.0 x 10 7/
- प्राप्तकर्ता (भोले सिंजेनिक चूहे): भोले प्राप्तकर्ता चूहों (चरण 3.2.2) को संवेदनाहारी करें और सीएचएस-प्रभावक कोशिकाओं (चरण 8.7) के तैयार मिश्रण के साथ आईवी इंजेक्ट करें। चूहों के नियंत्रण समूह में, किसी भी कोशिकाओं को इंजेक्ट न करें।
- (0 ज) से पहले कान की मोटाई को मापें और (24 घंटे) चुनौती (चरण 3.2.1-3.2.6) (चित्रा 10)।
- इसके अतिरिक्त, पृथक सीएचएस-प्रभावक कोशिकाओं (जैसे, सेल फेनोटाइपिंग या प्रवाह साइटोमेट्री द्वारा सीएचएस-प्रभावक कोशिकाओं द्वारा उत्पादित साइटोकिन्स की माप) पर परीक्षण करें। सेल संस्कृतियों को भी स्थापित किया जा सकता है, और एंटीजन की उपस्थिति में फैलने के लिए सीएचएस-प्रभावक कोशिकाओं की क्षमता या संस्कृति सतह पर तैरनेवालों में स्रावित साइटोकिन्स की मात्रा का मूल्यांकन21,22 (डेटा प्रस्तुत नहीं किया गया है) किया जा सकता है।
नोट: अतिरिक्त परीक्षण करने के लिए तदनुसार अधिक सेल दाताओं की आवश्यकता होती है।
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
सीएचएस प्रेरण के लिए, जानवरों को त्वचा पेंटिंग (पेट) के माध्यम से 5% टीएनसीबी के 150 μL के साथ संवेदनशील बनाया गया था या अकेले वाहन के साथ शम संवेदनशील बनाया गया था। दिन "4" पर, दोनों कानों की कान सूजन प्रतिक्रियाओं को संपर्क पेंटिंग (चुनौती) द्वारा प्रेरित किया गया था, जिसमें दोनों चूहों में 0.4% टीएनसीबी के 10 μL पहले टीएनसीबी (परीक्षण समूह) और नियंत्रण समूह चूहों (शम संवेदी) के साथ संपर्क किया गया था। प्रस्तुत आंकड़ों से पता चलता है कि टीएनसीबी के साथ संवेदनशील चूहों और 4 दिनों बाद चुनौती दी गई थी, इसी तरह चुनौती दी गई शम-संवेदी लोगों की तुलना में कान की सूजन में काफी वृद्धि हुई है (चित्रा 3, तालिका 2, परीक्षण बनाम नियंत्रण समूह)। कान की सूजन के परिणाम पूरी तरह से आगे के अध्ययन में मान्य थे, इस बात पर प्रकाश डाला गया कि संवर्धित कान के वजन (चित्रा 4), एमपीओ गतिविधि (चित्रा 5), कान के अर्क (चित्रा 6) में आईएफएन-γ एकाग्रता के साथ सहमत माइक्रोमीटर के साथ निर्धारित कान एडिमा में वृद्धि, हिस्टोलॉजिकल परीक्षा (चित्रा 7), और कान संवहनी पारगम्यता (चित्रा 8) में एडिमेटस डर्मिस के मोटा होना में वृद्धि ). नियंत्रण जानवरों (चित्रा 9) की तुलना में टीएनपी-विशिष्ट आईजीजी 1 एंटीबॉडी की एकाग्रता में वृद्धि भी परीक्षण चूहों के सीरा में पाई गई थी।
टी सेल-मध्यस्थता प्रतिरक्षा प्रतिक्रिया के उदाहरण के रूप में, सीएचएस को भोले सिंजेनिक प्राप्तकर्ता चूहों में भी स्थानांतरित किया जा सकता है। दाताओं को टीएनसीबी आवेदन द्वारा संवेदनशील बनाया गया था, और बाद में, सीएचएस-प्रभावक कोशिकाओं को भोले प्राप्तकर्ता चूहों में प्रशासित किया गया था, जिन्हें हैप्टेन के साथ चुनौती दी गई थी और 24 घंटे बाद सीएचएस के लिए परीक्षण किया गया था (चित्रा 10)। जिन जानवरों ने पहले टीएनसीबी के साथ संवेदनशील दाताओं से सीएचएस-प्रभावक कोशिकाओं को प्राप्त किया था, उन जानवरों की तुलना में कान की सूजन में काफी वृद्धि देखी गई थी जिन्हें केवल चुनौती दी गई थी (कोई कोशिका प्राप्त नहीं हुई थी)।
सीएचएस प्रतिक्रिया में एक जटिल तंत्र होता है और इसमें विभिन्न कोशिकाएं शामिल होती हैं। एंटीजन प्रस्तुति और टी / बी सेल सक्रियण परिधीय लिम्फ अंगों (जैसे, एएलएन और एसपीएल) में होता है। यह निर्धारित किया गया था कि सीएचएस-प्रभावक कोशिकाएं सीडी 4 + से कम हो गईं, लेकिन दत्तक सेल हस्तांतरण से पहले सीडी 8 + कोशिकाओं के परिणामस्वरूप प्राप्तकर्ता चूहों में सीएचएस प्रतिक्रिया की अनुपस्थिति हुई। उन कोशिकाओं को आईएफएन-γ (टी-बॉक्स ट्रांसक्रिप्शन फैक्टर टीबीएक्स 21, टीबीईटी +) और आईएल -17 ए (रेटिनोइक एसिड रिसेप्टर से संबंधित अनाथ परमाणु रिसेप्टर गामा, आरओआरटी +) (पूरक चित्रा 1) के लिए सकारात्मक पाया गया था।
प्रतिनिधि प्रयोगों से प्रस्तुत परिणाम 8-12 सप्ताह की उम्र में सी 57 बीएल / 6 और सीबीए / जे नर और मादा चूहों पर किए गए थे। जानवरों के उपयोग में 3 आर नियमों का पालनकरते हुए 23, विशेष रूप से कमी, इस लेख के प्रयोजनों के लिए, प्रयोगों के परिणाम जानवरों के छोटे समूहों पर दिखाए जाते हैं। रेखांकन में डेटा को एसईएम ± माध्य के रूप में दिखाया गया है सांख्यिकीय महत्व पी < 0.05 पर सेट किया गया था। रेखांकन प्रिज्म सॉफ्टवेयर का उपयोग करके तैयार किए गए थे ( सामग्री की तालिका देखें)।

चित्र 1: सीएचएस का प्रेरण। संवेदीकरण, चुनौती और कान माप। संक्षिप्त नाम: सीएचएस = संपर्क अतिसंवेदनशीलता प्रतिक्रिया; टीएनसीबी = 2,4,6-ट्रिनिट्रोक्लोरोबेंजीन। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।

चित्रा 2: सीएचएस-प्रभावक कोशिकाओं का दत्तक हस्तांतरण। संक्षिप्त नाम: एएलएन = एक्सिलरी और वंक्षण लिम्फ नोड्स; सीएचएस = संपर्क अतिसंवेदनशीलता प्रतिक्रिया; आई.वी. = अंतःशिरा; एसपीएल = प्लीहा; टीएनसीबी = 2,4,6-ट्रिनिट्रोक्लोरोबेंजीन। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।

चित्रा 3: एक माइक्रोमीटर के साथ कान की सूजन के माप से टीएनसीबी के लिए सीएचएस का प्रतिनिधि मूल्यांकन। चूहों को टीएनसीबी (परीक्षण समूह) या शम (नियंत्रण समूह) संवेदनशील बनाया गया था और बाद में चुनौती दी गई थी। चुनौती से पहले और बाद में ऑरिकल की मोटाई को मापा गया था, और कान की सूजन में अंतर की गणना 24 घंटे कान की मोटाई (μm) से 0 घंटे कान की मोटाई (μm) को घटाकर की गई थी। कान की सूजन को एसईएम, **** पी < 0.0001, एन = 10 चूहों / समूह ( तालिका 2 से डेटा) के ± मतलब के रूप में व्यक्त किया गया था। संक्षिप्त नाम: सीएचएस = संपर्क अतिसंवेदनशीलता प्रतिक्रिया; एसईएम = माध्य की मानक त्रुटि; टीएनसीबी = 2,4,6-ट्रिनिट्रोक्लोरोबेंजीन। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।

चित्रा 4: कान के वजन के माप से सीएचएस का प्रतिनिधि मूल्यांकन। कान का वजन उन मापदंडों में से एक है जो कान की सूजन से मेल खाता है। चूहों को टीएनसीबी (परीक्षण समूह) या शम (नियंत्रण समूह) संवेदनशील बनाया गया था और बाद में चुनौती दी गई थी। चुनौती के बाद 24 घंटे में, हटाए गए कानों से 6 मिमी व्यास के घूंसे लिए गए थे। घूंसे को विश्लेषणात्मक प्रयोगशाला संतुलन पर तौला गया था। कान का वजन मिलीग्राम (मिलीग्राम) में एसईएम, *** पी < 0.001, एन = 10 चूहों / समूह ± मतलब के रूप में व्यक्त किया गया था। संक्षिप्त नाम: सीएचएस = संपर्क अतिसंवेदनशीलता प्रतिक्रिया; एसईएम = माध्य की मानक त्रुटि; टीएनसीबी = 2,4,6-ट्रिनिट्रोक्लोरोबेंजीन। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।

चित्रा 5: एमपीओ गतिविधि का प्रतिनिधि मूल्यांकन। ऊतक अर्क में बढ़ी हुई एमपीओ गतिविधि कान की सूजन से संबंधित है। टीएनसीबी-संवेदी चूहों (परीक्षण समूह) और शम-संवेदनशील चूहों (नियंत्रण समूह) को चुनौती दी गई थी। 24 घंटे के बाद चुनौती पर, कानों को हटा दिया गया था, और कान के 6 मिमी व्यास के घूंसे निकाले गए और संसाधित किए गए। एमपीओ गतिविधि यू प्रति प्रोटीन सामग्री (प्रोटीन के यू / जी) में व्यक्त की जाती है। एसईएम, ** पी < 0.01, एन = 5-6 चूहों / समूह ± मतलब के रूप में प्रदर्शित परिणाम। संक्षिप्त नाम: सीएचएस = संपर्क अतिसंवेदनशीलता प्रतिक्रिया; एमपीओ = मायलोपरोक्सीडेज; एसईएम = माध्य की मानक त्रुटि; टीएनसीबी = 2,4,6-ट्रिनिट्रोक्लोरोबेंजीन; यू = इकाइयाँ। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।

चित्रा 6: कान के अर्क में साइटोकिन उत्पादन-आईएफएन-γ एकाग्रता का प्रतिनिधि मूल्यांकन। चूहों को टीएनसीबी (परीक्षण समूह) या शम (नियंत्रण समूह) संवेदनशील बनाया गया था और बाद में चुनौती दी गई थी। 24 घंटे के बाद चुनौती पर, कानों को हटा दिया गया था, और कान के 6 मिमी व्यास के घूंसे लिए गए थे। आईएफएन -γ की एकाग्रता एलिसा द्वारा ऊतक होमोजेनेट्स में निर्धारित की गई थी। एसईएम, * पी < 0.05, एन = 5 चूहों / समूह ± मतलब के रूप में दिखाए गए परिणाम। संक्षिप्त नाम: सीएचएस = संपर्क अतिसंवेदनशीलता प्रतिक्रिया; आईएफएन -γ = इंटरफेरॉन गामा; एसईएम = माध्य की मानक त्रुटि; टीएनसीबी = 2,4,6-ट्रिनिट्रोक्लोरोबेंजीन। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।

चित्रा 7: कान के ऊतकों के प्रतिनिधि ऊतक विज्ञान। हेमटॉक्सिलिन और इओसिन धुंधला हो जाना। चूहों को टीएनसीबी (परीक्षण समूह) या शम (नियंत्रण समूह) संवेदनशील बनाया गया था और बाद में चुनौती दी गई थी। (ए-सी) परीक्षण समूह में हिस्टोलॉजिकल परीक्षा भड़काऊ कोशिकाओं (मोनोन्यूक्लियर और पॉलीमोर्फोन्यूक्लियर कोशिकाओं) की काफी बढ़ी हुई एकाग्रता में प्रकट होती है, मुख्य रूप से डर्मिस में, एपिडर्मिस में माइक्रोएब्सेस गठन के साथ। एडिमेटस डर्मिस का मोटा होना और एक मोटा, हाइपरप्लास्टिक एपिडर्मिस भी देखा गया था। (डी-ई) नियंत्रण समूह। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।

चित्रा 8: प्रतिनिधि संवहनी पारगम्यता परीक्षण। मनाया कान ऊतक शोफ संवहनी पारगम्यता में वृद्धि का एक परिणाम है। संवहनी पारगम्यता में परिवर्तन निर्धारित करने के लिए, चूहों को टीएनसीबी (परीक्षण समूह) या शम (नियंत्रण समूह) संवेदनशील बनाया गया था और फिर 4 दिन बाद चुनौती दी गई थी। चुनौती के बाद 23 घंटे में, इवांस ब्लू को इंजेक्ट किया गया था, और इवांस ब्लू इंजेक्शन के 1 घंटे बाद, जानवरों को इच्छामृत्यु दी गई थी, और कान के 6 मिमी व्यास के घूंसे बनाए गए थे। एसईएम, ** पी < 0.01, एन = 5 चूहों / समूह ± माध्य के रूप में दिखाए गए परिणाम। संक्षिप्त नाम: सीएचएस = संपर्क अतिसंवेदनशीलता प्रतिक्रिया; एसईएम = माध्य की मानक त्रुटि; टीएनसीबी = 2,4,6-ट्रिनिट्रोक्लोरोबेंजीन। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।

चित्रा 9: प्रतिनिधि विरोधी टीएनपी आईजीजी 1 एंटीबॉडी माप। सीरम में एंटी-टीएनपी आईजीजी 1 एंटीबॉडी की एकाग्रता को शम संवेदी (नियंत्रण) और टीएनसीबी-संवेदी (परीक्षण समूह) चूहों में हैप्टेन टीएनसीबी के साथ चुनौती के 24 घंटे बाद मापा गया था। एकत्र किए गए सेरा को एलिसा द्वारा एंटीबॉडी एकाग्रता के लिए परीक्षण किया गया था। एसईएम, *** पी < 0.001, एन = 10 चूहों / समूह ± मतलब के रूप में दिखाए गए परिणाम। संक्षिप्त नाम: सीएचएस = संपर्क अतिसंवेदनशीलता प्रतिक्रिया; आईजीजी 1 = इम्युनोग्लोबुलिन जी उपवर्ग 1; एसईएम = माध्य की मानक त्रुटि; टीएनसीबी = 2,4,6-ट्रिनिट्रोक्लोरोबेंजीन। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।

चित्रा 10: सीएचएस-प्रभावक कोशिकाओं के प्रतिनिधि दत्तक हस्तांतरण। सीएचएस-प्रभावक कोशिकाओं को दाताओं से प्राप्त किया गया था जिन्हें टीएनसीबी के साथ संवेदनशील बनाया गया था। इसके बाद, एकत्रित प्रतिरक्षा कोशिकाओं को इंजेक्शन दिया गया था, अर्थात, भोले सिंजेनिक प्राप्तकर्ताओं में, जिन्हें सीएचएस प्रभावक चरण के उत्थान के लिए चुनौती दी गई थी। चूहों के नियंत्रण समूह को चुनौती से पहले कोई कोशिका नहीं मिली। चुनौती से पहले और बाद में ऑरिकल की मोटाई को मापा गया था। एसईएम, *** पी < 0.001, एन = 7 चूहों / समूह ± मतलब के रूप में दिखाए गए परिणाम। संक्षिप्त नाम: सीएचएस = संपर्क अतिसंवेदनशीलता प्रतिक्रिया; एसईएम = माध्य की मानक त्रुटि; टीएनसीबी = 2,4,6-ट्रिनिट्रोक्लोरोबेंजीन। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
| माउस तनाव | संवेदीकरण समाधान (खुराक) मुंडा पेट पर |
एलिसिटेशन समाधान (खुराक) कान के दोनों किनारों पर / |
संवेदीकरण/प्राप्ति दिवस | रेफरी | |||||||||||
| सी (एच -2डी); सी 57 बीएल /6 (एच -2बी) टीसीआरδ-/-, β2 मी-/-, सीडी1डी-/- (बी10 पीएल (एच-2यू बैकग्राउंड) |
एसीटोन-जैतून का तेल मिश्रण में 0.5% डीएनएफबी का 25 μL (अनुपात 4: 1) | एसीटोन-जैतून का तेल मिश्रण में 0.1% डीएनएफबी का 5 μL (अनुपात 4: 1) | 0 / 5 | 22 | |||||||||||
| सी 57 बीएल /6 (एच -2बी) | एसीटोन-जैतून का तेल मिश्रण में 0.5% डीएनएफबी का 50 μL (अनुपात 4: 1) | एसीटोन-जैतून का तेल मिश्रण में 0.2% डीएनएफबी का 25 μL (अनुपात 4: 1) | 0 / 5 | 32 | |||||||||||
| सी 57 बीएल /6 (एच 2बी); आईएल -17 ए -/- (सी 57 बीएल / 6 पृष्ठभूमि) | एसीटोन-इथेनॉल मिश्रण में 5% टीएनसीबी का 150 μL (अनुपात 1: 3) | जैतून का तेल-एसीटोन मिश्रण में 0.4% टीएनसीबी का 10 μL (अनुपात 1: 1) | 0 / 4 | 33 | |||||||||||
| जे (एच -2के); सी 57 बीएल /6 (एच -2बी) टीएलआर 2-/-, माईडी 88-/-, आईएल -17 ए-/- (सी 57 बीएल / |
एसीटोन-इथेनॉल मिश्रण में 5% टीएनपी-सीएल (टीएनसीबी) का 150 μL (अनुपात 1: 3) | जैतून का तेल-एसीटोन मिश्रण में 0.4% टीएनपी-सीएल (टीएनसीबी) का 10 μl (अनुपात 1: 1) | 0 / 4 | 21 | |||||||||||
| सी 57 बीएल / 6 (एच -2बी); बीएएलबी/सी (एच-2डी) | एक एसीटोन में 1% टीएनसीबी का 25 μL | एसीटोन में 0.1 या 0.2% टीएनसीबी का 10 μL (और 1% तक अधिक) | 0 / 7 | 34 | |||||||||||
| सी 57 बीएल / 6 (एच -2बी); टीएलआर 2-/-/टीएलआर 4-/- (सी 57 बीएल / 6 पृष्ठभूमि पर डबल-नॉकआउट चूहों) |
एक एसीटोन में 3% टीएनसीबी का 100 μL | एसीटोन में 1% टीएनसीबी का 20 μL (कानों के पीछे की ओर) | 0 / 5 | 31 | |||||||||||
| सी 57 बीएल /6 (एच -2बी) एमएचसी वर्ग द्वितीय की कमी चूहों (सी 57 बीएल / |
एसीटोन-जैतून का तेल मिश्रण में 3% टीएनसीबी का 100 μL (अनुपात 4: 1) | एसीटोन-जैतून का तेल मिश्रण में 0.5 या 1% टीएनसीबी का 20 μL (अनुपात 4: 1) | 0 / 6 | 35 | |||||||||||
| सी 57 बीएल /6 (एच -2बी) | एक एसीटोन में 7% टीएनसीबी का 100 μL | एक एसीटोन में 20 μL 1% टीएनसीबी | 0 / 5 | 36 | |||||||||||
| सी 57 बीएल /6 (एच -2बी) | इथेनॉल में 100 μL 3% OX | एक इथेनॉल में 20 μL 1% OX | 0 / 5 | ||||||||||||
| सी 57 बीएल / 6 (एच -2बी); सीडी 4-/-, सीडी 8-/- (सी 57 बीएल / | एसीटोन-जैतून का तेल में 0.5% डीएनएफबी का 25 μL (अनुपात 4: 1) | एसीटोन-जैतून का तेल में 0.2% डीएनएफबी का 10 μL (अनुपात 4: 1) | 0 / 5 | 10 | |||||||||||
| सी 57 बीएल / 6 (एच -2बी); सीडी 4-/-, सीडी 8-/- (सी 57 बीएल / | अल्कोहल-एसीटोन में 3% ओएक्स का 150 μL (अनुपात 3: 1) | अल्कोहल-एसीटोन में 10 μL 1% OX (अनुपात 3: 1) | 0 / 5 | ||||||||||||
| सी 57 बीएल / 6 (एच -2बी); एचईएन (एच -2के); टीएलआर 4-/- (सी 3 एच / MyD88-/- (C57BL/6 पृष्ठभूमि) | दोनों कानों के पृष्ठीय पक्ष पर सफेद पेट्रोलेटम में 10% एनआईसीएल2 का 100 मिलीग्राम / | सफेद पेट्रोलेटम में 10% एनआईसीएल2 | 0,1,2 / 23, 24 | 37 | |||||||||||
| एनओडी (एच -2जी 7) एमवाईडी 88-/- (एनओडी पृष्ठभूमि) | एसीटोन और डिब्यूटाइल थैलेट में 0.5% एफआईटीसी का 400 μL | एसीटोन और डिब्यूटाइल थैलेट में 0.1% एफआईटीसी का 10 μL | 0 / 5 | 25 | |||||||||||
तालिका 1: विभिन्न अध्ययनों में सीएचएस मॉडल की तुलना। संक्षिप्त नाम: डीएनएफबी = 1-फ्लोरो-2,4-डिनिट्रोबेंजीन; एफआईटीसी = फ्लोरोसिन आइसोथियोसाइनेट; एनआईसीएल2 = निकल (द्वितीय) क्लोराइड; टीएनसीबी = 2,4,6-ट्रिनिट्रोक्लोरोबेंजीन; टीएनपी-सीएल = ट्रिनिट्रोफेनिल क्लोराइड; ओएक्स = ऑक्साज़ोलोन। कृपया इस तालिका को डाउनलोड करने के लिए यहां क्लिक करें।
| नियंत्रण समूह (नकारात्मक) | परीक्षण समूह (सीएचएस प्रतिक्रिया) | ||||||
| माउस # कान: एल, आर | 0 ज कान की मोटाई [μm] | 24 घंटे कान की मोटाई [μm] | 24 घंटे – 0 घंटे कान की मोटाई [μm] | माउस # कान: एल, आर | 0 ज कान की मोटाई [μm] | 24 घंटे कान की मोटाई [μm] | 24 घंटे – 0 घंटे कान की मोटाई [μm] |
| 1 एल | 365 | 380 | 15 | 1 एल | 345 | 427.5 | 82.5 |
| 1 आर | 335 | 380 | 45 | 1 आर | 340 | 455 | 115 |
| 2 एल | 345 | 355 | 10 | 2 एल | 355 | 475 | 120 |
| 2 आर | 327.5 | 352.5 | 25 | 2 आर | 342.5 | 457.5 | 115 |
| 3 एल | 340 | 370 | 30 | 3 एल | 340 | 460 | 120 |
| 3 आर | 325 | 355 | 30 | 3 आर | 345 | 495 | 150 |
| 4 एल | 335 | 380 | 45 | 4 एल | 357.5 | 432.5 | 75 |
| 4 आर | 340 | 350 | 10 | 4 आर | 335 | 402.5 | 67.5 |
| 5 लीटर | 350 | 380 | 30 | 5 लीटर | 335 | 387.5 | 52.5 |
| 5 आर | 337.5 | 360 | 22.5 | 5 आर | 335 | 425 | 90 |
| 6 एल | 335 | 365 | 30 | 6 एल | 350 | 430 | 80 |
| 6 आर | 340 | 375 | 35 | 6 आर | 342.5 | 405 | 62.5 |
| 7 एल | 345 | 337.5 | 0 | 7 एल | 340 | 502.5 | 162.5 |
| 7 आर | 345 | 335 | 0 | 7 आर | 327.5 | 447.5 | 120 |
| 8 एल | 370 | 380 | 10 | 8 एल | 327.5 | 515 | 187.5 |
| 8 आर | 375 | 355 | 0 | 8 आर | 327.5 | 540 | 212.5 |
| 9 एल | 385 | 370 | 0 | 9 एल | 330 | 415 | 85 |
| 9 आर | 342.5 | 362.5 | 20 | 9 आर | 327.5 | 390 | 62.5 |
| 10 लीटर | 307.5 | 340 | 32.5 | 10 लीटर | 337.5 | 445 | 107.5 |
| 10 आर | 325 | 350 | 25 | 10 आर | 352.5 | 455 | 102.5 |
| औसत | 20.75 | औसत | 108.5 | ||||
| ± एसईएम | 3.245 | ± एसईएम | 9.565 | ||||
तालिका 2: सीएचएस के प्रभावकारी चरण में कान की मोटाई में अंतर की गणना करने का प्रतिनिधि उदाहरण। हैप्टेन के साथ चुनौती से पहले और बाद में ऑरिकल की मोटाई में अंतर की गणना: 24 घंटे कान की मोटाई (μm) - 0 h कान की मोटाई (μm)। प्रत्येक कान एक अलग माप के रूप में गिना जाता है। एसईएम, एन = 20 ± माइक्रोमीटर (μm) में व्यक्त कान की सूजन। संक्षिप्त नाम: एल = बाएं; R = दाएं। कृपया इस तालिका को डाउनलोड करने के लिए यहां क्लिक करें।
| विज्ञापन के साथ आईएसटीडी कमजोर पड़ने | एंटी-टीएनपी आईजीजी 1 एबी (यू / |
| 100x | 250 |
| 200x | 125 |
| 400x | 62.5 |
| 800x | 31.25 |
| 1600x | 15.63 |
| 3200x | 7.8 |
| केवल एडी | 0 |
तालिका 3: एंटी-टीएनपी आईजीजी 1 एबी माप के लिए मानक वक्र के लिए आईएसटीडी की विभिन्न सांद्रता की तैयारी। 100x iSTD कमजोर पड़ने को एंटी-टीएनपी आईजीजी 1 एबी के 250 यू माना जाता था। एडी = परख पतला; आईएसटीडी = आंतरिक मानक; आईजीजी 1 = इम्युनोग्लोबुलिन जी उपवर्ग 1; टीएनपी = 2,4,6-ट्रिनिट्रोफेनिल; यू = इकाइयाँ। कृपया इस तालिका को डाउनलोड करने के लिए यहां क्लिक करें।
पूरक चित्रा 1: सीएचएस-प्रभावक कोशिकाओं का फेनोटाइप। सीएचएस-प्रभावक कोशिकाओं को दाताओं के एएलएन और एसपीएल से प्राप्त किया गया था, जिन्हें पहले टीएनसीबी के साथ संवेदनशील बनाया गया था। (ए) एमएसीएस तकनीक को नियोजित करते हुए, सीएचएस-प्रभावक कोशिकाओं (पूरे एएलएन और एसपीएल) को सीडी 4 + या सीडी 8 + कोशिकाओं से समाप्त कर दिया गया था। इसके बाद, सीएचएस प्रभावक चरण की प्राप्ति से पहले दत्तक सेल हस्तांतरण आयोजित किया गया था। (बी-ई) एक प्रवाह साइटोमेट्री तकनीक का उपयोग करके, सीएचएस-प्रभावक और भोले (भोले चूहों से प्राप्त) कोशिकाओं को विश्लेषण से पहले आईएफएन -γ, टीबीईटी, आईएल -17 ए और आरओआरटी के लिए दाग दिया गया ± था। कोशिकाओं को टीसीआर + सीडी 4 + आबादी के लिए गेट किया गया था। एसईएम, *** पी ± < 0.001, ** पी < 0.01, * पी < 0.05, एन = 4-6 चूहों / संक्षिप्त नाम: एएलएन = एक्सिलरी और वंक्षण लिम्फ नोड्स; सीडी 4 = भेदभाव का क्लस्टर 4; सीएचएस = संपर्क अतिसंवेदनशीलता प्रतिक्रिया; आईएफएन -γ = इंटरफेरॉन गामा; आईएल = इंटरल्यूकिन; एमएसीएस = चुंबकीय-सक्रिय सेल सॉर्टिंग; एनएस = गैर महत्वपूर्ण; आरओआरटी = रेटिनोइक-एसिड-रिसेप्टर से संबंधित अनाथ परमाणु रिसेप्टर गामा; एसईएम = माध्य की मानक त्रुटि; एसपीएल = प्लीहा; टीबीईटी = टी-बॉक्स प्रतिलेखन कारक टीबीएक्स 21; टीसीआरβ = टी सेल रिसेप्टर बीटा; टीएनसीबी = 2,4,6-ट्रिनिट्रोक्लोरोबेंजीन। कृपया इस फ़ाइल को डाउनलोड करने के लिए यहाँ क्लिक करें.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
सीएचएस को हैप्टेंस के माध्यम से प्रेरित किया जाता है, जो त्वचा में स्व-प्रोटीन एंटीजन से बंधता है, जिससे नियोएंटिजन बनते हैं। सीएचएस को एंटीजन-विशिष्ट सीएचएस-इफेक्टर टी कोशिकाओं को परिचालित करने की स्थानीय बाह्य भर्ती द्वारा मध्यस्थता की जाती है, जिसके परिणामस्वरूप चुनौतीपूर्ण ऊतक में सूजन होती है, जो माध्यमिक त्वचा के संपर्क में आने के बाद 24 घंटे तक पहुंच जातीहै। ऊतक की सूजन मुख्य रूप से ल्यूकोसाइट्स और ल्यूकोसाइट-निर्भर फाइब्रिन जमाव24 की घुसपैठ के कारण होती है। इन परिवर्तनों को हैप्टेन-संवेदी और चुनौतीपूर्ण बनाम शम-संवेदी और चुनौतीपूर्ण चूहों के कान की सूजन को मापने वाले माइक्रोमीटर के साथ पता लगाया जा सकता है।
कान के वजन की तुलना से भी सीएचएस निर्धारित किया जा सकता है। फिर, कान के वजन निर्धारण के लिए उपयोग किए जाने वाले कान के घूंसे का उपयोग आगे के परीक्षणों के लिए किया जा सकता है। सूजन वाले कानों में कोशिका घुसपैठ में साइटोकिन-उत्पादक टी लिम्फोसाइट्स और एमपीओ-पॉजिटिव न्यूट्रोफिल होते हैं। कान के ऊतकों में, विभिन्न मापदंडों को मापा जा सकता है, जैसे कि एमपीओ गतिविधि या प्रो-भड़काऊ साइटोकिन्स की एकाग्रता (जैसे, टीएनएफ-α, आईएफएन -γ, आईएल -17 ए, या अन्य) एलिसा परीक्षण या क्यूपीसीआर परीक्षण25 का उपयोग करके त्वचा में साइटोकिन एमआरएनए की अभिव्यक्ति का उपयोग करके। इसके अतिरिक्त, इवांस ब्लू टेस्ट21,26 का उपयोग करके पोत पारगम्यता परिवर्तनों का मूल्यांकन किया जा सकता है।
सूजन वाले कान के ऊतकों में, देखे गए परिवर्तनों को इन विट्रो परीक्षणों के साथ भी पूरक किया जा सकता है, जो टी सेल प्रसार और साइटोकिन उत्पादन को उजागर करता है। यह हैप्टेन-संयुग्मित प्रोटीन एंटीजन22,27 की उपस्थिति में एएलएन को संवर्धन करके आसानी से पूरा किया जा सकता है। संवेदनशील लेकिन चुनौतीपूर्ण चूहों से पृथक एएलएन द्वारा साइटोकिन स्राव का मूल्यांकन उनके प्रेरण के स्थान पर सीएचएस-प्रभावक कोशिकाओं द्वारा साइटोकिन उत्पादन के बारे में विवरण प्रदान करता है।
सीमाओं
कई माइक्रोमीटर अलग-अलग सटीकता के साथ कान की सूजन को मापते हैं। उदाहरण के लिए, सबसे कम दबाव एक वसंत कैलिपर द्वारा लगाया जाता है, इसलिए ऐसा लगता है कि परिणाम वास्तविक मोटाई कान माप को सबसे अच्छा प्रतिबिंबित करेंगे। हालांकि, माइक्रोमीटर जो अधिक दबाव डालते हैं, जैसे कि मितुतोयो, एडिमा गठन के शुरुआती चरण में कानों में जमा होने वाले तरल पदार्थ को अधिक कसकर संपीड़ित करने की संभावना है। सीएचएस की द्विध्रुवी प्रकृति को इस तरह के माइक्रोमीटर का उपयोग करके अधिक स्पष्ट रूप से कल्पना की जा सकती है क्योंकि अधिक दबाव डाला जाता है। प्रकाश दबाव28 के साथ वसंत कैलिपर का उपयोग करते समय यह अधिक कठिन है। फिर भी, कुछ अध्ययनों में, कानों की मोटाई को कैलिपर29 के साथ मापा गया था। इसके अलावा, पर्यवेक्षक का अनुभव सटीक माप सुनिश्चित करता है, जो व्यक्तिपरक भावनाओं से प्रभावित हो सकता है, भले ही पर्यवेक्षक प्रयोगात्मक समूहों से अनजान हो।
यहां वैकल्पिक तरीकों का वर्णन किया गया है जो माइक्रोमीटर के साथ कान की सूजन के माप की पुष्टि करने में मदद कर सकते हैं, जिससे प्रस्तुत डेटा अधिक विश्वसनीय और कम व्यक्तिपरक हो जाता है। हालांकि, सीएचएस का आकलन करने के लिए इन वैकल्पिक रणनीतियों का उपयोग केवल एक समय में किया जा सकता है। माइक्रोमीटर माप को विभिन्न समय बिंदुओं पर दोहराया जा सकता है, जिससे सीएचएस कैनेटीक्स का अध्ययन करने की अनुमति मिलती है।
संशोधन
हमारी प्रयोगशाला में उपयोग की जाने वाली सीएचएस प्रतिक्रिया का अध्ययन करने के लिए प्रोटोकॉल अन्य प्रयोगशालाओं में उपयोग किए जाने वाले लोगों से काफी भिन्न होता है, जिसमें हैप्टेन की खुराक और विलायक संरचना दोनों के लिए उपयोग की जाती है, साथ ही साथ उस समय बिंदु पर जिस पर प्रतिक्रिया का मूल्यांकन किया जाता है। कान की मोटाई को अलग-अलग समय बिंदुओं पर मापा जा सकता है (उदाहरण के लिए, चुनौती के बाद 2 घंटे, 24 घंटे, 48 घंटे और 72 घंटे)10,30। तालिका 1 विभिन्न प्रयोगात्मक मॉडल, विशेष रूप से पशु तनाव, हैप्टेन, और विभिन्न अध्ययनों में उपयोग किए जाने वाले संवेदीकरण / चुनौती समय में अंतरदिखाती है 10,21,22,26,31,32,33,34,35,36,37 . सीएचएस प्रोटोकॉल भी चूहों के पेट की पिछली शेविंग के बिना आयोजित किया जा सकता है।
अगला अंतर स्वयं एलिसिटेशन (चुनौती) के निष्पादन से संबंधित है। जैसा कि विशिष्ट है, संवेदीकरण मुंडा चूहों के पेट की त्वचा को अकेले हैप्टेन या वाहन के साथ चित्रित करके किया जाता है। इसके बाद, दोनों समूहों में, प्रत्येक कान की तरफ पतला हैप्टेन के साथ एक कान को चुनौती दी जाती है। एक नियंत्रण के रूप में, विपरीत कान को अकेले10,31 वाहन की समान मात्रा के साथ चित्रित किया जाता है।
महत्वपूर्ण कदम
सबसे महत्वपूर्ण क्षण सीएचएस को ट्रिगर करना है, क्योंकि परीक्षण के परिणाम इस पर निर्भर करते हैं। (1) हैप्टेन समाधान बहुत अस्थिर और हल्का संवेदनशील है, इसलिए इसे कसकर बंद किया जाना चाहिए और प्रकाश से संरक्षित किया जाना चाहिए, और जब उपयोग में होता है, तो इसे जानवरों की त्वचा पर जल्दी से लागू किया जाना चाहिए ताकि यह वाष्पित न हो। (2) पेट की त्वचा पर हैप्टेन लगाने के बाद, जानवर के पिंजरे में लौटने से पहले इसे सुखाया जाना चाहिए क्योंकि चूहे इसे बिस्तर के खिलाफ धुंधला कर सकते हैं या इसे अपने पंजे के साथ कानों पर लागू कर सकते हैं (फिर ऑरिकल की मोटाई का माप अपर्याप्त हो सकता है)। (3) जानवरों को लेबल करने के विभिन्न तरीके, जैसे कि विलायक प्रतिरोधी मार्कर के साथ माउस पूंछ को चिह्नित करना, भी जाना जाता है। हालांकि, मार्कर में मौजूद रंजक (अध्ययन नहीं किया गया) एक हैप्टेन बन सकता है और सीएचएस को ट्रिगर कर सकता है। इसलिए, इस अध्ययन में, एक अंकन विधि चुनी गई थी जो प्रतिक्रिया को प्रभावित नहीं करती है। (4) शेविंग विधि चुनना बहुत महत्वपूर्ण है क्योंकि यह त्वचा को परेशान कर सकता है। इस प्रोटोकॉल में, एक ग्रे साबुन का उपयोग किया गया था क्योंकि इसमें सुखदायक गुण हैं; यह मामूली कटौती और घावों के उपचार को तेज करता है, जो इसके जीवाणुरोधी प्रभावों से मदद करता है। यह त्वचा की सूजन और सूजन को शांत करता है।
विभिन्न अध्ययनों के परिणामों की तुलना करने के लिए पशु उपयोग (तनाव और लिंग) सहित प्रयोगात्मक प्रक्रियाओं की आगे की जांच और मानकीकरण की आवश्यकता होती है।
सीएचएस मॉडल में कई अलग-अलग पर्यावरणीय कारकों और जैविक कार्यों के साथ नए पदार्थों का परीक्षण किया जा सकता है। यह मॉडल उपयोगी हो सकता है यदि शोधकर्ता यह दिखाना चाहते हैं कि परीक्षण किए गए कारक टी सेल-निर्भर प्रतिरक्षा प्रतिक्रियाओं को संशोधित करते हैं या नहीं।
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
लेखकों के पास खुलासा करने के लिए कुछ भी नहीं है।
Acknowledgments
इस अध्ययन को सबवेंशन सब्वेशन सब्ज़ द्वारा समर्थित किया गया था। व्रोकला, पोलैंड में मेडिकल यूनिवर्सिटी के ए020.22.060, और विज्ञान और उच्च शिक्षा मंत्रालय एन एन 401 545940 से एमएस और आईपी 2012 0443 72 से एमएमएस तक अनुदान द्वारा।
Materials
| Name | Company | Catalog Number | Comments |
| 70% ethanol | Merck KGaA, Darmstadt, Germany | 65350-M | for surface disinfection |
| 96-well flat-bottom plates, polypropylene | Greiner Bio-One GmbH, Kremsmunster, Austria | 655101 | for MPO and Evans blue measurement - plates should be made of polypropylene, that has a lower binding capacity so proteins or DNA will not bind |
| Acetone (ACS reagent, ≥99.5%) | Merck KGaA, Darmstadt, Germany | 179124 | |
| Aluminum foil | Merck KGaA, Darmstadt, Germany | Z185140 | |
| Analytical balance | Sartorius Weighing Technology GmbH, Goettingen, Germany | PRACTUM224-1s, 29105177 | |
| Automated tissue processor | MediMeas Instruments, Sarsehri, Haryana, India | MTP-E-212 | automatically prepare tissue samples by fixing, dehydrating, clearing, and infiltrating them with paraffin |
| BD Vacutainer SST II Advance (tube with gel for obtaining serum) | Becton Dickinson (BD), Franklin Lakes, NJ, USA | BD 366882 | |
| Bicinchoninic acid kit for protein determination | Merck KGaA, Darmstadt, Germany | BCA1-1KT | |
| Biotin Rat Anti-Mouse IgG1 | Becton Dickinson (BD Biosciences), Franklin Lakes, NJ, USA | 553441 | |
| BSA (bovine serum albumine) | Merck KGaA, Darmstadt, Germany | A9418 | protein assays & analysis, 2 mg/mL |
| Cell strainer, pore size 70 μm | BIOLOGIX, China | 15-1070 | suitable for 50 mL tubes |
| Coverslip | VWR, Radnor, Pennsylvania, United States | 631-1583 | 24 mm, but it possible to use different size |
| Disposable pipettes capacity: 5 mL, 10 mL, 25 mL | Merck KGaA, Darmstadt, Germany | Z740301, Z740302, Z740303 | |
| DPBS (Dulbecco′s phosphate buffered saline) | ThermoFisher Scientific, Waltham, Massachusetts, USA | 14190144 | no calcium, no magnesium, mammalian cell culture |
| DPX Mountant for histology | Merck KGaA, Darmstadt, Germany | 6522 | mounting media for H-E, might be used some other e.g, Canada balsam |
| Dumont 5 tweezers - straight | Animalab, Poznan, Poland | 11251-10FST | surgical instruments for procedures on mice (should be steriled) |
| Dumont 7 tweezers - bent | Animalab, Poznan, Poland | 11272-50FST | surgical instruments for procedures on mice (should be steriled) |
| Eosin Y solution, alcoholic | Merck KGaA, Darmstadt, Germany | HT110116 | |
| Eppendorf Safe-Lock Tubes 1.5 mL | Eppenforf, Germany | 3,01,20,086 | polypropylene |
| Eppendorf Safe-Lock Tubes, 2.0 mL | Eppenforf, Germany | 3,01,20,094 | polypropylene, round bottom (the homogenization beads can easily move) |
| Ethanol 100% (absolute alkohol) | Merck KGaA, Darmstadt, Germany | 1.07017 | |
| Ethanol 96% | Merck KGaA, Darmstadt, Germany | 1.59010 | |
| Evans blue | Merck KGaA, Darmstadt, Germany | E2129 | |
| FBS (fetal bovine serum) | ThermoFisher Scientific, Waltham, Massachusetts, USA | A3160802 | |
| Formalin solution, neutral buffered, 10% | Merck KGaA, Darmstadt, Germany | HT501128 | |
| Formamide 99.5% (GC) | Merck KGaA, Darmstadt, Germany | F7503 | |
| Freezer -20 °C | Bosch, Germany | GSN54AW30 | |
| Fridge +4 °C / freezer -20 °C | Bosch, Germany | KGV36V10 | mammalian Cell Culture, qualified, Brazil, 10 x 50 mL |
| Glass microskope slides, SuperFrost Plus | VWR, Radnor, Pennsylvania, United States | 631-0108, 631-0446, 631-0447, 631-0448, 631-0449 | Slides that eliminates the need to apply adhesive materials or protein coatings, to preventing any tissue sections loss during staining. |
| Graph Pad Prism | GraphPad Software Inc. | v. 9.4.0 | |
| Grey soap | Pollena Ostrzeszów, Producent Chemii Gospodarczej Sp. Z.o.o. , Sp. K., Poland | Bialy jelen soap bar | grey Soap Bar Natural Hypoallergenic. Generally available product |
| H2SO4 (sulfuric acid) 1 mol/l (1 M) | Merck KGaA, Darmstadt, Germany | 1.60313 | |
| Harris hematoxylin solution | Merck KGaA, Darmstadt, Germany | HHS16 | |
| Hemocytometer | VWR, Avantor, U.S.A | 612-5719 | manual counting chamber is recommend, which is more accurate |
| Hexadecyltrimethylammonium bromide | Merck KGaA, Darmstadt, Germany | H5882 | |
| Homogenizer | QIAGEN Hilden, Germany | Tissue Lyser LT, SN 23.1001/05234 | homogenizer with stainless steel beads (diameter 5 mm) for 2 mL centrifuge tubes |
| Horseradish peroxidase streptavidin (HRP streptavidin) | Vector Laboratories, Inc., Burlingame, CA, USA | SA-5004-1 | |
| Hydrogen peroxide solution (H202) | Merck KGaA, Darmstadt, Germany | H1009 | |
| Incubator Heracell 150i | Thermo Electron LED Gmbh, Germany | 41071068 | 37 oC in the atmosphere of 5 % CO2, and 65 0C for deparaffinization the sections for histology |
| Ketamine 100 mg/mL, solution for injection | Biowet Pulawy Sp. z o.o., Pulawy, Poland | cat.# not avaliable | |
| KH2PO4 (potassium dihydrogen phosphate) 99.995% anhydrous basis | Merck KGaA, Darmstadt, Germany | 1.05108 | |
| Laboratory Centrifuge | Heraeus Megafuge 1.0R, Thermo Scientific, Germany | B00013899 | speed to 300 x g, with cooling to 4 0C |
| Laboratory Centrifuge | Heraeus Fresco 21, Thermo Scientific, Germany | 75002425 | speed to 3,000 x g, with cooling to 4 0C |
| Mask (FFP2) | VWR, Radnor, Pennsylvania, United States | 111-0917 | for working with ortho-dianisine dihydrochloride |
| Mice | Breeding unit of the Chair of Biomedical Sciences, Faculty of Health Sciences, Jagiellonian University Medical College, Krakow, Poland | CBA/J, C57BL/6 | |
| Micrometer | Mitutoyo, Tokyo, Japan | 193-111 | digit Outside Micrometer, Ratchet Stop, 0-25mm Range, 0.001mm Graduation, +/-0.002mm Accuracy, https://shop.mitutoyo.pl/web/mitutoyo/pl_PL/all/all/Mikrometr%20analogowy%20/PR/193-111/index.xhtml |
| microplate, 96 well, microlon, high binding (for ELISA test) | Greiner Bio-One GmbH, Kremsmunster, Austria | 655061 | with maxi-sorp binding surfaces for reliable and reproducible results in colormetric assays |
| Microscope with objectives | Leica Microsystems CMS GmbH, Germany | DM1000, 294011-082007 | histology presented in the paper was performed under ThermoFisher Scientific EVOS M5000 Imaging System, with objectives: FL 20X LWDPH, 0.40NA/3.1WD and FL 40X LWDPH 0.65NA/1.79WD |
| Myeloperoxidase from human leukocytes (MPO standard) | Merck KGaA, Darmstadt, Germany | M6908 | |
| Na2HPO4 x 7 H2O (sodium phosphate dibasic heptahydrate) | Merck KGaA, Darmstadt, Germany | S9390 | |
| Olive-oil | Merck KGaA, Darmstadt, Germany | 75343 | pure, natural |
| OptEIA Mouse IFN-γ ELISA Set | Becton Dickinson (BD Biosciences), Franklin Lakes, NJ, USA | 555138 | |
| Ortho-dianisine dihydrochloride | Merck KGaA, Darmstadt, Germany | D3252 | |
| Paraffin wax | Merck KGaA, Darmstadt, Germany | 76242 | beads, waxy solid |
| PBS (phosphate buffered saline) | ThermoFisher Scientific, Waltham, Massachusetts, USA | 20012027 | pH 7.2, mammalian cell culture |
| ph meter | Elmetron, Poland | CP-401 | |
| Pipettes, variable volume with tips | Merck KGaA, Darmstadt, Germany | EP3123000900-1EA | 3-pack, Option 1, 0.5-10 uL/10-100 uL/100-1000 uL, includes epT.I.P.S. |
| Razor blade | VWR, Radnor, Pennsylvania, United States | PERS94-0462 | scraper and cutter blades, single edge, aluminium spine, 100 blades per box, individually wrapped |
| Rotary microtome | MRC Laboratory-Instruments, Essex, CM20 2HU UK | HIS-202A | |
| Scissors - straight, sharp / sharp | Animalab, Poznan, Poland | 14060-10FST | Surgical instruments for procedures on mice (should be steriled) |
| Screw cap (open top) | Merck KGaA, Darmstadt, Germany | 27056 | black polypropylene hole cap, for use with 22 mL vial with 20-400 thread |
| Spectrophotometer | BioTek Instruments, U.S.A | 201446 | universal microplate spectrophotometer: λ range: 200 - 999 nm, absorbance measurement range: 0.000 - 4.000 Abs |
| Staining dish 20 slides with rack | Merck KGaA, Darmstadt, Germany | S6141 | e.g. 20 slide staining dishes complete with covers, slide rack and handle |
| Sterile Disposable Biopsy Punch 6mm | Integra LifeSciences, Princeton, NJ, USA | 33-36 | |
| Surgical scissors | Animalab, Poznan, Poland | 52138-46 | surgical instruments for procedures on mice (should be steriled) |
| Tissue processing cassettes | Merck KGaA, Darmstadt, Germany | Z672122 | tissue processing/ embedding cassettes with lid |
| TMB Substrate Reagent Set | Becton Dickinson (BD Biosciences), Franklin Lakes, NJ, USA | 555214 | |
| TNCB (2,4,6-trinitrochlorobenzene) | Tokyo Chemical Industry CO., LTD, Japan | C0307 | |
| TNP-BSA (bovine serum albumin conjugated with 2,4,6-trinitrophenyl) | Biosearch Technologies LGC, Petaluma, CA, USA | T-5050 | |
| T-PER (tissue protein extration reagent) | ThermoFisher Scientific, Waltham, Massachusetts, USA | 78510 | |
| Tubes 15 mL sterile | Merck KGaA, Darmstadt, Germany | CLS430055 (Corning) | polypropylene, conical bottom |
| Tubes 50 mL, sterile | Merck KGaA, Darmstadt, Germany | CLS430290 (Corning) | polypropylene, conical bottom |
| Tween 20 | Merck KGaA, Darmstadt, Germany | P1379 | |
| Vials, screw top, clear glass (vial only) 22 mL | Merck KGaA, Darmstadt, Germany | 27173 | for the preparation of hapten, screwed on so that it does not evaporate |
| Water bath | AJL Electronic, Poland | LW102 | |
| Wax (paraffin) dispenser | VWR, Radnor, Pennsylvania, United States | 114-8737 | |
| Xylazine (xylapan 20 mg/mL) solution for injection | Vetoquinol Biowet Sp. z o.o., Gorzow Wielkopolski, Poland | cat.# not avaliable | |
| Xylene (histological grade) | Merck KGaA, Darmstadt, Germany | 534056 |
References
- Nosbaum, A., Vocanson, M., Rozieres, A., Hennino, A., Nicolas, J. F. Allergic and irritant contact dermatitis. European Journal of Dermatology. 19 (4), 325-332 (2009).
- Hertl, M., et al. Predominance of epidermal CD8+ T lymphocytes in bullous cutaneous reactions caused by beta-lactam antibiotics. The Journal of Investigative Dermatology. 101 (6), 794-799 (1993).
- Martin, S. F. T lymphocyte-mediated immune responses to chemical haptens and metal ions: implications for allergic and autoimmune disease. International Archives of Allergy and Immunology. 134 (3), 186-198 (2004).
- Takeyoshi, M., Iida, K., Suzuki, K., Yamazaki, S. Skin sensitization potency of isoeugenol and its dimers evaluated by a non-radioisotopic modification of the local lymph node assay and guinea pig maximization test. Journal of Applied Toxicology. 28 (4), 530-534 (2008).
- Nakamura, K., Aizawa, M. Studies on the genetic control of picryl chloride contact hypersensitivity reaction in inbred rats. Transplantation Proceedings. 13 (2), 1400-1403 (1981).
- Asherson, G. L., Ptak, W. Contact and delayed hypersensitivity in the mouse. I. Active sensitization and passive transfer. Immunology. 15 (3), 405-416 (1968).
- Honda, T., Egawa, G., Grabbe, S., Kabashima, K. Update of immune events in the murine contact hypersensitivity model: toward the understanding of allergic contact dermatitis. The Journal of Investigative Dermatology. 133 (2), 303-315 (2013).
- Kaplan, D. H., Jenison, M. C., Saeland, S., Shlomchik, W. D., Shlomchik, M. J. Epidermal langerhans cell-deficient mice develop enhanced contact hypersensitivity. Immunity. 23 (6), 611-620 (2005).
- Wang, L., et al. Langerin expressing cells promote skin immune responses under defined conditions. Journal of Immunology. 180 (7), 4722-4727 (2008).
- Wang, B., et al. CD4+ Th1 and CD8+ type 1 cytotoxic T cells both play a crucial role in the full development of contact hypersensitivity. Journal of Immunology. 165 (12), 6783-6790 (2000).
- Mori, T., et al. Cutaneous hypersensitivities to hapten are controlled by IFN-gamma-upregulated keratinocyte Th1 chemokines and IFN-gamma-downregulated langerhans cell Th2 chemokines. The Journal of Investigative Dermatology. 128 (7), 1719-1727 (2008).
- Peszkowski, M. J., Warfvinge, G., Larsson, A. Allergic and irritant contact responses to DNFB in BN and LEW rat strains with different TH1/TH2 profiles. Acta Dermato-Venereologica. 74 (5), 371-374 (1994).
- Henningsen, S. J., Mickell, J., Zachariae, H. Plasma kinins in dinitrochlorobenzene contact dermatitis of guinea-pigs. Acta Allergologica. 25 (5), 327-331 (1970).
- Maibach, H. I., Maguire, H. C. Elicitation of delayed hypersensitivity (DNCB contact dermatitis) in markedly panleukopenic guinea pigs. The Journal of Investigative Dermatology. 41, 123-127 (1963).
- Martel, B. C., Lovato, P., Bäumer, W., Olivry, T. Translational animal models of atopic dermatitis for preclinical studies. The Yale Journal of Biology and Medicine. 90 (3), 389-402 (2017).
- Jin, H., He, R., Oyoshi, M., Geha, R. S. Animal models of atopic dermatitis. The Journal of Investigative Dermatology. 129 (1), 31-40 (2009).
- Li, Y. Z., Lu, X. Y., Jiang, W., Li, L. F. Anti-inflammatory effect of qingpeng ointment in atopic dermatitis-like murine model. Evidence-Based Complementary and Alternative. 2013, 907016 (2013).
- Hoggatt, J., Hoggatt, A. F., Tate, T. A., Fortman, J., Pelus, L. M. Bleeding the laboratory mouse: Not all methods are equal. Experimental Hematology. 44 (2), 132-137 (2016).
- Bedoya, S. K., Wilson, T. D., Collins, E. L., Lau, K., Larkin, J. Isolation and th17 differentiation of naïve CD4 T lymphocytes. Journal of Visualized Experiments. (79), e50765 (2013).
- Vlab, A. Hemocytometer - Counting of Cells. Amrita University. , Available from: https://www.youtube.com/watch?v=MKS0KM3lr90 (2011).
- Majewska-Szczepanik, M., Strzepa, A., Marcińska, K., Wen, L., Szczepanik, M. Epicutaneous immunization with TNP-Ig and Zymosan induces TCRαβ+ CD4+ contrasuppressor cells that reverse skin-induced suppression via IL-17A. International Archives of Allergy and Immunology. 164 (2), 122-136 (2014).
- Majewska-Szczepanik, M., Zemelka-Wiącek, M., Ptak, W., Wen, L., Szczepanik, M. Epicutaneous immunization with DNP-BSA induces CD4+ CD25+ Treg cells that inhibit Tc1-mediated CS. Immunology and Cell Biology. 90 (8), 784-795 (2012).
- Directive 2010/63 / EU of the European Parliament and of the Council of 22 September 2010 on the protection of animals used for scientific purposes. Official Journal of the European Union. , Available from: https://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2010:276:0033:0079:En:PDF (2010).
- Colvin, R. B., Dvorak, H. F. Role of the clotting system in cell-mediated hypersensitivity. II. Kinetics of fibrinogen/fibrin accumulation and vascular permeability changes in tuberculin and cutaneous basophil hypersensitivity reactions. Journal of Immunology. 114, 377-387 (1975).
- Szczepanik, M., et al. Regulation of contact sensitivity in non-obese diabetic (NOD) mice by innate immunity. Contact Dermatitis. 79 (4), 197-207 (2018).
- Askenase, P. W., Majewska-Szczepanik, M., Kerfoot, S., Szczepanik, M. Participation of iNKT cells in the early and late components of Tc1-mediated DNFB contact sensitivity: Cooperative role of γδ-T cells. Scandinavian Journal of Immunology. 73 (5), 465-477 (2011).
- Zemelka-Wiącek, M., Majewska-Szczepanik, M., Ptak, W., Szczepanik, M. Epicutaneous immunization with protein antigen induces antigen-non-specific suppression of CD8 T cell mediated contact sensitivity. Pharmacological Reports. 64 (6), 1485-1496 (2012).
- Van Loveren, H., et al. Use of micrometers and calipers to measure various components of delayed-type hypersensitivity ear swelling reactions in mice. Journal of Immunological Methods. 67 (2), 311-319 (1984).
- Tsuji, R. F., et al. B cell-dependent T cell responses: IgM antibodies are required to elicit contact sensitivity. The Journal of Experimental Medicine. 196 (10), 1277-1290 (2002).
- Campos, R. A., et al. Cutaneous immunization rapidly activates liver invariant Valpha14 NKT cells stimulating B-1 B cells to initiate T cell recruitment for elicitation of contact sensitivity. The Journal of Experimental Medicine. 198 (12), 1785-1796 (2003).
- Rühl-Muth, A. C., Maler, M. D., Esser, P. R., Martin, S. F. Feeding of a fat-enriched diet causes the loss of resistance to contact hypersensitivity. Contact Dermatitis. 85 (4), 398-406 (2021).
- Bour, H., et al. histocompatibility complex class I-restricted CD8+ T cells and class II-restricted CD4+ T cells, respectively, mediate and regulate contact sensitivity to dinitrofluorobenzene. European Journal of Immunology. 25 (11), 3006-3010 (1995).
- Majewska-Szczepanik, M., et al. Obesity aggravates contact hypersensitivity reaction in mice. Contact Dermatitis. 87 (1), 28-39 (2022).
- Katagiri, K., Arakawa, S., Kurahashi, R., Hatano, Y. Impaired contact hypersensitivity in diet-induced obese mice. Journal of Dermatological Science. 46 (2), 117-126 (2007).
- Bouloc, A., Cavani, A., Katz, S. I. Contact hypersensitivity in MHC class II-deficient mice depends on CD8 T lymphocytes primed by immunostimulating Langerhans cells. The Journal of Investigative Dermatology. 111 (1), 44-49 (1998).
- Martin, S., et al. Peptide immunization indicates that CD8+ T cells are the dominant effector cells in trinitrophenyl-specific contact hypersensitivity. The Journal of Investigative Dermatology. 115 (2), 260-266 (2000).
- Vennegaard, M. T., et al. Epicutaneous exposure to nickel induces nickel allergy in mice via a MyD88-dependent and interleukin-1-dependent pathway. Contact Dermatitis. 71 (4), 224-232 (2014).
Tags
इम्यूनोलॉजी और संक्रमण अंक 187 म्यूरिन मॉडल एलर्जी संपर्क जिल्द की सूजन (एसीडी) संपर्क अतिसंवेदनशीलता (सीएचएस) कान की सूजन संवहनी पारगम्यता मायलोपेरोक्सीडेज (एमपीओ) साइटोकिन्स 2,4,6-ट्रिनिट्रोक्लोरोबेंजीन (टीएनसीबी) हैप्टेनErratum
Formal Correction: Erratum: Contact Hypersensitivity as a Murine Model of Allergic Contact Dermatitis
Posted by JoVE Editors on 01/19/2023.
Citeable Link.
An erratum was issued for: Contact Hypersensitivity as a Murine Model of Allergic Contact Dermatitis. The Protocol and Representative Results sections were updated.
Step 3.2.1 of the Protocol has been updated from:
On day "4", prepare 0.4% hapten: TNCB in an acetone-ethanol mixture (ratio 1:1). Prepare the solution just before use in a glass vial and protect it from light by covering the vial with aluminum foil.
to:
On day "4", prepare 0.4% hapten: TNCB in an acetone: olive oil mixture (ratio 1:1). Prepare the solution just before use in a glass vial and protect it from light by covering the vial with aluminum foil.
Figure 1 of the Representative Results has been updated from:
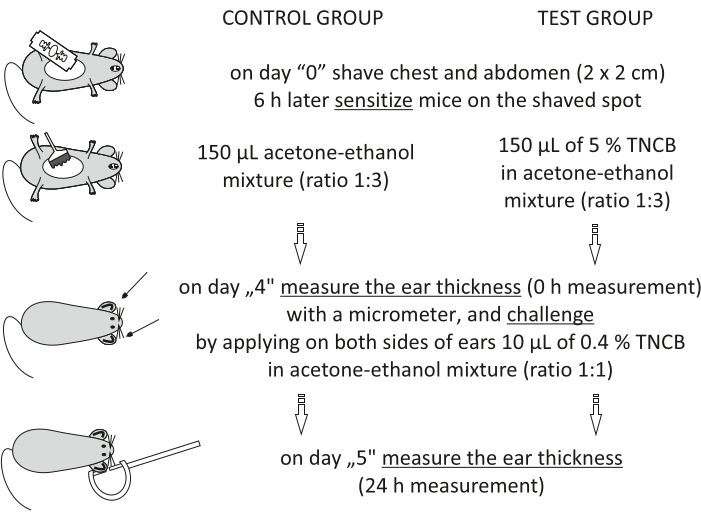
Figure 1: Induction of CHS. Sensitization, challenge, and ear measurement. Abbreviations: CHS = contact hypersensitivity reaction; TNCB = 2,4,6-trinitrochlorobenzene. Please click here to view a larger version of this figure.
to:
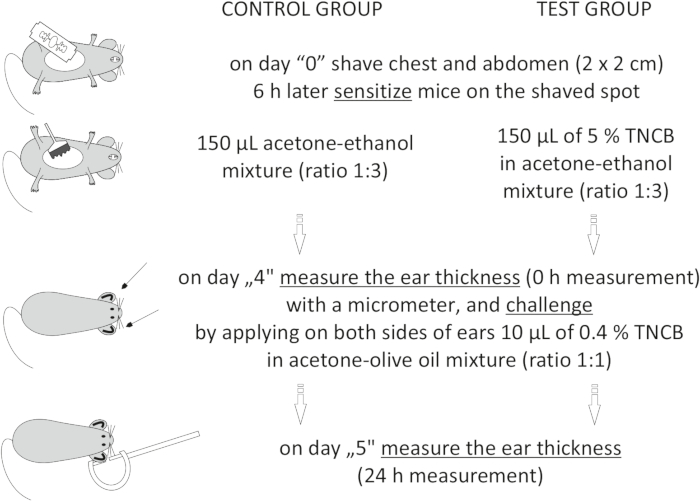
Figure 1: Induction of CHS. Sensitization, challenge, and ear measurement. Abbreviations: CHS = contact hypersensitivity reaction; TNCB = 2,4,6-trinitrochlorobenzene. Please click here to view a larger version of this figure.
Figure 2 of the Representative Results has been updated from:
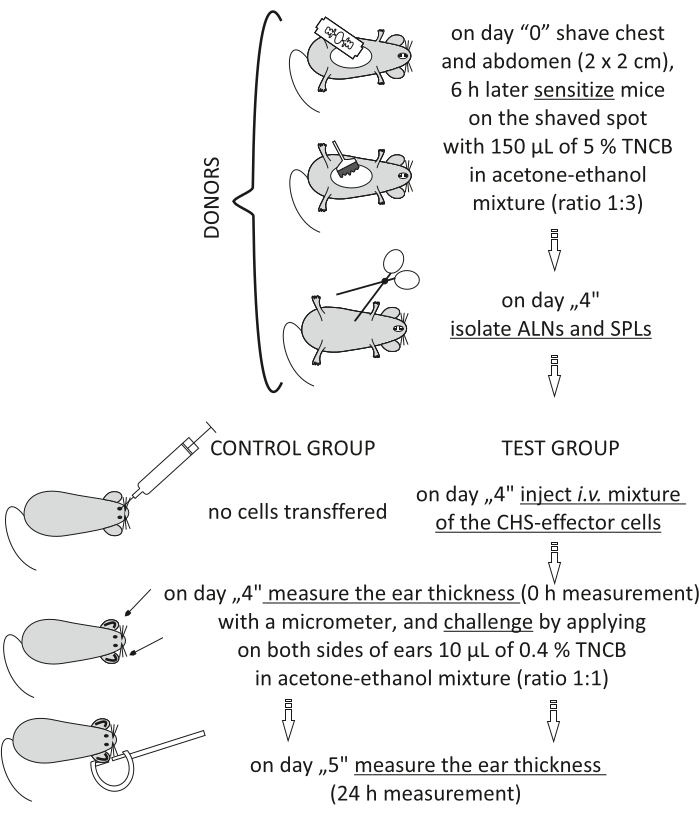
Figure 2: Adoptive transfer of the CHS-effector cells. Abbreviations: ALNs =axillary and inguinal lymph nodes; CHS = contact hypersensitivity reaction; i.v. = intravenously; SPLs = spleens; TNCB = 2,4,6-trinitrochlorobenzene. Please click here to view a larger version of this figure.
to:
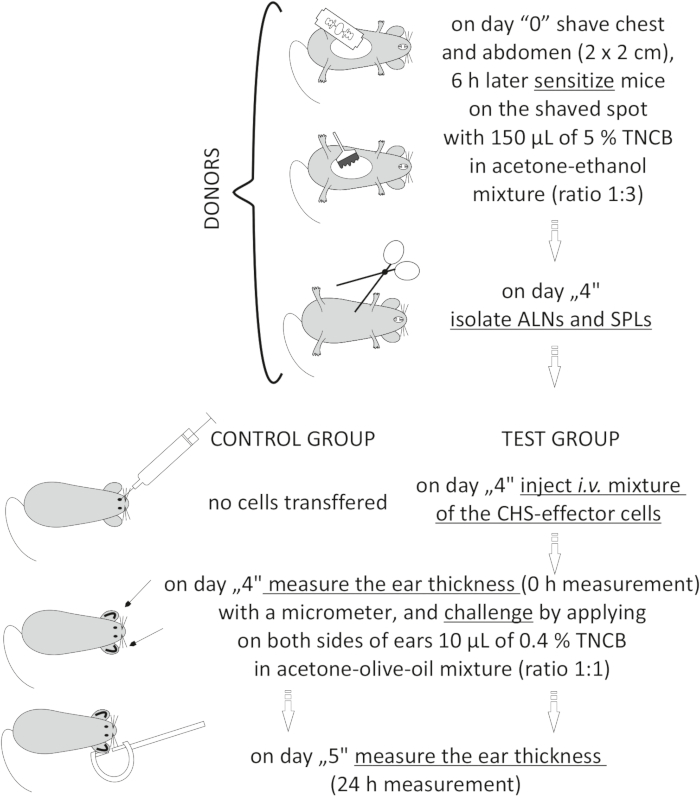
Figure 2: Adoptive transfer of the CHS-effector cells. Abbreviations: ALNs =axillary and inguinal lymph nodes; CHS = contact hypersensitivity reaction; i.v. = intravenously; SPLs = spleens; TNCB = 2,4,6-trinitrochlorobenzene. Please click here to view a larger version of this figure.



