ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
접촉 과민증 (CHS)은 알레르기 성 접촉 피부염 (ACD)의 뮤린 실험 모델입니다. CHS는 가슴과 복부의 면도 된 피부를 페인팅하여 반응성 합텐으로 감작을 기반으로하며, 희석 된 합텐으로 후속 귀 피부 챌린지를 통해 다양한 방법으로 평가되는 붓기 반응을 일으 킵니다.
Abstract
접촉 과민증 (CHS)은 마우스에서 연구 할 수있는 알레르기 성 접촉 피부염 (ACD)의 실험 모델입니다. 이 연구는 다양한 테스트로 측정하고 정량화 할 수있는 마우스의 CHS 반응을 연구하는 데 도움이되는 객관적인 실험실 방법을 제시하는 것을 목표로합니다. CHS를 유도하기 위해, "0"일째에, 마우스는 아세톤-에탄올 혼합물 중의 합텐 2,4,6-트리니트로클로로벤젠(TNCB)으로 복 도장에 의해 이전에 면도된 반점에 감작시킨 반면, 음성 대조군 마우스는 비히클 단독-아세톤-에탄올 혼합물로 가짜 감작되었다. "4"일째에, 기준선 귀 두께를 CHS(챌린지)의 도출 전에 시험군 및 대조군 둘 다에서 희석된 TNCB로 양쪽 귀를 페인팅함으로써 마이크로미터로 측정하였다. 24시간 후, 귀 팽윤을 마이크로미터로 측정하였다. CHS는 염증이 있는 조직에서 팽윤을 일으키는 T 세포 매개 면역 반응의 예이며, 동일한 합텐으로 피부 챌린지 후 24시간 후에 최고조에 달한다. 귀 부종의 증가는 증강 된 귀 무게, 골수퍼옥시다제 (MPO) 활성, 귀 추출물의 전염증성 사이토카인 농도, 조직 학적 검사에서 부종 진피의 두꺼움 증가 및 귀 혈관 투과성과 관련이 있습니다. 또한 대조군 마우스와 비교했을 때 시험군의 혈청에서 TNP 특이적 IgG1 항체의 농도가 증가하였다. 추가적으로, CHS는 이전에 TNCB로 감작된 공여자로부터 수득된 CHS-이펙터 세포와 함께 성공적으로 전달될 수 있다. CHS-이펙터 세포를 순진한 수용자 마우스에 정맥내 투여하였고, 이는 후속적으로 동일한 희석된 합텐으로 도전되었다. 귀 부종은 24시간 후에 마이크로미터로 측정하였다.
Introduction
알러지성 접촉성 피부염(ACD)은 합텐(haptens)이라고 불리는 저분자량 화학물질에 노출되어 발생하는 IV형 과민반응으로 인한 선진국에서 흔히 나타나는 피부 염증성 질환이다. 인간에서 접촉 감작을 일으키는 물질에는 화장품에 존재하는 중금속 이온 (크롬, 니켈, 철, 코발트), 테레빈 유, 향료, 염료 및 방부제 (예 : 파라페닐렌디아민), 일부 약물 (예 : 네오 마이신, 벤조카인), β-락탐 항생제 (즉, 페니실린), 식물에 의해 생성 된 화학 물질 (펜타 데카카테콜, 옻 아이비에 존재하는 물질) 및 사진 산업에서 사용되는 하이드로 퀴논 1,2 . ACD 병인학은 산업에서만 100,000 개 이상의 화학 물질이 사용되고 매년 2,000 개의 새로운 화학 물질이 합성되므로 매우 높습니다. 현재까지 접촉 합텐 / 알레르겐 일 수있는 3,700 개 이상의 분자가 확인되었습니다3. 접촉 과민 반응 (CHS)은 마우스, 기니아 피그 및 래트에서 연구 할 수있는 ACD의 실험 모델이며 유기 용매 4,5,6에 용해 된 반응성 화학 합텐의 국소 피부 적용에 의해 유도 될 수 있습니다. 이 연구는 다양한 테스트로 측정하고 정량화 할 수있는 마우스의 CHS 반응을 연구하는 데 도움이되는 객관적인 실험실 방법을 설명하는 것을 목표로합니다.
CHS는 감작(유도) 및 이펙터(챌린지) 단계로 구성됩니다. 동물 모델에서 합텐은 먼저 신체의 단백질에 공유적으로 결합하여 신 항원을 만듭니다. 감작 단계 동안, 활성화된 각질세포는 전염증성 사이토카인-종양 괴사 인자 α(TNF-α) 및 인터루킨 1β(IL-1β)7을 생성함으로써 피부 수지상 세포(sDCs)의 이동 및 성숙을 촉진한다. 표피 랑게르한스 세포 (LCs)는 CHS 유도 및 이펙터 단계8 동안 항원을 존재한다. 감작 동안 합텐에 노출된 LCs는 조절 및 이펙터 세포 둘 다의 유도를 촉진한다(9). 여러 연구로부터의 증가하는 증거는 CHS 반응이 CD4+ MHC 클래스 II 제한 Th1 세포 중 어느 하나에 의해 매개될 수 있고, 특징적인 염증 침윤물을 채용하기 위해 인터페론 γ(IFN-γ)을 국부적으로 방출할 수 있고, IFN-γ을 방출할 수 있지만 대부분 각질세포에 대한 세포독성 손상을 매개할 수 있는 CD8+ MHC 클래스 I-제한 Tc1 림프구, 그리고 현재 또한 인터루킨 17(IL-17)-생산 Th17 세포(10), 11.
다양한 종 12,13,14 및 합텐을 채용하는 몇몇 상이한 CHS 모델이 개발되었다 (상이한 합텐, 용매 및 적용 시간의 상세한 비교는 표 1에 요약된다). 자주 사용되는 실험실 종 인 마우스는 CHS를 연구 할 때 몇 가지 이점을 제공합니다. 다른 종에 비해 마우스들 사이에서 더 많은 균주, 녹아웃 (KO) 및 트랜스제닉 동물이 있으며, 이는 이들을 매우 매력적인 동물로 만든다15. 또한, CHS 모델은 많은 동물을 필요로하며, 마우스는 여기에서 더 경제적입니다. 동물 모델은 모든 측면에서 ACD를 모방하지 않으며; 특히, 그들은 인간에게 흔하지 않은 딱딱함과 절망을 보여줍니다16,17. 만성 질환의 특징은 주로 기술된 모델이 장기간 동안 합텐의 적용을 가정하지 않기 때문에 재현하기가 어렵다. 그러나, ACD의 많은 중요한 측면들이 재현된다는 것이 여기에서 확인되었다. 또한 인간과 마찬가지로 이러한 특징은 국소 알레르기 반응과 관련이 있음이 밝혀졌습니다. 이 프로토콜에 설명 된 합텐, 용매 및 그 적용의 선택은 결과가 수많은 시험관 내 테스트에 의해 확인되었으며 현재 버전이 확립 될 때까지 수년 동안 실험실에서 테스트되고 수정되었다는 사실에 의해 결정되었습니다. 뮤린 모델은 ACD의 발달에 관여하는 세포 서브셋 또는 사이토카인의 분석을 허용하며 새로운 치료법의 전임상 평가에 필수적이다.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
이 기사에 제시된 모든 실험은 크라쿠프의 동물 실험에 관한 제 1 차 지역 윤리위원회의 지침에 따라 수행되었습니다. 설명 된 모든 절차는 특히 케타민 / 자일라진을 마취제로 사용하고, 귀의 양쪽을 사용하여 물질 / 합텐을 적용하고, 귀를 자르고, 안구 제거로 혈액을 수집하는 것과 관련하여 현지 권장 사항에 따라 수행되었습니다. BALB/c (일배체형 H-2d), CBA/J (H-2k) 및 C57BL/6 (H-2b) 6-12주령의 수컷 및 암컷 마우스를 본 연구에 사용하였다 ( 물질의 표 참조). 통계적 중요성을 위해, 마우스의 각 그룹이 10-12 마리의 동물로 구성된 것이 가장 좋습니다.
1. 동물 준비
- 모든 절차 전후에 70 % 에탄올 용액으로 수술대를 청소하십시오. 멸균 조건이 필요한 마우스를 사용하는 경우 생물 안전 캐비닛에서 모든 작업을 수행하십시오.
2. 식별을 위해 마우스 표시
- 면도날로 피부를 면도하여 마우스에 라벨을 붙입니다 : # 0 - 표시가없는, # 2 - 오른쪽 앞발, # 3 - 오른쪽, # 4 - 오른쪽 뒷발, # 5 - 꼬리 밑, # 6 - 왼쪽 뒷발, # 7 - 왼쪽, # 8 - 왼쪽 앞발에.
참고 : 유도 된 반응으로 인해 마우스는 귀 펀칭이나 태깅으로 고전적으로 표시 할 수 없습니다. 마우스를 라벨링하는 동안 마취시키지 않았다.
3. CHS의 유도
참고: 이 절차는 그림 1에 나와 있습니다.
- 아래 단계에 따라 감작(유도)을 수행한다.
- "0"일째에 회색 비누를 물로 바르고 면도날로 면도하여 가슴과 복부 (정사각형 2cm x 2cm)에 마우스를 면도하십시오.
참고 : 합텐을 바르기 전에 피부가 자극받지 않도록 6 시간 동안 기다리십시오. - 5% 합텐을 준비하십시오: 2,4,6-트리니트로클로로벤젠(TNCB, 표 참조) 을 아세톤-에탄올 혼합물(비율 1:3) 또는 비히클 단독(아세톤-에탄올)에 넣는다. 유리 바이알에 사용하기 직전에 용액을 준비하고 알루미늄 호일로 바이알을 덮어 빛으로부터 보호하십시오.
- 같은 날에, 이전에 면도된 지점에 5% 합텐의 150 μL를 적용하여 마우스를 감작시킨다. 대조군 마우스의 그룹에서, 비히클 단독을 적용하여 비특이적 염증 반응을 평가한다. 동물을 새장에 다시 넣기 전에 30 초 동안 기다렸다가 합텐을 말리십시오.
주의: 장갑을 사용하십시오. TNCB는 대부분의 사람들에게 심각한 알레르기 반응을 일으 킵니다.
- "0"일째에 회색 비누를 물로 바르고 면도날로 면도하여 가슴과 복부 (정사각형 2cm x 2cm)에 마우스를 면도하십시오.
- 유도 (도전) 및 귀 붓기 측정을 수행하십시오.
- "4"일째에, 아세톤-에탄올 혼합물에서 TNCB를 0.4% 합텐:준비한다(비율 1:1). 유리 바이알에 사용하기 직전에 용액을 준비하고 알루미늄 호일로 바이알을 덮어 빛으로부터 보호하십시오.
- 깊은 마취를 위해 케타민 (90-120 mg / kg)과 자일라진 (5-10 mg / kg) ( 재료 표 참조)의 혼합물을 복강 내 (i.p.) 주사로 마우스를 마취하십시오. 마우스가 발가락 꼬집음으로 적어도 5 분 동안 완전히 마취되었는지 확인하십시오.
- 귀 두께(0시간 측정, 기준선)를 마이크로미터( 자료표 참조)로 실험군을 알지 못하는 관찰자에 의해 측정하였다.
- 10 μL의 0.4 % 합텐을 양쪽 그룹 (시험 및 대조군)의 귀 양쪽에 바르십시오. 동물을 새장에 다시 넣기 전에 30 초 동안 기다렸다가 합텐이 마르게하십시오.
- 합텐 적용 후 24시간 후인 "5"일째에, 24시간 측정에 대해 3.2.2-3.2.3단계를 반복한다.
- 합텐을 사용한 챌린지 전후의 귀 두께의 차이를 계산하여 CHS 반응을 평가한다: 24시간 귀 두께(μm) - 0시간 귀 두께(μm). 각 귀를 별도의 측정으로 계산하십시오. 다음으로, 귀 팽윤을 마이크로미터(μm)로 표현± 표준오차(SEM)의 평균(SEM)이다(표 2, 도 3).
4. 귀 생검
- 귀 두께의 24 시간 측정 직후 (마우스가 여전히 깊은 마취 상태에있을 때), 가위로 가능한 한 두개골에 가까운 귀를 잘라냅니다. 생검 펀치를 사용하여 직경 6 mm 펀치를 만들어 귀의 원위 측으로부터 생검을 수집 하십시오 (재료 표 참조).
- 귀 무게를 측정하고(단계 4.2) 동일한 귀 생검에 대해 다음 시험 중 하나를 추가로 수행한다: 골수퍼옥시다제 (MPO) 검정 (단계 4.3) 또는 귀 추출물 중의 사이토카인 농도의 시험관내 측정 (예를 들어, IFN-γ, IL-17A, TNF-α [단계 4.4]).
참고 : 혈액 수집 전에 귀를 자르십시오. 이 절차 후, 마우스는 안락사되어야합니다 (예를 들어, 자궁 경부 탈구에 의해).
- 귀 무게를 측정하고(단계 4.2) 동일한 귀 생검에 대해 다음 시험 중 하나를 추가로 수행한다: 골수퍼옥시다제 (MPO) 검정 (단계 4.3) 또는 귀 추출물 중의 사이토카인 농도의 시험관내 측정 (예를 들어, IFN-γ, IL-17A, TNF-α [단계 4.4]).
- 분석 저울에서 각 귀 생검의 무게를 측정하고 밀리그램 (mg)으로 표현하십시오 (그림 4).
- 아래 단계에 따라 MPO 분석을 수행합니다.
- 50 mmol 인산화 완충액 KH2PO4/Na2HPO4에 0.5% 헥사데실트리메틸암모늄 브로마이드를용해시키고 pH를 6.0으로 조정하여 균질화 완충액을 준비한다(상온, RT에서 사용).
- 500 μL의 준비된 완충액이 있는 2 mL 마이크로원심분리 튜브에서 생검을 10분 동안 균질화하고, 직경 5 mm 스테인레스 스틸 비드(두 개의 비드/바이알 추가)를 갖는 호모게나이저를 사용하여 10분 동안 균질화한다( 물자 표 참조). 다음에, 샘플을 4°C에서 15분 동안 냉각시키고, 추가의 10분 동안 균질화시킨다.
참고: 마이크로 원심분리 튜브는 둥근 바닥을 가지므로 비드가 쉽게 움직일 수 있습니다. - 균질액을 -20°C에서 30분 동안 동결시킨다. 해동 및 와류 (샘플이 해동되었는지 확인하십시오). 이 절차를 3x 반복합니다.
- 균질액을 4°C에서 30분 동안 3,000 x g 에서 원심분리한다. 피펫으로 상층액을 수확하십시오. MPO 활성을 단백질 1 mg 당 단위 (U)로 표현하십시오.
참고: 프로토콜은 여기에서 일시 중지할 수 있습니다. 샘플은 -20°C에서 3개월 동안 안정하다. - MPO 활성을 측정하기 위해, 20 μL의 상청액과 200 μL의 MPO 기질 (KH2PO4/Na2HPO4완충액의 50 mmol 중 오르토-디아니신 디하이드로클로라이드 0.167 mg/mL와 5 x 10-4%H202)을 혼합하여 효소 반응을 수행하고 96-웰 평판 플레이트에 첨가한다. 플레이트를 RT에서 20분 동안 인큐베이션한다.
- 200 μL의 MPO 기질에서 0.008 U에서 0.5 U까지의 농도에서 20 μL의 MPO 표준을 사용하여 표준 곡선을 제조하였다. MPO 기질 단독으로, 블랭크 샘플을 준비한다.
주의: 오르토-디아니신 디하이드로클로라이드로 작업하는 동안 마스크를 사용하십시오.
참고 : 플레이트는 단백질 또는 DNA가 결합하지 않도록 결합 능력이 낮은 폴리프로필렌으로 만들어야합니다. - λ = 460 nm의 파장에서 광학 밀도 (OD)를 측정한다. 효소 반응은 10분 동안 안정하다. 표준 곡선에서 테스트된 샘플에서 MPO 활성을 판독합니다.
- 단백질 농도를 측정하기 위해, 상청액 20 μL를 사용하고, 단백질 결정을 위한 비친코닌산 키트로 시험을 수행하고( 표 물질 참조), λ = 562 nm에서 OD를 측정하였다(도 5).
- 귀 추출물에서 사이토카인의 시험관내 측정을 수행한다.
- 500 μL의 조직 단백질 추출 시약 (T-PER)이있는 2 mL 마이크로 원심분리 튜브에서 RT에서 귀 생검을 10 분 동안 5mm 직경의 스테인레스 스틸 비드가있는 균질 기(두 개의 비드 / 바이알 추가)를 사용하여 균질화하십시오. 다음에, 샘플을 4°C에서 15분 동안 냉각시키고, 추가의 10분 동안 균질화시킨다.
참고: 마이크로 원심분리 튜브는 둥근 바닥을 가지므로 비드가 쉽게 움직일 수 있습니다. - 균질액을 4°C에서 30분 동안 3,000 x g 에서 원심분리한다.
참고: 프로토콜은 여기에서 일시 중지할 수 있습니다. 샘플은 -80°C에서 6개월 동안 안정하다. - 제조자의 지시에 따라 상업적으로 이용가능한 ELISA 세트(예를 들어, IFN-γ)( 물질의 표 참조)를 사용하여 사이토카인 수준을 평가한다(도 6).
- 500 μL의 조직 단백질 추출 시약 (T-PER)이있는 2 mL 마이크로 원심분리 튜브에서 RT에서 귀 생검을 10 분 동안 5mm 직경의 스테인레스 스틸 비드가있는 균질 기(두 개의 비드 / 바이알 추가)를 사용하여 균질화하십시오. 다음에, 샘플을 4°C에서 15분 동안 냉각시키고, 추가의 10분 동안 균질화시킨다.
5. 귀 조직의 조직학
- 귀 두께의 24 시간 측정 직후, 마우스가 여전히 깊게 마취되었을 때, 가위로 가능한 한 두개골에 가까운 귀를 잘라냅니다 (단계 4.1).
참고 :이 절차 후, 마우스는 안락사되어야합니다 (예 : 자궁 경부 탈구에 의해). - 아래 단계에 따라 조직 블록의 파라핀 포매를 수행하십시오.
- 제거 직후 귀를 10 % 포르말린 ~ 10mL에 넣고 24 시간 동안 놓습니다.
- 귀를 조직 처리 카세트에 넣으십시오. 카세트를 탈수 사이클(RT에서 각각 알코올 70%, 90%, 100%, 30분), 클리어링 사이클(자일렌 3x, RT에서 각각 30분) 및 왁스 침윤 사이클(파라핀 3x, 56°C에서 각각 30분)을 위해 자동화된 프로세서( 자료 표 참조)에 넣는다.
- 자동 프로세서에서 카세트를 분리하고 필요할 때까지 워밍 플레이트를 잡으십시오. 왁스 몰드를 따뜻한 왁스 (디스펜서에서)로 채 웁니다.
- 따뜻한 포셉으로 카세트에서 섹션을 제거하고 몰드에 넣으십시오. 다음으로, 카세트베이스를 몰드 상단에 놓은 다음 더 많은 왁스로 채 웁니다. 차가운 접시에 차가운 물에 30 분 동안 놓아 파라핀이 응고되어 시편을 포함하는 블록을 형성하십시오.
- 회전식 마이크로톰( 재료 표 참조)을 사용하여 절편을 ~5 μm 두께로 절단한다. 따뜻한 욕조에 섹션을 띄워 평평하게하십시오. 섹션을 유리 현미경 슬라이드에 집어 넣습니다. RT에서 건조시켜 섹션이 슬라이드에 부착되도록 하십시오.
참고: 염색 중 조직 절편의 손실을 방지하기 위해 접착 물질이나 단백질 코팅을 적용할 필요가 없는 슬라이드를 사용하십시오.
- 헤마톡실린 및 에오신(H&E) 염색을 수행한다.
- 자일렌 (네 가지 접시), 100 % 에탄올 (절대 알코올) (네 가지 접시), 90 % 에탄올, 80 % 에탄올, 70 % 에탄올, 50 % 에탄올, PBS (세 가지 요리), 헤마톡실린 용액, 에오신 용액으로 17 가지 염색 접시를 준비하십시오. 아래 단계에 따라 슬라이드를 한 접시에서 다음 접시로 옮기고 RT에서 모두 수행하십시오.
참고 : 각 접시의 절차는 약 10x 반복 될 수 있습니다 (예 : 20 슬라이드 접시를 사용하는 경우 유체를 변경하지 않고 200 개의 얼룩을 만들 수 있음). - 절편을 인큐베이터에서 30분 동안 65°C에서 인큐베이션함으로써 분리시킨다. 슬라이드를 자일렌에 30분 동안 담그십시오. 새로운 자일렌에서 1x를 30 분 동안 반복하십시오.
- 슬라이드를 100% 에탄올에 5분 동안 담그십시오. 새로운 100% 에탄올에서 1x를 5분 동안 반복한다. 슬라이드를 에탄올 행, 90%, 80%, 70%, 및 50%에 담그고, 각각의 희석액에 2분 동안 침지시킨다.
- 슬라이드를 5분 동안 포스페이트 완충 식염수(PBS)에 침지시킨다. 조직 주위와 슬라이드 뒷면에서 과도한 액체를 닦아냅니다.
- 헤마톡실린 용액 ( 재료 표 참조)에서 섹션을 7-8 분 동안 얼룩지게하십시오. 단면이 손상되지 않도록 뒷면에서 30 초 동안 흐르는 물에 씻으십시오. 5.3.4단계를 반복합니다.
- 30 초 동안 eosin 용액 ( 재료 표 참조)으로 섹션을 얼룩지게하십시오. 단계 5.3.5에서 언급된 바와 같이 세척한 다음, 단계 5.3.4를 반복한다.
- 슬라이드를 100% 에탄올(절대 알코올)에 2분 동안 담그십시오. 2 분 동안 새로운 100 % 에탄올에서 1x를 반복하십시오.
- 슬라이드를 자일렌에 5분 동안 담그십시오. 5 분 동안 새로운 자일렌에서 1x를 반복하십시오.
- 섹션을 RT에서 15분 동안 공기 건조시킵니다. 커버슬립에 장착 매체 한 방울( 재료 표 참조)을 넣은 다음 섹션 상단에 놓습니다.
- 자일렌 (네 가지 접시), 100 % 에탄올 (절대 알코올) (네 가지 접시), 90 % 에탄올, 80 % 에탄올, 70 % 에탄올, 50 % 에탄올, PBS (세 가지 요리), 헤마톡실린 용액, 에오신 용액으로 17 가지 염색 접시를 준비하십시오. 아래 단계에 따라 슬라이드를 한 접시에서 다음 접시로 옮기고 RT에서 모두 수행하십시오.
- 광학 현미경으로 단면을 20x 또는 40x 배율로 검사하고 이미지를 캡처합니다(그림 7).
6. 혈관 투과성 시험
참고 : 귀 두께 측정을 번갈아 가며 혈관 투과성 검사를 수행 할 수 있습니다.
- "0"일째에 마우스를 감작시키고(단계 3.1.1-3.1.3), 이어서, "4"일째에, 마우스를 마취시키고(단계 3.2.2), 귀에 합텐을 직접 도포하고(단계 3.2.4), 0시간 귀 측정을 생략한다.
- 도전 후 23h에서, 마우스를 마취시킨다(단계 3.2.2).
- 둘베코 인산완충식염수(DPBS)에 1% 에반스 블루 염료( 물질 표 참조)의 8.3μL/g 체중을 정맥내(i.v.) 주사한다.
- 마우스를 다시 마취-심부 마취(단계 3.2.2)-1 h 후 에반스 블루 주사한다.
- 귀 생검을 수집합니다 (단계 4.1).
참고 :이 절차 후, 마우스는 안락사되어야합니다 (예 : 자궁 경부 탈구에 의해). - 조직으로부터 염료를 추출하고, 귀 펀치를 포름아미드 1 mL를 함유하는 튜브에 넣고, 5%CO2 의 분위기 중에서 37°C에서 18시간 동안 인큐베이션한다.
- 생검을 RT에서 3분 동안 3,000 x g 에서 원심분리한다.
- 포름아미드를 함유하는 블랭크에 대하여 96-웰 평판 바닥 플레이트에서 λ=565 nm의 파장에서 OD를 측정한다. 색상은 24 시간 동안 안정적입니다. 표준 곡선에서 테스트 샘플의 농도를 판독합니다(0.2-30 μg의 염료/mL 포름아미드 범위의 에반스 블루의 농도 사용).
참고 : 플레이트는 단백질 또는 DNA가 결합하지 않도록 결합 능력이 낮은 폴리프로필렌으로 만들어야합니다.
7. 혈청 수집 및 항-TNP 면역글로불린(IgG1) 항체 측정
- 귀 생검을 수집한 후(단계 4.1), 마우스가 여전히 깊은 마취 상태일 때, 핀셋으로 안구를 제거하고, 마우스에 완만한 압력을 가하고, 역궤도 부비동으로부터 혈액을 튜브 내로 수집한다(혈청을 얻기 위한 겔이 있는 바이알, 표 참조). 혈액을 수집하는 또 다른 방법은 주사기로 심장을 뚫고 혈액을 수집하는 것일 수 있습니다.
참고 : 혈액은 귀를 제거한 후에 수집해야합니다. 동일한 출혈 방법은 혈액 매개 변수18의 잠재적 차이로 인해 전체 연구에서 사용되어야합니다. 이 절차 후, 마우스는 안락사되어야 한다 (예를 들어, 자궁경부 탈구에 의해). - 최소 6x를 반전시키고 혈액이 응고될 때까지 30분 정도 기다린 다음 RT에서 10분 동안 1,300-2,000 x g 에서 원심분리한다.
참고: 프로토콜은 여기에서 일시 중지할 수 있습니다. 샘플은 6개월 동안 -20°C에서 안정하다. - 96웰 플랫 바닥 플레이트를 10μg/mL의 협동으로 DPBS에 용해된 2,4,6-트리니트로페닐(TNP-BSA)과 컨쥬게이션된 50μL의 소 혈청 알부민으로 코팅한다. 다음으로, 두 번째 플레이트를 10 μg/mL의 농도로 DPBS (배경)에 용해된 소 혈청 알부민 (BSA) 단독으로 코팅한다. 4°C에서 하룻밤 동안 인큐베이션한다.
참고 : 마우스 혈청에는 BSA에 대한 항체 (Abs)가 포함되어 있으므로 두 플레이트 모두에서 샘플을 테스트해야하며 다음으로 계산을 수행해야합니다 (OD TNP-BSA - OD BSA). - 플레이트를 0.05% 트윈 20을 함유하는 DPBS 300 μL로 세척한다. 3x를 반복하십시오.
- 분석 희석제 (AD) 준비 : 1 % BSA를 함유하는 DPBS. RT에서 1시간 동안 AD로 웰을 차단하고 다시 세척한다(단계 7.4).
- 내부 표준물질 (iSTD)을 준비한다: 마우스를 TNCB로 감작시키고(단계 3.1.1-3.1.3), 감작 10일 후, 모든 공여자로부터 혈청을 수집하고 폴링한다(단계 7.1 및 단계 7.2).
- 표준 곡선을 만들기 위해 AD로 희석된 iSTD의 등급화된 농도 50 μL를 플레이트에 첨가한다 ( 표 3에 기재됨). 50 μL의 혈청 샘플을 플레이트에 첨가한다. 두 플레이트 모두에서 각 샘플과 표준 곡선을 테스트하십시오 (TNP-BSA 및 BSA 코팅). RT. 플레이트를 세척하여 RT. 2시간 동안 인큐베이션한다(단계 7.4).
- AD로 1:250으로 희석된 50 μL의 비오티닐화 항-마우스 IgG1 모노클로날 항체 (mAb, 표 표 참조)를 첨가하고, RT. 세척에서 1시간 동안 인큐베이션한다 (단계 7.4).
- AD로 1:2000으로 희석된 양고추냉이 퍼옥시다제 스트렙타비딘 (HRD 스트렙타비딘, 물질표 참조) 50 μL를 첨가하고, 어둠 속에서 RT에서 30분 동안 인큐베이션한다. 플레이트를 세척한다(단계 7.4).
- 50 μL의 TMB 기질 ( 물질 표 참조)을 첨가하고, 어둠 속에서 RT에서 30분 동안 인큐베이션한다.
- 25 μL의 1MH2SO4를 첨가하여 효소 반응을 정지시키고; 반응은 30분 동안 안정하다.
- λ = 450nm의 파장과 570nm의 배경에서 OD를 측정합니다 (배경은 450nm 측정마다 빼야합니다). 결과를 제시할 때 샘플 및 표준 곡선에 대한 TNP-BSA에서 BSA 측정값을 뺍니다. 이어서, 표준 곡선에 따라 항체의 단위 (U)를 계산한다 (도 9).
8. CHS 이펙터 세포의 채택 전달
참고: 이 절차는 그림 2에 나와 있습니다.
- 기증자 (1 기증자 : 1 수혜자의 비율) : "0"일에 TNCB로 마우스를 감작시킵니다 (단계 3.1.1-3.1.3).
- "4"일째에, 마우스-심부 마취를 마취한다(단계 3.2.2).
- 겨드랑이 및 사타구니 림프절 (ALN)과 비장 (SPL)을 포셉으로 분리하십시오. ALN을 한 바이알에 모으고 다른 바이알에는 SPL을 함께 모으십시오.
참고 : 각 겨드랑이의 가슴 근육 뒤에는 겨드랑이 림프절이 하나 있습니다. 엉덩이 부위의 한 사타구니 림프절은 세 개의 혈관 옆에 있습니다. 비장은 창자와 위 뒤의 몸의 왼쪽에 있습니다19. 생물 안전 캐비닛에서 멸균 도구를 사용하여 멸균 상태를 유지하십시오. 이 절차 후, 마우스는 안락사되어야합니다 (예를 들어, 자궁 경부 탈구에 의해). - 두 현미경 슬라이드의 서리가 내린 끝 사이의 매쉬 조직. 세포 현탁액을 기공 크기가 70 μm인 세포 스트레이너를 통해 통과 시킨다(물자 표 참조).
- 세포를 1% 소 태아 혈청(FBS)으로 보충된 DPBS로 세척하십시오. 4°C에서 10분 동안 300 x g 에서 원심분리한다. 상청액을 데칸트하고, 나머지 세포 펠릿을 DPBS 1-5.0 mL에 재현탁시킨다.
- 혈구측정기20 을 사용하여 살아있는 세포를 트리판 블루와 함께 계수하고, 10 μL의 세포 현탁액을 트리판 블루의 90-990 μL (세포 수에 따라 다름)와 혼합한다. 세포 번호 (10x-100x)를 계산할 때 희석을 고려하십시오.
- ALNs 및 SPL (비율 1:1)의 혼합물을 제조하였다: 8.0 x 106 내지 7.0 x 107/마우스 200 μL의 DPBS에서.
- 수용자 (naïve syngeneic mice): 나이브 수용자 마우스를 마취하고(단계 3.2.2) CHS-이펙터 세포의 혼합물과 함께 i.v.를 주입한다(단계 8.7). 마우스의 대조군에는 어떤 세포도 주입하지 마십시오.
- 챌린지 전(0시간) 및 후(24h)의 귀 두께를 측정합니다(단계 3.2.1-3.2.6).
- 추가적으로, 단리된 CHS-이펙터 세포에 대한 시험을 수행한다 (예를 들어, 세포 표현형 또는 유세포 분석기에 의한 CHS-이펙터 세포에 의한 생산된 사이토카인의 측정). 세포 배양은 또한 확립될 수 있고, 항원의 존재 하에 증식하는 CHS-이펙터 세포의 능력 또는 배양 상청액에서 분비된 사이토카인의 양은21,22 (데이터 제시되지 않음)로 평가될 수 있다.
참고 : 추가 검사를 수행하려면 그에 따라 더 많은 세포 기증자가 필요합니다.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
CHS 유도를 위해, 동물을 150 μL의 5% TNCB 또는 비히클 단독의 가짜 감작으로 피부 페인팅(복부)을 통해 감작시켰다. "4"일째에, 양쪽 귀의 귀 부종 반응은 이전에 TNCB로 감작된 마우스(시험 그룹) 및 대조군 마우스(가짜 감작)에서 0.4% TNCB의 10 μL와 접촉페인팅(challenge)에 의해 유도되었다. 제시된 데이터는 TNCB로 감작되고 도전 4일 후에 샴페인팅된 마우스가 유사하게 도전된 샴-감작된 것들과 비교하여 유의하게 증가된 귀 부종을 발달시켰다는 것을 묘사한다(도 3, 표 2, 시험 대 대조군). 귀 부종 결과는 추가 연구에서 완전히 검증되었으며, 귀 무게 증가에 동의한 마이크로미터로 결정된 귀 부종의 증가(그림 4), MPO 활성(그림 5), 귀 추출물의 IFN-γ 농도(그림 6), 조직학적 검사에서 부종 진피의 두꺼워짐 증가(그림 7) 및 귀 혈관 투과성(그림 8 ). TNP 특이적 IgG1 항체의 농도의 증가는 대조군 동물과 비교했을 때 시험 마우스의 혈청에서도 발견되었다 (도 9).
T 세포 매개 면역 반응의 예로서, CHS는 또한 순진한 신제닉 수용자 마우스로 전달될 수 있다. 공여체는 TNCB 적용에 의해 감작되었고, 이어서, CHS-이펙터 세포를 순진한 수용자 마우스 내로 i.v.를 투여하였고, 이는 합텐으로 도전하고 CHS 24 h 후에 시험하였다 (도 10). 이전에 TNCB로 감작된 기증자로부터 CHS-이펙터 세포를 투여받은 동물은 단지 도전을 받았던 동물에 비해 귀 부종이 유의하게 증가하였다(어떠한 세포도 받지 않았다).
CHS 반응은 복잡한 메커니즘을 가지고 있으며 다양한 세포를 수반합니다. 항원 제시 및 T/B 세포 활성화는 말초 림프 기관(예를 들어, ALN 및 SPL)에서 발생한다. 채택 세포 전달 전에 CD4+ 를 고갈시켰지만 CD8+ 세포는 고갈되지 않은 CHS-이펙터 세포가 수용자 마우스에서 CHS 반응의 부재를 초래하는 것으로 결정되었다. 이들 세포는 IFN-γ(T-box 전사 인자 TBX21, Tbet+) 및 IL-17A(레티노산 수용체-관련 고아 핵 수용체 감마, RORγT+)에 대해 양성인 것으로 밝혀졌다(보충도 1).
대표적인 실험으로부터 제시된 결과는 8-12주령의 C57BL/6 및 CBA/J 수컷 및 암컷 마우스에 대해 수행되었다. 동물 23, 특히 감소의 사용에서3R 규칙에 따라, 본 기사의 목적을 위해, 실험의 결과는 동물의 작은 그룹에 대해 도시된다. 그래프에서의 데이터는 평균 ± SEM으로 나타내었다. 통계적 유의성은 p < 0.05로 설정되었다. 그래프는 Prism 소프트웨어를 사용하여 그려졌습니다 ( 자료 표 참조).

그림 1: CHS의 유도. 감작, 도전 및 귀 측정. 약어: CHS = 접촉 과민 반응; TNCB = 2,4,6-트리니트로클로로벤젠. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: CHS-이펙터 세포의 입양 전달. 약어: ALNs = 겨드랑이 및 사타구니 림프절; CHS = 접촉 과민 반응; i.v. = 정맥내로; SPLs = 비장; TNCB = 2,4,6-트리니트로클로로벤젠. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 3: 마이크로미터로 귀 부종의 측정에 의한 TNCB에 대한 CHS의 대표적인 평가. 마우스는 TNCB (시험 그룹) 또는 가짜 (대조군)를 감작시키고 후속적으로 도전하였다. 귀의 두께는 챌린지 전후에 측정하였고, 귀 팽윤의 차이는 24시간 귀 두께(μm)에서 0시간 귀 두께(μm)를 뺀 값으로 계산하였다. 귀 부종은 평균 ± SEM, ****p < 0.0001, n=10 마우스/군으로 표시하였다 ( 표 2로부터의 데이터). 약어: CHS = 접촉 과민 반응; SEM = 평균의 표준 오차; TNCB = 2,4,6-트리니트로클로로벤젠. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 4: 귀 무게의 측정에 의한 CHS의 대표적인 평가. 귀 무게는 귀 붓기와 일치하는 매개 변수 중 하나입니다. 마우스는 TNCB (시험 그룹) 또는 가짜 (대조군)를 감작시키고 후속적으로 도전하였다. 챌린지 후 24 시간에, 제거 된 귀에서 6mm 직경 펀치를 가져 왔습니다. 펀치는 분석 실험실 저울에서 칭량되었습니다. 귀 무게는 평균 ± SEM, ***p < 0.001, n=10 마우스/군으로서 밀리그램(mg)으로 표시하였다. 약어: CHS = 접촉 과민 반응; SEM = 평균의 표준 오차; TNCB = 2,4,6-트리니트로클로로벤젠. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 5: MPO 활성의 대표적인 평가. 조직 추출물에서 MPO 활성 증가는 귀 염증과 관련이 있습니다. TNCB 감작 마우스(시험 그룹) 및 sham-감작 마우스(대조군)에 도전하였다. 챌린지 후 24 시간에, 귀를 제거하고, 귀의 직경 6mm 펀치를 추출하고 처리하였다. MPO 활성은 단백질 함량 (단백질의 U / g) 당 U로 표현됩니다. 결과는 평균 ± SEM, **p < 0.01, n=5-6 마우스/군으로 표시하였다. 약어: CHS = 접촉 과민 반응; MPO = 골수퍼옥시다제; SEM = 평균의 표준 오차; TNCB = 2,4,6-트리니트로클로로벤젠; U = 단위. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 6: 귀 추출물의 사이토카인 생산-IFN-γ 농도의 대표적인 평가. 마우스는 TNCB (시험 그룹) 또는 가짜 (대조군)를 감작시키고 후속적으로 도전하였다. 도전 후 24 시간에, 귀는 제거되었고, 6mm 직경의 귀 펀치가 취해졌습니다. IFN-γ의 농도는 ELISA에 의해 조직 균질물에서 결정되었다. 결과는 평균 ± SEM, *p < 0.05, n=5 마우스/군으로 나타내었다. 약어: CHS = 접촉 과민 반응; IFN-γ = 인터페론 감마; SEM = 평균의 표준 오차; TNCB = 2,4,6-트리니트로클로로벤젠. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 7: 귀 조직의 대표적인 조직학. 헤마톡실린 및 에오신 염색. 마우스는 TNCB (시험 그룹) 또는 가짜 (대조군)를 감작시키고 후속적으로 도전하였다. (A-C) 시험 그룹의 조직 학적 검사는 표피에 미세 농양 형성과 함께 주로 진피에서 염증성 세포 (단핵 및 다형성 핵 세포)의 농도가 현저히 증가한 것으로 나타났습니다. 부종 진피의 두꺼워짐과 두꺼워진 과형성 표피도 발견되었습니다. (D-E) 대조군. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 8: 대표적인 혈관 투과성 시험. 관찰된 귀 조직 부종은 혈관 투과성 증가의 결과이다. 혈관 투과성의 변화를 확인하기 위해, 마우스는 TNCB (시험 그룹) 또는 가짜 (대조군)를 감작시킨 다음 4 일 후에 도전했다. 챌린지 후 23 시간에, 에반스 블루를 주입하고, 에반스 블루 주사 후 1 시간 후, 동물을 안락사시키고, 귀의 직경 6 mm 펀치를 만들었다. 결과는 평균 ± SEM, **p < 0.01, n=5 마우스/군으로 나타내었다. 약어: CHS = 접촉 과민 반응; SEM = 평균의 표준 오차; TNCB = 2,4,6-트리니트로클로로벤젠. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 9: 대표적인 항-TNP IgG1 항체 측정. 혈청 중의 항-TNP IgG1 항체의 농도는 가짜 감작화 (대조군) 및 TNCB 감작화 (시험 그룹) 마우스에서 합텐 TNCB로 챌린지한 후 24시간 후에 측정하였다. 수집된 혈청을 ELISA에 의해 항체 농도에 대해 시험하였다. 결과는 평균 ± SEM, ***p < 0.001, n=10 마우스/군으로 나타내었다. 약어: CHS = 접촉 과민 반응; IgG1 = 면역글로불린 G 하위클래스 1; SEM = 평균의 표준 오차; TNCB = 2,4,6-트리니트로클로로벤젠. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 10: CHS-이펙터 세포의 대표적인 입양 전달. CHS-이펙터 세포를 TNCB로 감작시킨 공여자로부터 수득하였다. 다음에, 수집된 면역 세포를, 즉 순진한 syngeneic 수용자 내로 주입하였고, 이들은 CHS 이펙터 단계의 유도를 위해 도전되었다. 마우스의 대조군은 챌린지 전에 어떠한 세포도 받지 않았다. 귀의 두께는 챌린지 전후에 측정되었다. 결과는 평균 ± SEM, ***p < 0.001, n=7 마우스/군으로 나타내었다. 약어: CHS = 접촉 과민 반응; SEM = 평균의 표준 오차; TNCB = 2,4,6-트리니트로클로로벤젠. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 마우스 균주 | 감작 용액 (용량) 면도 복부에 |
엘리인용 용액 (복용량) 귀의 양쪽에 / s |
감작/도발의 날 | 심판 | |||||||||||
| BALB/c (H-2d); C57BL/6 (H-2b) TCRδ-/-, β2m-/-, CD1d-/- (B10 PL (H-2 u 배경) |
25 μL의 아세톤-올리브 오일 혼합물 중 0.5% DNFB (비율 4:1) | 5 μL의 아세톤-올리브 오일 혼합물 중 0.1% DNFB (비율 4:1) | 0 / 5 | 22 | |||||||||||
| C57BL/6 (H-2b) | 아세톤-올리브 오일 혼합물에 0.5% DNFB의 50 μL(비율 4:1) | 아세톤-올리브 오일 혼합물 중 0.2% DNFB의 25 μL(비율 4:1) | 0 / 5 | 32 | |||||||||||
| C57BL/6 (H2b); IL-17A-/- (C57BL/6 배경) | 아세톤-에탄올 혼합물 중의 150 μL의 5% TNCB (비율 1:3) | 올리브 오일-아세톤 혼합물 중 0.4% TNCB의 10 μL(비율 1:1) | 0 / 4 | 33 | |||||||||||
| CBA / J (H-2k); C57BL/6 (H-2b) TLR2-/-, MyD88-/-, IL-17A-/- (C57BL/ 6 배경) |
150 μL의 5% TNP-Cl (TNCB)을 아세톤-에탄올 혼합물 (비율 1:3) | 올리브 오일-아세톤 혼합물 중 0.4% TNP-Cl (TNCB) 10 μl(비율 1:1) | 0 / 4 | 21 | |||||||||||
| C57BL/6 (H-2b); BALB/c (H-2d) | 25 μL의 아세톤 중의 1% TNCB | 10 μL의 아세톤 중 0.1 또는 0.2% TNCB (및 최대 1 % 이상) | 0 / 7 | 34 | |||||||||||
| C57BL/6 (H-2b); TLR2-/-/ TLR4-/- (C57BL/6 배경의 이중 녹아웃 마우스) |
100 μL의 3% TNCB를 아세톤 중의 | 아세톤에서 20 μL의 1% TNCB (귀의 뒷면에 있음) | 0 / 5 | 31 | |||||||||||
| C57BL/6 (H-2b) MHC 클래스 II 결핍 마우스 (C57BL/6 배경) |
아세톤-올리브 오일 혼합물 중 3% TNCB의 100 μL(비율 4:1) | 20 μL의 아세톤-올리브 오일 혼합물 중 0.5 또는 1% TNCB (비율 4:1) | 0 / 6 | 35 | |||||||||||
| C57BL/6 (H-2b) | 100 μL의 아세톤 중의 7% TNCB | 20 μL 아세톤 중 1% TNCB | 0 / 5 | 36 | |||||||||||
| C57BL/6 (H-2b) | 에탄올 중 100 μL 3% OX | 20 μL 에탄올 중 1% OX | 0 / 5 | ||||||||||||
| C57BL/6 (H-2b); CD4-/-, CD8-/- (C57BL/ 6 배경) | 아세톤-올리브 오일에 0.5% DNFB의 25 μL(비율 4:1) | 아세톤 올리브 오일에 0.2 % DNFB의 10 μL (비율 4:1) | 0 / 5 | 10 | |||||||||||
| C57BL/6 (H-2b); CD4-/-, CD8-/- (C57BL/ 6 배경) | 150 μL의 3% OX의 알코올-아세톤 (비율 3:1) | 10 μL 알코올-아세톤 중 1% OX (비율 3:1) | 0 / 5 | ||||||||||||
| C57BL/6 (H-2b); C3H/HeN (H-2k); TLR4-/- (C3H/HeJ 배경); MyD88-/- (C57BL/6 배경) | 100 mg/귀의 양쪽 귀의 등쪽에 있는 백색 페트롤라툼에 있는 10%NiCl2 의 귀 | 10%NiCl2 화이트 페트롤라툼 | 0,1,2 / 23, 24 | 37 | |||||||||||
| NOD (H-2g7) MyD88-/- (NOD 배경) | 400 μL의 0.5% FITC를 아세톤 및 디부틸프탈레이트 중의 | 10 μL의 0.1% FITC를 아세톤 및 디부틸 프탈레이트에 | 0 / 5 | 25 | |||||||||||
표 1: 다양한 연구에서 CHS 모델의 비교. 약어: DNFB = 1-플루오로-2,4-디니트로벤젠; FITC = 플루오레세인 이소티오시아네이트; NiCl2 = 니켈(II) 클로라이드; TNCB = 2,4,6-트리니트로클로로벤젠; TNP-Cl = 트리니트로페닐 클로라이드; OX = 옥사졸론. 이 테이블을 다운로드하려면 여기를 클릭하십시오.
| 대조군(음성) | 시험군(CHS 반응) | ||||||
| 마우스 # 귀: L, R | 0 시간 귀 두께 [μm] | 24 시간 귀 두께 [μm] | 24 h – 0 h 귀 두께 [μm] | 마우스 # 귀: L, R | 0 시간 귀 두께 [μm] | 24 시간 귀 두께 [μm] | 24 h – 0 h 귀 두께 [μm] |
| 1 리터 | 365 | 380 | 15 | 1 리터 | 345 | 427.5 | 82.5 |
| 1 R | 335 | 380 | 45 | 1 R | 340 | 455 | 115 |
| 2 리터 | 345 | 355 | 10 | 2 리터 | 355 | 475 | 120 |
| 2 R | 327.5 | 352.5 | 25 | 2 R | 342.5 | 457.5 | 115 |
| 3 리터 | 340 | 370 | 30 | 3 리터 | 340 | 460 | 120 |
| 3 R | 325 | 355 | 30 | 3 R | 345 | 495 | 150 |
| 4 리터 | 335 | 380 | 45 | 4 리터 | 357.5 | 432.5 | 75 |
| 4 R | 340 | 350 | 10 | 4 R | 335 | 402.5 | 67.5 |
| 5 리터 | 350 | 380 | 30 | 5 리터 | 335 | 387.5 | 52.5 |
| 5 R | 337.5 | 360 | 22.5 | 5 R | 335 | 425 | 90 |
| 6 리터 | 335 | 365 | 30 | 6 리터 | 350 | 430 | 80 |
| 6 R | 340 | 375 | 35 | 6 R | 342.5 | 405 | 62.5 |
| 7 리터 | 345 | 337.5 | 0 | 7 리터 | 340 | 502.5 | 162.5 |
| 7 R | 345 | 335 | 0 | 7 R | 327.5 | 447.5 | 120 |
| 8 리터 | 370 | 380 | 10 | 8 리터 | 327.5 | 515 | 187.5 |
| 8 R | 375 | 355 | 0 | 8 R | 327.5 | 540 | 212.5 |
| 9 리터 | 385 | 370 | 0 | 9 리터 | 330 | 415 | 85 |
| 9 R | 342.5 | 362.5 | 20 | 9 R | 327.5 | 390 | 62.5 |
| 10 L | 307.5 | 340 | 32.5 | 10 L | 337.5 | 445 | 107.5 |
| 10 R | 325 | 350 | 25 | 10 R | 352.5 | 455 | 102.5 |
| 의미하다 | 20.75 | 의미하다 | 108.5 | ||||
| ± SEM | 3.245 | ± SEM | 9.565 | ||||
표 2: CHS의 이펙터 단계에서 귀 두께의 차이를 계산하는 대표적인 예. 합텐을 사용한 챌린지 전후의 귀 두께의 차이를 계산합니다 : 24 시간 귀 두께 (μm) - 0 시간 귀 두께 (μm). 각 귀는 별도의 측정으로 계산됩니다. 귀 부종은 마이크로미터(μm) ± SEM, n=20으로 표시된다. 약어: L = 왼쪽; R = 오른쪽. 이 테이블을 다운로드하려면 여기를 클릭하십시오.
| AD를 사용한 iSTD 희석 | 항-TNP IgG1 Ab (U/mL) |
| 100배 | 250 |
| 200배 | 125 |
| 400배 | 62.5 |
| 800배 | 31.25 |
| 1600배 | 15.63 |
| 3200배 | 7.8 |
| AD 만 | 0 |
표 3: 항TNP IgG1 Ab 측정을 위한 표준 곡선에 대한 상이한 농도의 iSTD의 제조. 100x iSTD 희석액은 250 U의 항-TNP IgG1 Ab. 약어로 가정되었다: Ab = 항체; AD = 분석 희석제; iSTD = 내부 표준; IgG1 = 면역글로불린 G 하위클래스 1; TNP = 2,4,6-트리니트로페닐; U = 단위. 이 테이블을 다운로드하려면 여기를 클릭하십시오.
보충 그림 1: CHS-이펙터 세포의 표현형. CHS-이펙터 세포는 이전에 TNCB로 감작된 공여자의 ALN 및 SPL로부터 수득되었다. (a) MACS 기술을 채택하여, CHS-이펙터 세포(전체 ALNs 및 SPLs)를 CD4+ 또는 CD8+ 세포 중 어느 하나로 고갈시켰다. 이어서, 입양 세포 전달은 CHS 이펙터 단계의 유도 이전에 수행되었다. 귀 팽윤은 평균 ± SEM. (B-E) 유세포 분석 기술을 사용하여, CHS-이펙터 및 나이브 (나이브 마우스로부터 수득된) 세포를 분석 전에 IFN-γ, Tbet, IL-17A 및 RORγt에 대해 염색하였다. 세포를 TCRβ+CD4+ 집단에 대해 게이팅하였다. 결과는 평균 ± SEM, ***p < 0.001, **p < 0.01, *p < 0.05, n=4-6 마우스/군으로 나타내었다. 약어: ALNs = 겨드랑이 및 사타구니 림프절; CD4 = 분화의 클러스터 4; CHS = 접촉 과민 반응; IFN-γ = 인터페론 감마; IL = 인터루킨; MACS = 자기-활성화된 세포 정렬; ns = 유의하지 않음; RORγt = 레티노산-관련 고아 핵 수용체 감마; SEM = 평균의 표준 오차; SPLs = 비장; Tbet = T-박스 전사 인자 TBX21; TCRβ = T 세포 수용체 베타; TNCB = 2,4,6-트리니트로클로로벤젠. 이 파일을 다운로드하려면 여기를 클릭하십시오.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
CHS는 합텐을 통해 유도되며, 이는 피부의 자체 단백질 항원에 결합하여 신 항원을 생성합니다. CHS는 순환 항원 특이적 CHS-이펙터 T 세포의 국소 혈관외 모집에 의해 매개되며, 이는 도전된 조직에서 팽윤을 초래하고, 동일한 합텐6에 이차 피부의 노출 후 24 h를 피크로 한다. 조직의 팽윤은 주로 백혈구 및 백혈구 의존성 피브린 침착(24)의 침윤에 의해 야기된다. 이러한 변화는 마이크로미터로 감지할 수 있으며, 얕텐 감작 및 도전 마우스와 가짜 감작 및 도전 마우스의 귀 붓기를 측정할 수 있습니다.
CHS는 또한 귀 무게의 비교에 의해 결정될 수 있다. 그런 다음, 귀 중량 결정에 사용되는 귀 펀치가 추가 테스트에 사용될 수 있습니다. 염증이있는 귀에 침윤 된 세포는 사이토 카인 생성 T 림프구와 MPO 양성 호중구로 구성됩니다. 귀 조직 균질액에서, 다양한 파라미터, 예컨대 MPO 활성 또는 전염증성 사이토카인 (예를 들어, TNF-α, IFN-γ, IL-17A, 또는 기타)의 농도를 ELISA 검정을 사용하여 측정하거나 qPCR 검정25를 사용하여 피부에서 사이토카인 mRNA의 발현을 측정할 수 있다. 추가적으로, 용기 투과도 변화는 에반스 블루 테스트21,26을 사용하여 평가될 수 있다.
염증이있는 귀 조직에서 관찰 된 변화는 T 세포 증식 및 사이토 카인 생산을 강조하는 시험관 내 테스트로 보완 될 수 있습니다. 이는 합텐-컨쥬게이션된 단백질 항원(22,27)의 존재 하에 ALNs를 배양함으로써 용이하게 달성될 수 있다. 감작되었지만 도전받지 않은 마우스로부터 분리된 ALNs에 의한 사이토카인 분비의 평가는 이들의 유도 대신에 CHS-이펙터 세포에 의한 사이토카인 생산에 관한 세부사항을 제공한다.
제한
많은 마이크로 미터는 다른 정확도로 귀 붓기를 측정합니다. 예를 들어, 가장 낮은 압력은 스프링 캘리퍼에 의해 가해지므로 결과는 실제 두께 귀 측정을 가장 잘 반영하는 것으로 보입니다. 그러나 Mitutoyo와 같이 더 많은 압력을 가하는 마이크로 미터는 부종 형성의 초기 단계에서 귀에 축적되는 유체를 더 단단히 압축 할 가능성이 큽니다. CHS의 이phasic 특성은 더 많은 압력이 가해지기 때문에 이러한 마이크로미터를 사용하여 더 명확하게 시각화 할 수 있습니다. 이것은 가벼운 압력28을 갖는 스프링 캘리퍼를 사용할 때 더 어렵다. 그럼에도 불구하고, 일부 연구에서, 귀의 두께는 캘리퍼29로 측정되었다. 또한 관찰자의 경험은 관찰자가 실험 그룹을 알지 못하더라도 주관적인 감정에 의해 영향을받을 수있는 정확한 측정을 보장합니다.
마이크로미터로 귀 부종의 측정을 확인하는 데 도움이 될 수 있는 대체 방법이 여기에 설명되어 있으며, 제시된 데이터를보다 신뢰할 수 있고 덜 주관적으로 만듭니다. 그러나 CHS를 평가하기위한 이러한 대체 전략은 한 시점에서만 사용할 수 있습니다. 마이크로미터 측정은 다양한 시점에서 반복될 수 있으므로 CHS 동역학을 연구할 수 있습니다.
수정
우리 실험실에서 사용하는 CHS 반응을 연구하기위한 프로토콜은 합텐의 복용량과 유도 및 감작에 사용되는 용매 조성뿐만 아니라 반응이 평가되는 시점을 포함하여 다른 실험실에서 사용되는 프로토콜과 크게 다릅니다. 귀 두께는 상이한 시점들(예를 들어, 챌린지 후 2 h, 24 h, 48 h 및 72 h)10,30에서 측정될 수 있다. 표 1은 다양한 실험 모델, 특히 다양한 연구에서 사용된 동물 균주, 합텐 및 감작/도전 시간의 차이 10,21,22,26,31,32,33,34,35,36,37을 보여줍니다. . CHS 프로토콜은 또한 마우스의 복부를 면도하지 않고 수행 될 수 있습니다.
다음 차이점은 유도 (도전) 자체의 실행에 관한 것입니다. 전형적으로, 감작은 합텐 또는 차량만으로 면도 된 마우스의 복부 피부를 페인팅함으로써 수행됩니다. 그 후, 두 그룹 모두에서 한쪽 귀는 각 귀쪽에 희석 된 합텐으로 도전합니다. 컨트롤로서, 반대쪽 귀는 동일한 양의 차량만으로10,31로 칠해집니다.
중요한 단계
가장 중요한 순간은 테스트 결과가 CHS에 의존하기 때문에 CHS를 트리거하는 것입니다. (1) Hapten 용액은 매우 휘발성이며 빛에 민감하므로 단단히 닫고 빛으로부터 보호해야하며 사용 중일 때 동물의 피부에 신속하게 적용하여 증발하지 않아야합니다. (2) 합텐을 복부의 피부에 도포 한 후, 쥐가 침구에 묻히거나 발로 귀에 적용 할 수 있기 때문에 동물이 새장으로 돌아 오기 전에 말려야합니다 (귀의 두께 측정이 부적절 할 수 있음). (3) 용매 내성 마커로 마우스 꼬리를 표시하는 것과 같은 동물을 라벨링하는 다양한 방법도 공지되어 있다. 그러나, 마커에 존재하는 염료는 (연구되지 않은) 합텐이 되고 CHS를 트리거할 수 있다. 따라서이 연구에서는 반응에 영향을 미치지 않는 마킹 방법을 선택했습니다. (4) 면도 방법은 피부를 자극 할 수 있으므로 매우 중요합니다. 이 프로토콜에서는 회색 비누가 진정 특성을 가지고 있기 때문에 사용되었습니다. 그것은 항균 효과에 의해 도움되는 사소한 상처와 곪은 상처의 치료를 가속화합니다. 그것은 피부의 붓기와 염증을 진정시킵니다.
동물 사용 (균주 및 성별)을 포함한 실험 절차의 추가 조사 및 표준화는 다른 연구의 결과를 비교하기 위해 필요합니다.
생물학적 기능을 가진 많은 다른 환경 요인과 새로운 물질은 CHS 모델에서 테스트 할 수 있습니다. 이 모델은 연구자들이 시험된 인자가 T 세포 의존성 면역 반응을 조절하는지 보여주고 싶을 때 유용할 수 있다.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
저자는 공개 할 것이 없습니다.
Acknowledgments
이 연구는 서브벤션 SUBZ에 의해 뒷받침되었다. 폴란드 브로츠와프에있는 의과 대학의 A020.22.060 및 과학 고등 교육부 N N401 545940에서 MS 및 IP2012 0443 72에 대한 보조금으로 MMS에.
Materials
| Name | Company | Catalog Number | Comments |
| 70% ethanol | Merck KGaA, Darmstadt, Germany | 65350-M | for surface disinfection |
| 96-well flat-bottom plates, polypropylene | Greiner Bio-One GmbH, Kremsmunster, Austria | 655101 | for MPO and Evans blue measurement - plates should be made of polypropylene, that has a lower binding capacity so proteins or DNA will not bind |
| Acetone (ACS reagent, ≥99.5%) | Merck KGaA, Darmstadt, Germany | 179124 | |
| Aluminum foil | Merck KGaA, Darmstadt, Germany | Z185140 | |
| Analytical balance | Sartorius Weighing Technology GmbH, Goettingen, Germany | PRACTUM224-1s, 29105177 | |
| Automated tissue processor | MediMeas Instruments, Sarsehri, Haryana, India | MTP-E-212 | automatically prepare tissue samples by fixing, dehydrating, clearing, and infiltrating them with paraffin |
| BD Vacutainer SST II Advance (tube with gel for obtaining serum) | Becton Dickinson (BD), Franklin Lakes, NJ, USA | BD 366882 | |
| Bicinchoninic acid kit for protein determination | Merck KGaA, Darmstadt, Germany | BCA1-1KT | |
| Biotin Rat Anti-Mouse IgG1 | Becton Dickinson (BD Biosciences), Franklin Lakes, NJ, USA | 553441 | |
| BSA (bovine serum albumine) | Merck KGaA, Darmstadt, Germany | A9418 | protein assays & analysis, 2 mg/mL |
| Cell strainer, pore size 70 μm | BIOLOGIX, China | 15-1070 | suitable for 50 mL tubes |
| Coverslip | VWR, Radnor, Pennsylvania, United States | 631-1583 | 24 mm, but it possible to use different size |
| Disposable pipettes capacity: 5 mL, 10 mL, 25 mL | Merck KGaA, Darmstadt, Germany | Z740301, Z740302, Z740303 | |
| DPBS (Dulbecco′s phosphate buffered saline) | ThermoFisher Scientific, Waltham, Massachusetts, USA | 14190144 | no calcium, no magnesium, mammalian cell culture |
| DPX Mountant for histology | Merck KGaA, Darmstadt, Germany | 6522 | mounting media for H-E, might be used some other e.g, Canada balsam |
| Dumont 5 tweezers - straight | Animalab, Poznan, Poland | 11251-10FST | surgical instruments for procedures on mice (should be steriled) |
| Dumont 7 tweezers - bent | Animalab, Poznan, Poland | 11272-50FST | surgical instruments for procedures on mice (should be steriled) |
| Eosin Y solution, alcoholic | Merck KGaA, Darmstadt, Germany | HT110116 | |
| Eppendorf Safe-Lock Tubes 1.5 mL | Eppenforf, Germany | 3,01,20,086 | polypropylene |
| Eppendorf Safe-Lock Tubes, 2.0 mL | Eppenforf, Germany | 3,01,20,094 | polypropylene, round bottom (the homogenization beads can easily move) |
| Ethanol 100% (absolute alkohol) | Merck KGaA, Darmstadt, Germany | 1.07017 | |
| Ethanol 96% | Merck KGaA, Darmstadt, Germany | 1.59010 | |
| Evans blue | Merck KGaA, Darmstadt, Germany | E2129 | |
| FBS (fetal bovine serum) | ThermoFisher Scientific, Waltham, Massachusetts, USA | A3160802 | |
| Formalin solution, neutral buffered, 10% | Merck KGaA, Darmstadt, Germany | HT501128 | |
| Formamide 99.5% (GC) | Merck KGaA, Darmstadt, Germany | F7503 | |
| Freezer -20 °C | Bosch, Germany | GSN54AW30 | |
| Fridge +4 °C / freezer -20 °C | Bosch, Germany | KGV36V10 | mammalian Cell Culture, qualified, Brazil, 10 x 50 mL |
| Glass microskope slides, SuperFrost Plus | VWR, Radnor, Pennsylvania, United States | 631-0108, 631-0446, 631-0447, 631-0448, 631-0449 | Slides that eliminates the need to apply adhesive materials or protein coatings, to preventing any tissue sections loss during staining. |
| Graph Pad Prism | GraphPad Software Inc. | v. 9.4.0 | |
| Grey soap | Pollena Ostrzeszów, Producent Chemii Gospodarczej Sp. Z.o.o. , Sp. K., Poland | Bialy jelen soap bar | grey Soap Bar Natural Hypoallergenic. Generally available product |
| H2SO4 (sulfuric acid) 1 mol/l (1 M) | Merck KGaA, Darmstadt, Germany | 1.60313 | |
| Harris hematoxylin solution | Merck KGaA, Darmstadt, Germany | HHS16 | |
| Hemocytometer | VWR, Avantor, U.S.A | 612-5719 | manual counting chamber is recommend, which is more accurate |
| Hexadecyltrimethylammonium bromide | Merck KGaA, Darmstadt, Germany | H5882 | |
| Homogenizer | QIAGEN Hilden, Germany | Tissue Lyser LT, SN 23.1001/05234 | homogenizer with stainless steel beads (diameter 5 mm) for 2 mL centrifuge tubes |
| Horseradish peroxidase streptavidin (HRP streptavidin) | Vector Laboratories, Inc., Burlingame, CA, USA | SA-5004-1 | |
| Hydrogen peroxide solution (H202) | Merck KGaA, Darmstadt, Germany | H1009 | |
| Incubator Heracell 150i | Thermo Electron LED Gmbh, Germany | 41071068 | 37 oC in the atmosphere of 5 % CO2, and 65 0C for deparaffinization the sections for histology |
| Ketamine 100 mg/mL, solution for injection | Biowet Pulawy Sp. z o.o., Pulawy, Poland | cat.# not avaliable | |
| KH2PO4 (potassium dihydrogen phosphate) 99.995% anhydrous basis | Merck KGaA, Darmstadt, Germany | 1.05108 | |
| Laboratory Centrifuge | Heraeus Megafuge 1.0R, Thermo Scientific, Germany | B00013899 | speed to 300 x g, with cooling to 4 0C |
| Laboratory Centrifuge | Heraeus Fresco 21, Thermo Scientific, Germany | 75002425 | speed to 3,000 x g, with cooling to 4 0C |
| Mask (FFP2) | VWR, Radnor, Pennsylvania, United States | 111-0917 | for working with ortho-dianisine dihydrochloride |
| Mice | Breeding unit of the Chair of Biomedical Sciences, Faculty of Health Sciences, Jagiellonian University Medical College, Krakow, Poland | CBA/J, C57BL/6 | |
| Micrometer | Mitutoyo, Tokyo, Japan | 193-111 | digit Outside Micrometer, Ratchet Stop, 0-25mm Range, 0.001mm Graduation, +/-0.002mm Accuracy, https://shop.mitutoyo.pl/web/mitutoyo/pl_PL/all/all/Mikrometr%20analogowy%20/PR/193-111/index.xhtml |
| microplate, 96 well, microlon, high binding (for ELISA test) | Greiner Bio-One GmbH, Kremsmunster, Austria | 655061 | with maxi-sorp binding surfaces for reliable and reproducible results in colormetric assays |
| Microscope with objectives | Leica Microsystems CMS GmbH, Germany | DM1000, 294011-082007 | histology presented in the paper was performed under ThermoFisher Scientific EVOS M5000 Imaging System, with objectives: FL 20X LWDPH, 0.40NA/3.1WD and FL 40X LWDPH 0.65NA/1.79WD |
| Myeloperoxidase from human leukocytes (MPO standard) | Merck KGaA, Darmstadt, Germany | M6908 | |
| Na2HPO4 x 7 H2O (sodium phosphate dibasic heptahydrate) | Merck KGaA, Darmstadt, Germany | S9390 | |
| Olive-oil | Merck KGaA, Darmstadt, Germany | 75343 | pure, natural |
| OptEIA Mouse IFN-γ ELISA Set | Becton Dickinson (BD Biosciences), Franklin Lakes, NJ, USA | 555138 | |
| Ortho-dianisine dihydrochloride | Merck KGaA, Darmstadt, Germany | D3252 | |
| Paraffin wax | Merck KGaA, Darmstadt, Germany | 76242 | beads, waxy solid |
| PBS (phosphate buffered saline) | ThermoFisher Scientific, Waltham, Massachusetts, USA | 20012027 | pH 7.2, mammalian cell culture |
| ph meter | Elmetron, Poland | CP-401 | |
| Pipettes, variable volume with tips | Merck KGaA, Darmstadt, Germany | EP3123000900-1EA | 3-pack, Option 1, 0.5-10 uL/10-100 uL/100-1000 uL, includes epT.I.P.S. |
| Razor blade | VWR, Radnor, Pennsylvania, United States | PERS94-0462 | scraper and cutter blades, single edge, aluminium spine, 100 blades per box, individually wrapped |
| Rotary microtome | MRC Laboratory-Instruments, Essex, CM20 2HU UK | HIS-202A | |
| Scissors - straight, sharp / sharp | Animalab, Poznan, Poland | 14060-10FST | Surgical instruments for procedures on mice (should be steriled) |
| Screw cap (open top) | Merck KGaA, Darmstadt, Germany | 27056 | black polypropylene hole cap, for use with 22 mL vial with 20-400 thread |
| Spectrophotometer | BioTek Instruments, U.S.A | 201446 | universal microplate spectrophotometer: λ range: 200 - 999 nm, absorbance measurement range: 0.000 - 4.000 Abs |
| Staining dish 20 slides with rack | Merck KGaA, Darmstadt, Germany | S6141 | e.g. 20 slide staining dishes complete with covers, slide rack and handle |
| Sterile Disposable Biopsy Punch 6mm | Integra LifeSciences, Princeton, NJ, USA | 33-36 | |
| Surgical scissors | Animalab, Poznan, Poland | 52138-46 | surgical instruments for procedures on mice (should be steriled) |
| Tissue processing cassettes | Merck KGaA, Darmstadt, Germany | Z672122 | tissue processing/ embedding cassettes with lid |
| TMB Substrate Reagent Set | Becton Dickinson (BD Biosciences), Franklin Lakes, NJ, USA | 555214 | |
| TNCB (2,4,6-trinitrochlorobenzene) | Tokyo Chemical Industry CO., LTD, Japan | C0307 | |
| TNP-BSA (bovine serum albumin conjugated with 2,4,6-trinitrophenyl) | Biosearch Technologies LGC, Petaluma, CA, USA | T-5050 | |
| T-PER (tissue protein extration reagent) | ThermoFisher Scientific, Waltham, Massachusetts, USA | 78510 | |
| Tubes 15 mL sterile | Merck KGaA, Darmstadt, Germany | CLS430055 (Corning) | polypropylene, conical bottom |
| Tubes 50 mL, sterile | Merck KGaA, Darmstadt, Germany | CLS430290 (Corning) | polypropylene, conical bottom |
| Tween 20 | Merck KGaA, Darmstadt, Germany | P1379 | |
| Vials, screw top, clear glass (vial only) 22 mL | Merck KGaA, Darmstadt, Germany | 27173 | for the preparation of hapten, screwed on so that it does not evaporate |
| Water bath | AJL Electronic, Poland | LW102 | |
| Wax (paraffin) dispenser | VWR, Radnor, Pennsylvania, United States | 114-8737 | |
| Xylazine (xylapan 20 mg/mL) solution for injection | Vetoquinol Biowet Sp. z o.o., Gorzow Wielkopolski, Poland | cat.# not avaliable | |
| Xylene (histological grade) | Merck KGaA, Darmstadt, Germany | 534056 |
References
- Nosbaum, A., Vocanson, M., Rozieres, A., Hennino, A., Nicolas, J. F. Allergic and irritant contact dermatitis. European Journal of Dermatology. 19 (4), 325-332 (2009).
- Hertl, M., et al. Predominance of epidermal CD8+ T lymphocytes in bullous cutaneous reactions caused by beta-lactam antibiotics. The Journal of Investigative Dermatology. 101 (6), 794-799 (1993).
- Martin, S. F. T lymphocyte-mediated immune responses to chemical haptens and metal ions: implications for allergic and autoimmune disease. International Archives of Allergy and Immunology. 134 (3), 186-198 (2004).
- Takeyoshi, M., Iida, K., Suzuki, K., Yamazaki, S. Skin sensitization potency of isoeugenol and its dimers evaluated by a non-radioisotopic modification of the local lymph node assay and guinea pig maximization test. Journal of Applied Toxicology. 28 (4), 530-534 (2008).
- Nakamura, K., Aizawa, M. Studies on the genetic control of picryl chloride contact hypersensitivity reaction in inbred rats. Transplantation Proceedings. 13 (2), 1400-1403 (1981).
- Asherson, G. L., Ptak, W. Contact and delayed hypersensitivity in the mouse. I. Active sensitization and passive transfer. Immunology. 15 (3), 405-416 (1968).
- Honda, T., Egawa, G., Grabbe, S., Kabashima, K. Update of immune events in the murine contact hypersensitivity model: toward the understanding of allergic contact dermatitis. The Journal of Investigative Dermatology. 133 (2), 303-315 (2013).
- Kaplan, D. H., Jenison, M. C., Saeland, S., Shlomchik, W. D., Shlomchik, M. J. Epidermal langerhans cell-deficient mice develop enhanced contact hypersensitivity. Immunity. 23 (6), 611-620 (2005).
- Wang, L., et al. Langerin expressing cells promote skin immune responses under defined conditions. Journal of Immunology. 180 (7), 4722-4727 (2008).
- Wang, B., et al. CD4+ Th1 and CD8+ type 1 cytotoxic T cells both play a crucial role in the full development of contact hypersensitivity. Journal of Immunology. 165 (12), 6783-6790 (2000).
- Mori, T., et al. Cutaneous hypersensitivities to hapten are controlled by IFN-gamma-upregulated keratinocyte Th1 chemokines and IFN-gamma-downregulated langerhans cell Th2 chemokines. The Journal of Investigative Dermatology. 128 (7), 1719-1727 (2008).
- Peszkowski, M. J., Warfvinge, G., Larsson, A. Allergic and irritant contact responses to DNFB in BN and LEW rat strains with different TH1/TH2 profiles. Acta Dermato-Venereologica. 74 (5), 371-374 (1994).
- Henningsen, S. J., Mickell, J., Zachariae, H. Plasma kinins in dinitrochlorobenzene contact dermatitis of guinea-pigs. Acta Allergologica. 25 (5), 327-331 (1970).
- Maibach, H. I., Maguire, H. C. Elicitation of delayed hypersensitivity (DNCB contact dermatitis) in markedly panleukopenic guinea pigs. The Journal of Investigative Dermatology. 41, 123-127 (1963).
- Martel, B. C., Lovato, P., Bäumer, W., Olivry, T. Translational animal models of atopic dermatitis for preclinical studies. The Yale Journal of Biology and Medicine. 90 (3), 389-402 (2017).
- Jin, H., He, R., Oyoshi, M., Geha, R. S. Animal models of atopic dermatitis. The Journal of Investigative Dermatology. 129 (1), 31-40 (2009).
- Li, Y. Z., Lu, X. Y., Jiang, W., Li, L. F. Anti-inflammatory effect of qingpeng ointment in atopic dermatitis-like murine model. Evidence-Based Complementary and Alternative. 2013, 907016 (2013).
- Hoggatt, J., Hoggatt, A. F., Tate, T. A., Fortman, J., Pelus, L. M. Bleeding the laboratory mouse: Not all methods are equal. Experimental Hematology. 44 (2), 132-137 (2016).
- Bedoya, S. K., Wilson, T. D., Collins, E. L., Lau, K., Larkin, J. Isolation and th17 differentiation of naïve CD4 T lymphocytes. Journal of Visualized Experiments. (79), e50765 (2013).
- Vlab, A. Hemocytometer - Counting of Cells. Amrita University. , Available from: https://www.youtube.com/watch?v=MKS0KM3lr90 (2011).
- Majewska-Szczepanik, M., Strzepa, A., Marcińska, K., Wen, L., Szczepanik, M. Epicutaneous immunization with TNP-Ig and Zymosan induces TCRαβ+ CD4+ contrasuppressor cells that reverse skin-induced suppression via IL-17A. International Archives of Allergy and Immunology. 164 (2), 122-136 (2014).
- Majewska-Szczepanik, M., Zemelka-Wiącek, M., Ptak, W., Wen, L., Szczepanik, M. Epicutaneous immunization with DNP-BSA induces CD4+ CD25+ Treg cells that inhibit Tc1-mediated CS. Immunology and Cell Biology. 90 (8), 784-795 (2012).
- Directive 2010/63 / EU of the European Parliament and of the Council of 22 September 2010 on the protection of animals used for scientific purposes. Official Journal of the European Union. , Available from: https://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2010:276:0033:0079:En:PDF (2010).
- Colvin, R. B., Dvorak, H. F. Role of the clotting system in cell-mediated hypersensitivity. II. Kinetics of fibrinogen/fibrin accumulation and vascular permeability changes in tuberculin and cutaneous basophil hypersensitivity reactions. Journal of Immunology. 114, 377-387 (1975).
- Szczepanik, M., et al. Regulation of contact sensitivity in non-obese diabetic (NOD) mice by innate immunity. Contact Dermatitis. 79 (4), 197-207 (2018).
- Askenase, P. W., Majewska-Szczepanik, M., Kerfoot, S., Szczepanik, M. Participation of iNKT cells in the early and late components of Tc1-mediated DNFB contact sensitivity: Cooperative role of γδ-T cells. Scandinavian Journal of Immunology. 73 (5), 465-477 (2011).
- Zemelka-Wiącek, M., Majewska-Szczepanik, M., Ptak, W., Szczepanik, M. Epicutaneous immunization with protein antigen induces antigen-non-specific suppression of CD8 T cell mediated contact sensitivity. Pharmacological Reports. 64 (6), 1485-1496 (2012).
- Van Loveren, H., et al. Use of micrometers and calipers to measure various components of delayed-type hypersensitivity ear swelling reactions in mice. Journal of Immunological Methods. 67 (2), 311-319 (1984).
- Tsuji, R. F., et al. B cell-dependent T cell responses: IgM antibodies are required to elicit contact sensitivity. The Journal of Experimental Medicine. 196 (10), 1277-1290 (2002).
- Campos, R. A., et al. Cutaneous immunization rapidly activates liver invariant Valpha14 NKT cells stimulating B-1 B cells to initiate T cell recruitment for elicitation of contact sensitivity. The Journal of Experimental Medicine. 198 (12), 1785-1796 (2003).
- Rühl-Muth, A. C., Maler, M. D., Esser, P. R., Martin, S. F. Feeding of a fat-enriched diet causes the loss of resistance to contact hypersensitivity. Contact Dermatitis. 85 (4), 398-406 (2021).
- Bour, H., et al. histocompatibility complex class I-restricted CD8+ T cells and class II-restricted CD4+ T cells, respectively, mediate and regulate contact sensitivity to dinitrofluorobenzene. European Journal of Immunology. 25 (11), 3006-3010 (1995).
- Majewska-Szczepanik, M., et al. Obesity aggravates contact hypersensitivity reaction in mice. Contact Dermatitis. 87 (1), 28-39 (2022).
- Katagiri, K., Arakawa, S., Kurahashi, R., Hatano, Y. Impaired contact hypersensitivity in diet-induced obese mice. Journal of Dermatological Science. 46 (2), 117-126 (2007).
- Bouloc, A., Cavani, A., Katz, S. I. Contact hypersensitivity in MHC class II-deficient mice depends on CD8 T lymphocytes primed by immunostimulating Langerhans cells. The Journal of Investigative Dermatology. 111 (1), 44-49 (1998).
- Martin, S., et al. Peptide immunization indicates that CD8+ T cells are the dominant effector cells in trinitrophenyl-specific contact hypersensitivity. The Journal of Investigative Dermatology. 115 (2), 260-266 (2000).
- Vennegaard, M. T., et al. Epicutaneous exposure to nickel induces nickel allergy in mice via a MyD88-dependent and interleukin-1-dependent pathway. Contact Dermatitis. 71 (4), 224-232 (2014).
Tags
면역학 및 감염 문제 187 뮤린 모델 알레르기 성 접촉 피부염 (ACD) 접촉 과민증 (CHS) 귀 부종 혈관 투과성 골수퍼옥시다제 (MPO) 사이토카인 2,4,6-트리니트로클로로벤젠 (TNCB) 합텐Erratum
Formal Correction: Erratum: Contact Hypersensitivity as a Murine Model of Allergic Contact Dermatitis
Posted by JoVE Editors on 01/19/2023.
Citeable Link.
An erratum was issued for: Contact Hypersensitivity as a Murine Model of Allergic Contact Dermatitis. The Protocol and Representative Results sections were updated.
Step 3.2.1 of the Protocol has been updated from:
On day "4", prepare 0.4% hapten: TNCB in an acetone-ethanol mixture (ratio 1:1). Prepare the solution just before use in a glass vial and protect it from light by covering the vial with aluminum foil.
to:
On day "4", prepare 0.4% hapten: TNCB in an acetone: olive oil mixture (ratio 1:1). Prepare the solution just before use in a glass vial and protect it from light by covering the vial with aluminum foil.
Figure 1 of the Representative Results has been updated from:
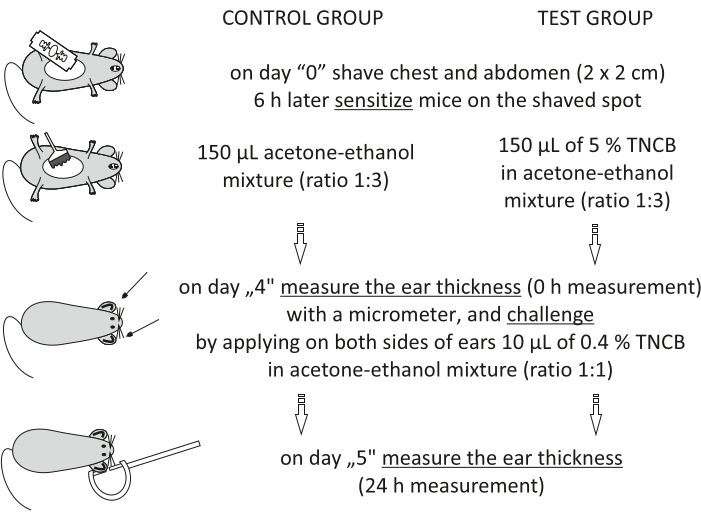
Figure 1: Induction of CHS. Sensitization, challenge, and ear measurement. Abbreviations: CHS = contact hypersensitivity reaction; TNCB = 2,4,6-trinitrochlorobenzene. Please click here to view a larger version of this figure.
to:
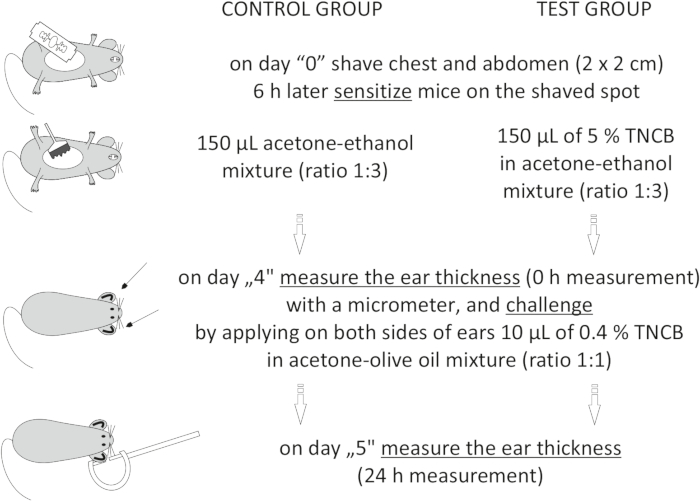
Figure 1: Induction of CHS. Sensitization, challenge, and ear measurement. Abbreviations: CHS = contact hypersensitivity reaction; TNCB = 2,4,6-trinitrochlorobenzene. Please click here to view a larger version of this figure.
Figure 2 of the Representative Results has been updated from:
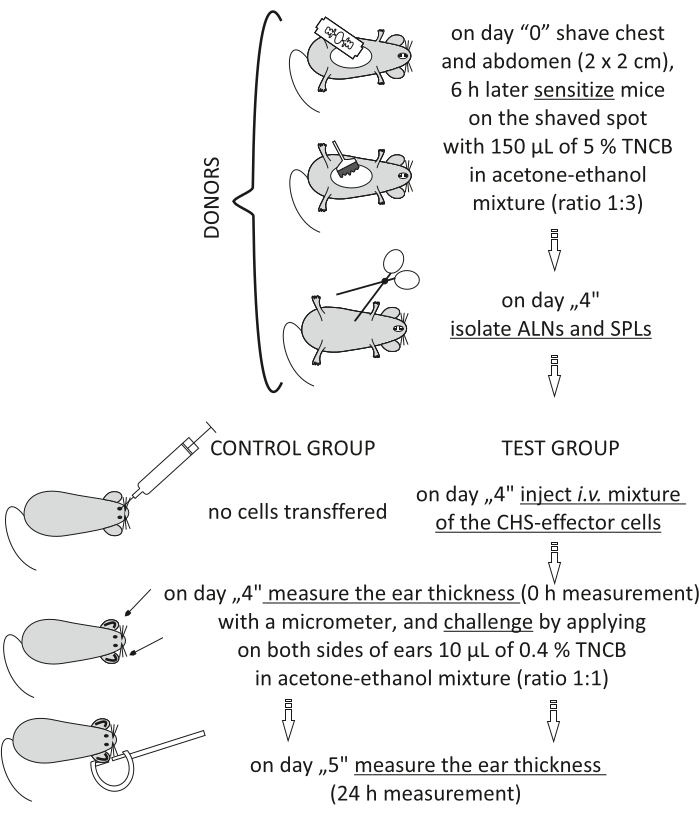
Figure 2: Adoptive transfer of the CHS-effector cells. Abbreviations: ALNs =axillary and inguinal lymph nodes; CHS = contact hypersensitivity reaction; i.v. = intravenously; SPLs = spleens; TNCB = 2,4,6-trinitrochlorobenzene. Please click here to view a larger version of this figure.
to:
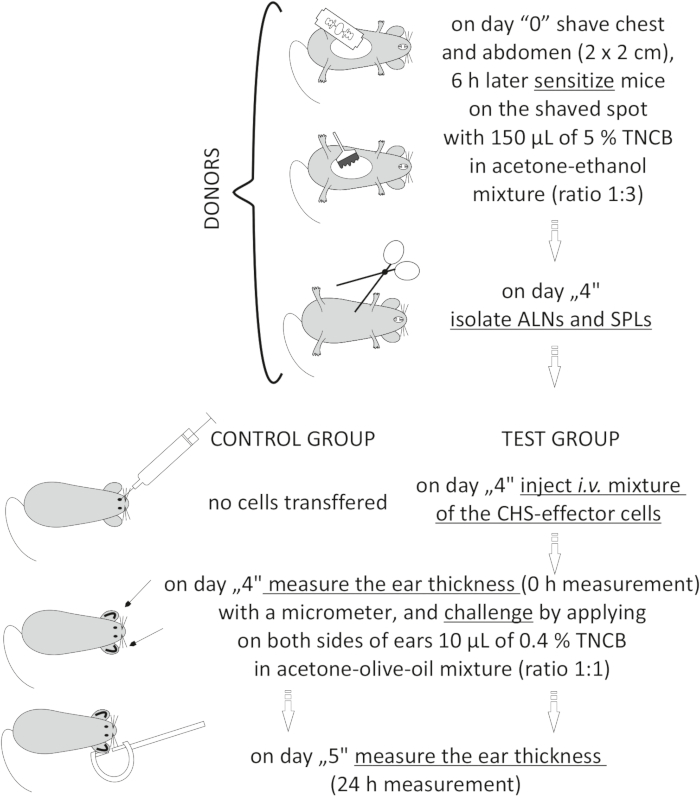
Figure 2: Adoptive transfer of the CHS-effector cells. Abbreviations: ALNs =axillary and inguinal lymph nodes; CHS = contact hypersensitivity reaction; i.v. = intravenously; SPLs = spleens; TNCB = 2,4,6-trinitrochlorobenzene. Please click here to view a larger version of this figure.



