Overview
Source : Laboratoire du Dr Michael Evans, Georgia Institute of Technology
La constante d’équilibre K, pour un système chimique est le rapport des concentrations du produit à des concentrations de réactifs à l’équilibre, chacune à la puissance de leurs coefficients stoechiométriques respectifs. Mesure de K implique la détermination de ces concentrations pour les systèmes en équilibre chimique.
Les systèmes de réaction contenant un seul composant de couleur peuvent être étudiés par spectrophotométrie. La relation entre l’absorbance et la concentration du composant de couleur est mesurée et utilisée pour déterminer sa concentration dans le système de réaction d’intérêt. Peut calculer les concentrations des composants incolores indirectement à l’aide de l’équation chimique équilibrée et la concentration mesurée de la composante de couleur.
Dans cette vidéo, courbe de droit de la bière pour Fe(SCN)2 + est déterminée empiriquement et appliqué à la mesure de K pour la réaction suivante :
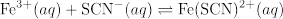
Quatre systèmes de réaction avec différentes concentrations initiales des réactifs sont étudiées pour illustrer que K reste constant indépendamment des concentrations initiales.
Principles
Chaque réaction chimique est associée à une constante d’équilibre K, qui reflète le rapport des concentrations du produit à des concentrations de réactifs à l’équilibre chimique. Pour la réaction générique un A + b B  c C + d D, la constante d’équilibre est définie comme
c C + d D, la constante d’équilibre est définie comme

où les concentrations sur la partie droite de l’équation sont molarités à l’équilibre. Cette équation est connue comme l’expression d’équilibre pour la réaction. Dans les systèmes chimiques qui ne sont pas en équilibre, les réactions et inverses se produisent à des vitesses différentes jusqu'à ce que les concentrations des réactifs et produits répondent à l’expression de l’équilibre.
Pour mesurer la valeur de K pour un système en équilibre chimique, il est nécessaire de déterminer les concentrations des réactifs et de produits directement ou indirectement. Méthodes spectrophotométriques pour la détermination de K impliquent une mesure directe de la concentration d’un composant de couleur et de la mesure indirecte des autres. Spectroscopie visible du composant coloré à des concentrations connues révèle la relation entre absorbance et concentration pour ce composant. Selon la Loi de Beer, cette relation a la forme

où e est l’absorptivité molaire de l’élément en L/mol-cm, l est la longueur du trajet de la lumière à travers l’échantillon en cm, c est la molarité de la composante en mol/L, et A est l’absorbance.
Courbe de droit de la bière pour le composant de couleur peut être appliquée à un système de réaction en équilibre pour déterminer la concentration de ce volet de mesures d’absorbance (Figure 1). Peut ensuite calculer les concentrations des réactifs et des produits restants en ajustant les concentrations initiales basées sur la molarité mesurée de l’espèce colorée.
Le système étudié ici est la réaction du cation fer (III) avec l’anion thiocyanate pour former un complexe de thiocyanate de fer (III).

L’expression de l’équilibre de ce système de réaction est

où l’indice eq désigne des concentrations à l’équilibre. Le produit de sulfocyanure de fer (III) est orange, mais les deux réactifs sont incolores en solution aqueuse. Par conséquent, [Fe(SCN)]2 +eq peut être déterminée directement à partir de mesures d’absorbance.

Concentrations des réactifs à l’équilibre peuvent être calculées en soustrayant la concentration à l’équilibre du produit de la concentration initiale des réactifs. Un tableau Initial-changement-équilibre (glace) illustre comment les concentrations initiales et équilibre sont liées (tableau 1).

Des essais répétés de cette expérience impliquant différentes concentrations initiales des réactifs devraient donner la même valeur de K, la valeur de K est indépendante de la concentration.

La figure 1. Courbe de loi de Beer pour thiocyanate de fer (III).
| Fe3 + | RCS– | Fe(SCN)2 + | |
| Initiales | [Fe3 +] j’ai | [SCN–] j’ai | 0 |
| Changement | –[Fe(SCN)2 +]eq | –[Fe(SCN)2 +]eq | +[Fe(SCN)2 +]eq |
| Équilibre | [Fe3 +] j’ai – [Fe(SCN)]2 +eq | [SCN–] j’ai – [Fe(SCN)]2 +eq | [Fe(SCN)]2 + EQ |
Le tableau 1. Tableau Initial-changement-équilibre (ICE) qui illustre comment les concentrations initiales et équilibre sont liées.
Subscription Required. Please recommend JoVE to your librarian.
Procedure
1. détermination droit courbe de la bière pour Fe(SCN)2 +
- Calibrer un spectrophotomètre visible à l’aide de l’eau distillée comme un blanc.
- Ajouter 1,0 mL de 1,0 × 10-4 M Fe(NO3)3 solution dans un tube à essai.
- Dans le même tube à essai, ajouter 5,0 mL de solution KSCN de 0,50 M.
- Dans le même tube à essai, ajouter 4,0 mL de solution de 0,10 M HNO3 . Couvrir le tube avec un doigt ganté et secouer doucement pour mélanger.
- Utiliser une pipette Pasteur pour transférer une petite quantité de la solution dans une cuvette. S’assurer que le niveau du liquide est au-dessus de la trajectoire du faisceau lumineux dans le spectrophotomètre.
- Placez la cuve dans le spectrophotomètre, afin que la lumière passe à travers les parois transparentes.
- Acquérir un spectre et d’enregistrer la valeur λmax et l’absorbance à λmax.
- Afin de construire la courbe d’une bière droit, des solutions supplémentaires avec des concentrations connues de Fe(SCN)2 + doivent être préparées et mesurées. Répétez les étapes 2 à 7 en utilisant les volumes de Fe (NO3)3, KSCN et HNO3 solutions dans le tableau 2.
- Reporter l’absorbance mesurée par rapport à la concentration de Fe(SCN)2 + dans chaque tube à essai et déterminer la ligne de régression pour les données. La pente de cette droite est l’absorptivité molaire et la longueur du trajet est de 1 cm.
2. mesure K pour le système de Thiocyanate de fer (III)
- Préparer 4 tubes à essai moyens contenant les volumes indiqués de 0,0025 M Fe (NO3)3, 0,0025 M KSCN et 0,10 M HNO3 solutions dans le tableau 3.
- Couvrir chaque tube avec un doigt et secouer doucement pour mélanger. Laissez-les reposer pendant au moins 10 min. Ce repos période veille à ce que les solutions sont à l’équilibre chimique.
- Utiliser une pipette Pasteur pour transférer une petite quantité de solution 6 à une cuvette. S’assurer que le niveau du liquide est au-dessus de la trajectoire du faisceau lumineux dans le spectrophotomètre.
- Acquérir un spectre et d’enregistrer la valeur λmax et l’absorbance à λmax.
- Des réactions multiples avec différentes concentrations initiales des réactifs peuvent être étudiées afin d’illustrer que K ne dépend pas de concentration. Pour déterminer K pour des conditions initiales différentes, répétez les étapes 3 et 4 pour les solutions 7 – 9.
| Nombre de tube | Volume 1,0 x 10– 4 M Fe (pas3)3 (mL) |
Volume 0,50 M KSCN (mL) |
Volume 0,10 M HNO3 (mL) |
| 1 | 1.0 | 5.0 | 4.0 |
| 2 | 2.0 | 5.0 | 3.0 |
| 3 | 3.0 | 5.0 | 2.0 |
| 4 | 4.0 | 5.0 | 1.0 |
| 5 | 5.0 | 5.0 | 0.0 |
Le tableau 2. Échéant des volumes de Fe (NO3)3, KSCN et HNO3 solutions pour être placés dans des tubes de 2-5.
| Nombre de tube | Volume 0,0025 M Fe (pas3)3 (mL) |
Volume 0,0025 M KSCN (mL) |
Volume 0,10 M HNO3 (mL) |
| 6 | 1.0 | 1.0 | 5.0 |
| 7 | 1.0 | 2.0 | 4.0 |
| 8 | 2.0 | 2.0 | 3.0 |
| 9 | 2.0 | 3.0 | 2.0 |
Tableau 3. Volumes appropriés de 0,0025 M Fe (NO3)3, 0,0025 M KSCN et 0,10 M HNO3 solutions.
Détermination de la constante d’équilibre d’une réaction chimique peut fournir des informations importantes concernant la mesure dans laquelle il formera produits au fil du temps.
Chaque réaction chimique est associée à une constante d’équilibre K, ce qui reflète le rapport entre les concentrations des réactifs et produits lors de la réaction a cessé de progresser. Pour mesurer le K, ces concentrations doivent être déterminées.
Si une réaction contient un composant de couleur unique, son interaction avec la lumière peut être mesurée pour discerner sa concentration. Les concentrations des composants non colorées peuvent alors être calculées indirectement à l’aide de l’équation chimique équilibrée. Cette vidéo illustre l’utilisation d’un spectrophotomètre à déterminer empiriquement la constante d’équilibre d’une réaction de thiocyanante de fer.
Réactions chimiques plus aller de l’avant dans les directions avance et arrière. Comme la réaction progresse, il atteint un point où les réactions et inverses se produisent au même rythme. Ceci est connu comme l’équilibre chimique. Cet état d’équilibre, le rapport des concentrations du produit à des concentrations de réactifs, chacune à la puissance de leurs coefficients stoechiométriques, correspond à la constante d’équilibre K. Sur mesure K pour un système d’intérêt, les coefficients doivent être connues, et la concentration doit être déterminée, directement ou indirectement. Conformément à la Loi de Beer-Lambert, la concentration d’une espèce colorée est proportionnelle à son absorption, qui est la quantité d’énergie qu’elle absorbe à une longueur d’onde spécifique de la lumière. Ceci peut être exprimé mathématiquement, où A est absorbance, epsilon est le coefficient d’atténuation molaire, qui est spécifique à un composé, l est la longueur de chemin d’accès par le biais de l’échantillon, et c est la concentration. Une courbe d’étalonnage est créée en testant plusieurs solutions de concentration connue et traçant les valeurs d’absorbance obtenue. Avec cette courbe d’étalonnage de concentration inconnue des solutions peuvent être étudiées. Mesures d’absorbance sont utilisées pour déterminer la concentration de l’espèce colorée. Ensuite, on peuvent calculer les concentrations des réactifs et des produits restants. La procédure suivante permettra d’étudier la réaction du fer trois avec le thiocyanate pour former un complexe de thiocyanate de fer.
Une fois que les concentrations ont été mesurées, la valeur de K peut être calculée avec une initiale-changement-équilibre, ou de la glace, tableau qui sera expliqué plus loin dans les résultats.
Maintenant que vous comprenez comment les méthodes spectrophotométriques peuvent être utilisés pour déterminer la constante d’équilibre, vous êtes prêt à commencer la procédure.
Avant de mesurer l’échantillon, une courbe d’étalonnage doit être générée.
Pour commencer, zéro un spectrophotomètre UV-visible à l’aide d’eau distillée comme un vide pour ne représenter aucune absorption. Lorsque vous insérez une cuvette dans le spectrophotomètre, veiller à ce qu’il est orienté alors la lumière passe à travers les parois transparentes, et que le niveau du liquide se trouve au-dessus du faisceau.
Ensuite, préparer 5 tubes à essai contenant les volumes indiqués de chaque solution de réactif comme indiqué dans le protocole du texte, qui produira à différentes concentrations du produit. Couvrir chaque tube avec un doigt ganté et secouer doucement pour mélanger. Laisser les tubes se reposer pendant 10 min. utilisation un Pasteur pipette pour transférer une petite quantité de solution 1 dans une cuvette et placez-le dans le spectrophotomètre. Acquérir un spectre et consigner le λmax et son absorbance. Répétez ce processus pour les solutions 2 à 5, en utilisant une nouvelle cuvette de chaque série.
Reporter l’absorbance mesurée par rapport à la concentration de sulfocyanure de fer pour chaque solution. Déterminer la ligne de régression pour les données. La pente de cette droite est le coefficient d’atténuation molaire.
Maintenant que les données pour les solutions étalons a été acquis, préparer quatre tubes à essai moyens contenant les volumes indiqués de solutions comme indiqué dans le protocole du texte.
Couvrir chaque tube avec un doigt et secouer doucement pour mélanger. Laissez-les reposer pendant au moins 10 min. Cette période de repos permet les solutions atteindre l’équilibre chimique.
Utiliser une pipette Pasteur pour transférer une petite quantité de solution 6 dans une cuvette et placez-le dans le spectrophotomètre. Acquérir un spectre et d’enregistrer la valeur λmax et l’absorbance mesurée à la λmax. Répétez ce processus pour les solutions 7 – 9.
Une fois que tous les échantillons ont été mesurés, les données molarité et absorbance de solutions de 1 à 5 peuvent être analysées. Un grand excès de thiocyanate servait à faire en sorte que tous le fer chimiquement, ce qui simplifie l’analyse.
Les données sont tracées pour créer une courbe d’étalonnage. La longueur du trajet de la lumière, l, est généralement de 1 cm et peut être pris en compte dans les calculs. La pente de la droite, qui a été évaluée à 7600, est donc le coefficient d’atténuation. Pour les solutions de test de 6 à 9, cette valeur et l’absorbance sont utilisés pour calculer les concentrations de sulfocyanure de fer à l’équilibre. Avec ces données, la table de glace pourrait alors être utilisée.
Les concentrations des réactifs initiaux sont basées sur les molarités connues de fer et du thiocyanate ajouté à la solution et le volume total de la réaction. Parce que le produit est formé par la réaction de 1:1 du fer et du thiocyanate, concentration à l’équilibre de chaque diminution de la quantité de produit formé. La concentration à l’équilibre de chaque espèce est maintenant connue. Ces valeurs sont utilisées pour calculer la constante d’équilibre pour chaque solution. Les valeurs sont à peu près constantes dans la gamme de concentrations étudiées.
Le concept de la constante d’équilibre est important pour un large éventail de domaines scientifiques. La constante d’équilibre peut être utilisée pour fournir des informations utiles sur l’étendue à laquelle se forme une réaction produits au fil du temps. Dans cet exemple, on a observé des deux réactions contenant du violet de gentiane.
La première solution était composée de violet de gentiane et d’hydroxyde de sodium. La couleur a été observée à rapidement changer du violet incolore. Cette réaction a une valeur très élevée de K, indiquant que les produits forment presque complètement au fil du temps.
Cristal violet puis réagit avec l’acétate de sodium. Cette solution est resté violette indéfiniment. Cette réaction a une très faible valeur de K, donc il ne se livre pas avancer de manière significative.
Enfin, la constante de dissociation, un type spécifique de la constante d’équilibre — peut être utilisé pour décrire le comportement de la protéine. Dans cet exemple, les changements dans la structure de l’ARN ont été suivis dans les tampons de réaction de magnésium.
L’ARN purifié a été mélangé dans la solution avec des concentrations connues de magnésium et a permis d’atteindre l’équilibre. Ensuite, la structure d’ARN qui en résulte a été tracée.
Dans ce cas, des concentrations plus élevées de magnésium causé des sites réactifs sur l’ARN pour être moins protégé, produisant un Kd qui était la moitié de la valeur.
Vous avez juste regardé introduction de JoVE à dosage spectrophotométrique de la constante d’équilibre. Vous devez maintenant comprendre la relation définie par la Loi de Beer-Lambert, comment faire pour déterminer la concentration de l’absorbance à l’aide d’un spectrophotomètre et comment calculer une constante d’équilibre en utilisant des concentrations à l’équilibre.
Merci de regarder !
Subscription Required. Please recommend JoVE to your librarian.
Results
Tableau 4 répertorie les données absorbance et la concentration des solutions 1 – 5. Concentrations de Fe(SCN)2 + ont été déterminées à partir des concentrations initiales de Fe3 + sous l’hypothèse que toutes les Fe3 + est converti en Fe(SCN)2 +. Un grand excès de SCN– a été utilisé dans des tubes de 1 à 5 pour s’assurer que cette hypothèse est vraie.
La molarité [Fe(SCN)]2 +et l’absorbance sont tracés sur la Figure 2. L’absorbance mesurée concordent bien avec la Loi de Beer.
Tableau 5 répertorie les absorbances mesurées et les valeurs de K calculées pour tubes de 6 à 9. Les valeurs de K ont été déterminées à l’aide de la méthode de table de glace. Les concentrations des réactifs initiaux étaient fondées sur les molarités connues de Fe3 + et SCN– dans les solutions de réactif et le volume total de la réaction (10 mL). La concentration à l’équilibre de la Fe(SCN)2 + dépendait de démarcation absorbance mesurée par l’absorptivité molaire de Fe(SCN)2 +. Parce que tout le produit a été formé par la réaction de 1:1 de Fe3 + et SCN–, la concentration d’équilibre de Fe(SCN)2 + correspond à la diminution dans la concentration des réactifs. Le tableau 6 présente le processus pour tube à essai 6.
La constante d’équilibre est calculée d’après les concentrations dans la ligne d’équilibre. Pour tube à essai 6,

La moyenne valeur K était de 147 ± 11, illustrant que K est à peu près constante dans la gamme de concentrations étudiées.

Figure 2. Ligne graphique de l’Absorbance versus la Concentration pour Fe(SCN)2 +.
| Tube | [Fe(SCN)]2 + (mol/L) | Absorbance |
| 1 | 1,00 x 10-5 | 0,10 |
| 2 | 2.00 x 10-5 | 0.20 |
| 3 | 3,00 x 10-5 | 0.25 |
| 4 | 4.00 x 10-5 | 0,32 |
| 5 | 5,00 x 10-5 | 0,42 |
Tableau 4. Absorbance par rapport aux données de Concentration pour Fe(SCN)2 +.
| Tube | Absorbance | K |
| 6 | 0,120 | 136 |
| 7 | 0,268 | 161 |
| 8 | 0,461 | 142 |
| 9 | 0.695 | 150 |
Tableau 5. Mesuré les valeurs d’absorbance et K calculée pour la réaction du fer (III) avec le thiocyanate.
| [Fe3 +] (mol/L) | [SCN–] (mol/L) | [Fe(SCN)]2 + (mol/L) | |
| Initiales | 3,57 x 10– 4 | 3,57 x 10– 4 | 0 |
| Changement | –1.58 x 10-5 | –1.58 x 10-5 | +1.58 x 10-5 |
| Équilibre | 3.41 x 10– 4 | 3.41 x 10– 4 | 1,58 x 10-5 |
Tableau 6. La table de glace qui illustre le processus utilisé pour tube à essai 6.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
La constante d’équilibre fournit des informations utiles sur la mesure dans laquelle une réaction va se prononcer pour former des produits au fil du temps. Réactions avec une valeur élevée de K, beaucoup plus grand que 1, formeront des produits presque complet donnés assez de temps (Figure 3). Réactions d’une valeur de K inférieur à 1 ne seront effectuera pas avancer de manière significative ? La constante d’équilibre sert donc d’une mesure de la faisabilité d’une réaction chimique.

Figure 3. La constante d’équilibre de cette réaction est supérieure à 1. Une quantité importante du produit coloré forme dans chaque cas, même si les concentrations initiales des réactifs diffèrent.
La constante d’équilibre fournit également des informations utiles de thermodynamiques sur les variations d’énergie libre, enthalpie et entropie au cours d’une réaction chimique. La constante d’équilibre est liée à la variation d’énergie libre de la réaction :

La variation d’énergie libre de la réaction est liée à son tour pour les changements d’enthalpie et d’entropie de réaction :

Mesures de la température de K peuvent révéler que la Δ de changement d’enthalpieH et l’entropie changent ΔS pour une réaction. Outre les chimistes avec aperçu des modèles de comportement moléculaire, tables de données thermodynamiques peuvent servir à identifier les réactions avec les propriétés thermodynamiques favorables. Par exemple, des réactions d’oxydo-réduction qui libèrent de grandes quantités d’énergie (associée aux valeurs deG négatif Δ) sont candidats attrayants pour les batteries.
Les valeurs de K pour des réactions de dissociation acide (une valeursK) sont utiles pour prédire les résultats des réactions acide-base, qui sont sous contrôle thermodynamique. Acides forts sont associés aux grands Kune faible et valeurs acides avec petit Kune valeurs. les indicateurs de pH sont des acides faibles avec des formes acides et basique différemment colorées, et la pKun (le logarithme de base 10 négatif de Kun) d’un indicateur représente le pH au cours de laquelle un changement de couleur se produit sous forme acide ou base est ajoutée à une solution de l’indicateur.
De même,une valeurs de Ksont utilisés dans la préparation de solutions tampons pour atteindre une valeur cible de pH. Le pKun d’un acide faible représente le pH au cours de laquelle l’acide et sa base conjuguée sont présents dans la solution en concentrations égales. Lorsque les quantités d’un acide faible égales et sa base conjuguée sont dissous dans une solution, le pH de la solution est égale à la pKa de l’acide faible.
Subscription Required. Please recommend JoVE to your librarian.




