Overview
출처: 틸드 앤더슨1,롤프 루드1
1 임상 과학 룬드학과, 감염 의학 학과, 생물 의학 센터, 룬드 대학, 221 00 룬드, 스웨덴
박테리오파지 또는 단순히 파지에게 불린 대핵 생물을 감염시키는 바이러스는, Twort (1) 및 d'Hérelle (2)에 의해 20세기 초에 독립적으로 확인되었습니다. 파지는 이후 널리 그들의 치료 값 (3) 및 인간에 미치는 영향에 대 한 그들의 영향에 대 한 인식 되었습니다 (4), 글로벌, 생태계 (5). 현재의 관심사는 전염병의 치료에 현대 항생제에 대한 대안으로 파지의 사용에 대한 새로운 관심을 연료 (6). 본질적으로 모든 파지 연구는 바이러스를 정화하고 정량화하는 능력에 의존합니다, 또한 바이러스 성 미터로 알려진. 처음에 1952년에 기술된, 이것은 플라크 분석의 목적이었습니다 (7). 수십 년 후 여러 기술 발전, 플라크 분석 바이러스 성 titer의 결정에 대 한 가장 신뢰할 수 있는 방법 중 하나 남아 (8).
박테리오파지(Bacteriophages)는 유전 물질을 숙주 세포에 주입하고, 새로운 파지 입자의 생산을 위해 기계를 납치하고, 결국 숙주를 세포 용해를 통해 수많은 자손 비리를 방출하도록 유도함으로써 자손을 주입합니다. 그들의 분 크기 때문에, 박테리오파지는 전적으로 가벼운 현미경 검사를 사용하여 관찰될 수 없습니다; 따라서 전자 현미경 검사가 필요합니다 (그림 1). 또한, 파지는 박테리아와 같은 영양 한천 접시에 재배 할 수 없습니다, 그들은 에 먹이 호스트 세포가 필요하기 때문에.
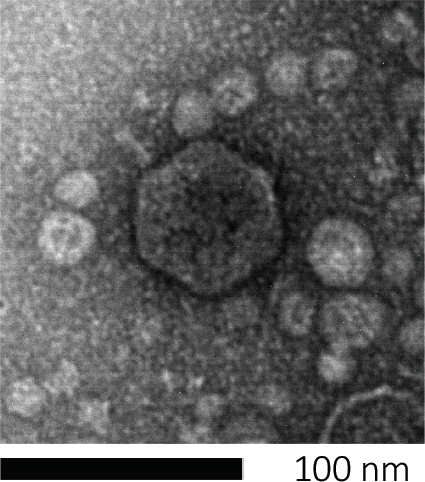
도 1: 대장균 파지에 의해 본래 예시된 박테리오파지의 형태는, 주사 전자 현미경 검사를 사용하여 연구될 수 있다. 대부분의 박테리오파지는 코도바이인(꼬리 박테리오파지)에 속한다. 이 특정 파지는 매우 짧은 꼬리 구조와 icosahedral 머리를 가지고, Podoviruses의 가족에 배치.
플라크 분석(그림 2)은 로그 상 성장에서 우선적으로 배지로 숙주 셀을 통합하는 것을 기반으로 합니다. 이것은 바이러스 성 성장을 유지할 수 있는 박테리아의 조밀 한, 탁탁 층을 만듭니다. 분리된 파지는 이후에 감염, 복제 및 한 세포를 lyse수 있습니다. 각 lysed 세포로, 다중 인접 한 것 들은 즉시 감염 되 면. 여러 사이클에서, 명확한 영역(플라크)은 그렇지 않으면 탁탁판(도 2B/도 3A)에서관찰될 수 있으며, 이는 처음에 단일 박테리오파지 입자의 존재를 나타낸다. 시료의 부피당 플라크 형성단위(즉, PFU/mL)의 개수는 생성된 플라크 수로부터 결정될 수 있다.
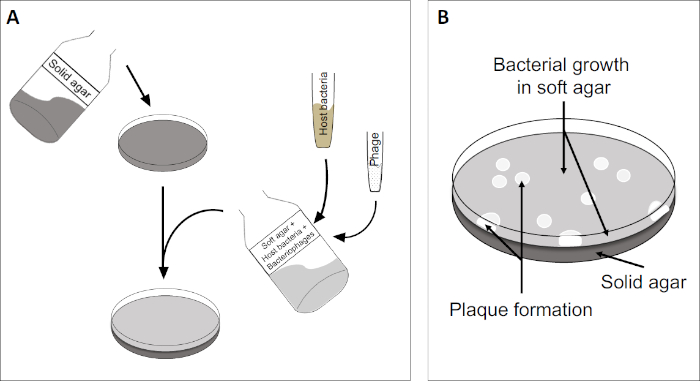
도 2: 플라크 성형 유닛(PFU)에 대한 테스트는 샘플에서 박테리오파지수를 결정하는 일반적인 방법입니다. (A) 멸균 페트리 접시의 베이스는 적절한 고체 영양소 배지로 덮여 있으며, 그 다음으로 소프트 미디어, 취약한 숙주 세포 및 원래 의 박테리오파지 샘플의 희석이 뒤섞인다. 파지 서스펜션은 경우에 따라 이미 고형화된 소프트 한천의 표면을 고르게 퍼뜨릴 수도 있습니다. (B) 숙주 박테리아의 성장은 상단 천층에서 세포의 잔디를 형성한다. 박테리오파지 복제는 숙주 세포 리시스로 인한 명확한 영역 또는 플라크를 생성합니다.
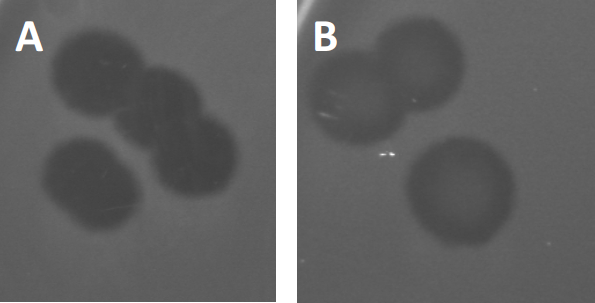
그림 3: PFU 테스트 결과 박테리오파지에서 생성된 여러 플라크가 표시됩니다. 취약한 숙주 세포의 용해로 인해 플라크는 (A) 전체 클리어런스와 함께 세균 잔디의 클리어링 영역으로 볼 수 있으며, (B) 내성 박테리아의 생성에 의한 부분적인 재성장(또는 리소겐성 사이클의 온대 파지에 의해).
특정 온대 파지는 이전에 설명된 lytic 성장 이외에 리소겐성 수명 주기라고 하는 것을 채택할 수 있습니다. 리소겐에서, 바이러스는 호스트 세포의 게놈에 그것의 유전 물질의 통합을 통해 잠복 상태를 가정합니다 (9), 수시로 추가 파지 감염에 저항을 수여합니다. 이것은 때때로 플라크의 약간의 흐린을 통해 드러난다 (그림 3B). 그러나, 그 플라크는 또한 이전 파지 감염의 독립적인 파지에 저항을 발전시킨 박테리아의 재성장 때문에 흐리게 나타날 수 있다는 것을 주목할 가치가 있습니다.
바이러스는 제한된 범위의 숙주 박테리아(10)에만 부착하거나 흡착할 수 있습니다. 호스트 범위는 CRISPR-Cas 시스템(11)과 같은 세포내 항 바이러스 전략에 의해 더욱 제한됩니다. 세균 성 하위 그룹에 의해 표시되는 특정 파지에 대한 저항 /감도는 역사적으로 다른 파지 유형으로 세균균을 분류하는 데 사용되어 왔다 (도 4). 이 방법의 효과는 이제 새로운 시퀀싱 기술에 의해 능가되었지만, 파지 타이핑은 여전히 박테리아 파지 상호 작용에 대한 귀중한 정보를 제공 할 수 있습니다, 예를 들어, 임상 사용을위한 파지 칵테일의 디자인을 촉진.
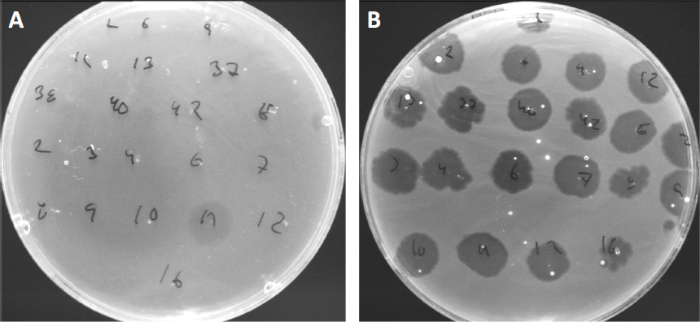
그림 4: 다른 세균균의 파지 감도. Cutibacterium 여드름 균주 (A) AD27 및 (B) AD35와 부드러운 천 접시, 21 다른 C. 여드름 박테리오파지로 발견되었다. 만 파지 11 감염 하 고 AD27을 죽일 수 있었다 동안 변형 AD35 모든 파지에 대 한 감도 를 보였다. 이 기술, 라는 파지 타이핑, 파지 감수성에 따라 다른 하위 그룹으로 세균종과 균주를 분할 하는 데 사용할 수 있습니다.
Procedure
1. 셋업
- 미생물과 관련된 작업을 시작하기 전에 작업 공간이 멸균되었는지 확인하십시오(예 : 70 %의 에탄올로 닦아). 항상 실험실 코트와 장갑을 착용하고 긴 머리를 다시 묶어 두며 상처가 특히 잘 보호되도록하십시오.
- 완료되면 모든 표면을 살균하고 손과 손목을 철저히 씻고 살균하십시오.
2. 프로토콜
- LB 미디어 준비
참고: 숙주 세균균및 박테리오파지에 따라, 상이한 액체 배지는 숙주 세균균균또는 상이한 고체 배지의 초기 배양에 더 적합할 수 있다. 리소제니 국물 (LB)는 국물 및 한천에 대한이 프로토콜에 사용됩니다.- LB 국물, 단단한 바닥 한천 및 부드러운 상단 천에 대해 200 mL 증류수에 4 g LB를 혼합합니다. 모든 솔루션은 자동화하는 동안 오버플로를 방지하기 위해 최종 볼륨의 두 배를 보유할 수 있는 컨테이너에 준비해야 합니다.
참고: 삼중에서 분석량을 수행하는 경우 LB 하단 한고의 양을 두 배로 준비하십시오. - 3가지 솔루션 모두의 pH를 NaOH 또는 HCl을 사용하여 7.4로 적절히 조정합니다.
- 하단 한천 병에 3 g의 한천 파워를 추가하여 고체 한천용 1.5% 한천 용액을 만듭니다.
- 상단 한천 병에 1.2 g의 한천 파워를 추가하여 부드러운 한천용 0.6% 한천 용액을 만듭니다.
- 반조개한 캡을 장착한 병을 121°C로 설정된 오토클레이브에 20분 간 배치하여 솔루션을 살균합니다. 오염을 방지하기 위해 실행이 완료되자마자 캡을 닫습니다.
- LB 미디어가 약 45-50°C의 온도에 도달하면 200mL LB 솔루션 중 세 가지 모두에 멸균 1 M CaCl2의 450 μL을 추가하여 최종 농도가 2.25mMM입니다.
- 고체 한천 배지의 15mL 알리쿼트를 멸균 페트리 접시에 붓고(발포를 방지하기 위해 흔들리지 않도록) 실온에서 몇 시간 또는 하룻밤 동안 고형화되도록한다(그림4A). 플레이트는 며칠 동안 4°C에서 거꾸로 보관할 수 있습니다.
- LB 국물, 단단한 바닥 한천 및 부드러운 상단 천에 대해 200 mL 증류수에 4 g LB를 혼합합니다. 모든 솔루션은 자동화하는 동안 오버플로를 방지하기 위해 최종 볼륨의 두 배를 보유할 수 있는 컨테이너에 준비해야 합니다.
- 숙주 세포의 배양
- 분석 하기 하루 전에, LB 국물의 10 mL에 대장균 배양의 10 μL을 추가합니다.
- 흔들리는 인큐베이터에서 160 rpm에서 하룻밤 사이에 37 °C에서 박테리아를 배양하십시오.
- 분석의 아침, 신선한 LB의 10 mL에 하룻밤 문화의 0.5 mL을 추가합니다.
참고: 삼중에서 분석체를 수행하는 경우 이 문화의 양을 두 배로 준비하십시오. - 세균 문화가 로그 상 성장에 될 때까지 흔들리는 인큐베이터에서 160 rpm에서 37 °C에서 배양하십시오. 이는 0.5-0.7의 OD600에 의해 분광성으로 결정될 수 있다.
- 박테리아가 최고 LB 화창에 추가 될 때까지 실온에서 문화를 유지합니다.
- 박테리오파지의 10배 직렬 희석
- LB 국물의 180μL을 7개의 우물에 넣고 96웰 플레이트에 넣습니다.
참고: 통계적 신뢰성을 높이기 위해 삼중에서 희석을 수행하는 것이 좋습니다. 이렇게하려면 플레이트의 두 번째 및 세 번째 행에서 박테리오파지의 추가 희석을 준비하십시오. - 정중 하 게 균성을 보장 하 고 첫 번째 우물에 20 μL을 전송 하는 원래 박테리오파지 샘플을 소용돌이.
- 피펫팅과 아래로 샘플을 잘 섞는다.
- 결과 서스펜션의 20 μL을 두 번째 우물로 옮킨다.
- 두 번째 우물에서 솔루션의 20 μL을 세 번째 우물로 옮기고, 여섯 째 우물까지, 일곱 번째우물까지, 7번째와 파지 서스펜션이 추가되지 않는 네거티브 컨트롤을 떠나서 직렬 희석을 계속한다. 이렇게 하면 희석 범위가 10-1 -1 -10-6입니다.
- LB 국물의 180μL을 7개의 우물에 넣고 96웰 플레이트에 넣습니다.
- 도금
- 이름, 날짜 및 짧은 샘플 설명(파지 샘플 희석 계수 포함)과 함께 페트리 접시(이전에 2.1.7단계에서 준비)의 베이스를 레이블을 지정합니다. 분석 1시간 전에 37°C 인큐베이터로 페트리 요리를 예열합니다.
- 고화된 부드러운 한천 매체(일반적으로 전자레인지를 사용하여 수행됨) 녹여고 고화된 한천이 85°C에서 녹아 약 45°C로 들어오게 합니다. 가열 된 매체는 적절한 온도에 도달하기 위해 ~ 1h에 대한 45 ° C 수조에 배치 할 수 있습니다. 그것은 액체 형태로 남아 있을 정도로 뜨거운 해야 한다, 하지만 추가 된 박테리아를 죽 이지 충분히 냉각.
- 4mL 세균 배양(2.2단계에서)과 35mL LB 소프트 한천(45°C)을 혼합합니다. 세포를 균등하게 분배하지만 거품을 방지하기 위해 흔들리지 않도록 소용돌이(그림 4A).
- 각 직렬 희석 단계에 대해 멸균 테스트 튜브 1개, 대조군 샘플에 대해 1개의 멸균 테스트 튜브에 라벨을 부착하여 총 7개의 라벨이 부착된 테스트 튜브에 라벨을 부착합니다. 세균 배양/부드러운 천 혼합물의 5mL 알리쿼트(aliquots)를 단계 2.4.3에서 7개의 튜브에 넣습니다. 이러한 소량의 한천 기반 매체가 실온에서 빠르게 고화되기 때문에 2.4.6 단계를 통해 신속하게 작업할 수 있습니다.
- 제어 샘플의 100 μL(2.3단계)을 제어 테스트 튜브에 넣고 조심스럽게 소용돌이쳐냅니다. 사용된 파이펫 팁을 버리고 각 직렬 희석 된 박테리오파지 샘플 (단계 2.3)에서 동일한 볼륨을 각각의 시험 관으로 전송하여 혼합합니다.
- 5mL 혼합물을 라벨, 예열, 고체 식천 판(도4A)에즉시 전달합니다. 접시를 부드럽게 소용돌이어 혼합물을 퍼뜨리기도 합니다.
참고: 삼중에서 분석서를 수행하는 경우 2.4.3-6 단계를 두 번 더 반복하십시오. - 실험실 필름으로 각 플레이트를 밀봉하고, 두 층이 실온(약 15분)에서 제대로 고화되도록 허용한 후 37°C 인큐베이터를 상류로 배치하고, 박테리아와 파지의 성장을 자극하며, 24시간 동안 또는 플라크가 발달할 때까지, 일반적으로 플라크가 나타나기까지 는 보통 1~5일 정도걸립니다(그림 4B),그러나 중간 정도의 경우 는 상당히 다양하지만, 중간 정도의 조건은 상당히 다양합니다.
3. 데이터 분석 및 결과
-
플라크 계수
- 바이러스 성 오염을 나타낼 수 있기 때문에 "제어"로 표시된 플레이트에 플라크가 표시되지 않도록하십시오.
- 가장 희석된 박테리오파지 샘플을 포함하는10-6이라고표시된 플레이트로 시작합니다. 뚜껑을 제거하지 않고 플라크를 계산하여 펜으로 표시하여 이미 계산된 플라크를 나타냅니다.
- 나머지 플레이트를 계산합니다. 일부 플레이트에는 너무 적거나 너무 많은 플라크가 있을 수 있습니다. 추가 분석을 위해 10-150 플라크가 있는 플레이트를 사용합니다.
-
PFU 계산
- 파지 혼합물의100 μL에서 플라크 성형 유닛(PFU)의 수를 얻기 위해 희석 계수(예: 가장 희석된 시료의 경우 10-6)로 플라크 수를 나눕니다.
참고: 삼중판에서 분석체를 수행하는 경우 세 개의 플레이트에서 평균 플라크 수를 사용하십시오. - 원래 시료의 농도(PFU/mL)를 결정하기 위해, 10의 추가 희석계수에 곱하여 100μL의 시료만 도금하였다.
 (즉)
(즉) - PFU/mL의 평균 값을 10에서 150플라크 사이에 있는 모든 희석에 대해 계산하여 보다 신뢰할 수 있는 결과를 얻습니다.
- 파지 혼합물의100 μL에서 플라크 성형 유닛(PFU)의 수를 얻기 위해 희석 계수(예: 가장 희석된 시료의 경우 10-6)로 플라크 수를 나눕니다.
파지라고도 불리는 박테리오파지(Bacteriophages)는 박테리아를 구체적으로 감염시키는 바이러스이며, 플라크 분석이라는 도구를 사용하여 박테리아의 존재를 확인하고 정량화할 수 있습니다. 박테리오파지는 먼저 세균세포벽에 부착하고 유전물질을 주입하여 그들의 취약한 호스트를 감염시다. 그런 다음 세포의 생합성 기계를 납치하여 DNA를 복제하고 수많은 자손 파지 입자를 생성하여 숙주 세포를 용인하고 죽임으로써 방출합니다.
이러한 리틱 활동은 플라크 분석또는 이중 한고층 분석으로 알려진 널리 사용되는 파지 내레이션 기술의 기초이다. 여기서, 박테리오파지 믹스는 먼저 저농도 한천을 함유한 용융 영양국으로 제조된다. 혼합에 사용되는 모든 박테리아는 살아 있고 적극적으로 그들의 성장의 로그 단계에서 분할 해야 합니다., 박테리아의 큰 비율이 실행 가능 하 고 플라크 주위에 조밀 한 잔디를 형성 할 수 있도록 합니다. 다음으로, 이 용융 세균 파지 식기 혼합물은 페트리 접시에 이미 고화된 더 단단하고 농축된 한천 영양소 매체에 퍼짐합니다. 실온에서 인큐베이션시 저농도 천파지 박테리아 국물도 고화되어 부드러운 천 오버레이를 형성합니다.
여기서, 세균 세포는 바닥 층에서 추가 양분을 파생할 수 있고 박테리아의 수렴잔디를 생성하기 위하여 급속하게 곱해야 합니다. 그러나, 파지 입자는 또한 연층에 존재하기 때문에, 이들은 박테리아 내의 그들의 유전 물질을 감염하고 복제할 것입니다, 다중 자손을 풀어 놓는 세포 lysis에서 절정에 달합니다. 박테리아 파지 층의 반 고체 상태가 더 멀리 위치한 숙주 세포로 그들의 움직임을 제한하기 때문에 이 파지 자손은 그 때 이웃 세포를 감염시다. 감염과 lysis의이 주기는 여러 라운드를 통해 계속, 지역화 된 지역에서 박테리아의 큰 숫자를 죽이고. 이웃 세포가 파괴되는 효과는, 알몸눈으로 볼 수있는 플라크라고 하는 단일 원형 클리어 존을 생성하여 파지의 박테리아 리스틱 활성을 효과적으로 증폭시키고 열거감을 가능하게하는 것입니다.
페트리 접시의 플라크 수는 플라크 성형 유닛 또는 PfUs라고 하며, 초기 박테리오파지 농도를 충분히 희석시키고, 원래 샘플의 감염파지 입자 수에 직접 대응해야 한다. 이 기술은 플라크 형태의 특성화, 파지 유형 식별 을 돕거나 파지 돌연변이를 격리하는 데 사용할 수 있습니다. 이 실험실에서는 대장균의 T7 파지를 예로 사용하여 파지를 예에 내포하기 위한 플라크 분석법을 수행하는 방법을 배웁니다.
먼저, 숙주 세균 세포 및 박테리오파지의 배양에 적합한 배지를 식별한다. 여기서 리소겐국물, 또는 LB 배지는 대장균과 T7 파지를 배양하는 데 사용되었다. 다음으로, 세 개의 깨끗한 유리 병을 가지고 미디어, 이름, 다음 LB-Broth로 그들을 레이블, 두 번째는 LB-Bottom Agar로, 그리고 세 번째는 LB-탑 Agar로. 이제 3세트에서 미리 제조된 LB 파우더 4그램을 계량한 다음 계량된 말린 미디어 1세트를 각 병에 전달합니다. 첫 번째 병에 200 밀리리터의 물을 넣습니다. 마그네틱 스터드 바를 사용하여 내용내용을 섞는다.
그런 다음, pH 미터와 일정한 교반을 사용하여, 수산화 나트륨 또는 염산의 첨가를 통해 최종 pH를 7.4로 가져옵니다. 나머지 두 병에 대한 물 첨가 및 pH 조정도 반복합니다. 이제 3 그램의 천가 를 계량하고 두 번째 병에 추가하여 1.5 % 바닥 한천을 만듭니다. 마지막으로, 무게 1. 2 그램의 천을 세 번째 병에 추가하여 .6 % LB 상단 한천을 만듭니다. 병 1의 국물 상태는 한천을 첨가할 필요가 없습니다. 병을 반으로 단단히 캡한 다음 20 분 동안 섭씨 121도에서 오토클레이브하여 미디어를 살균하십시오. 완료되면 오토클레이브에서 미디어 병을 제거하고 즉시 병 뚜껑을 비틀어 오염을 방지하기 위해 완전히 닫습니다. 나중에 사용할 수 있도록 LB-국물 및 LB-탑 한천 미디어를 벤치에 보관하십시오. LB-Bottom Agar를 미리 섭씨 약 45도로 미리 설정된 수조에서 식힙니다.
LB-Bottom 한천이 섭씨 약 45도에 도달하면 작업 용 벤치로 옮습니다. 다음으로 70% 에테놀을 사용하여 작업 공간을 살균합니다. 다음으로, 450 마이크로리터의 멸균 된 해금 칼슘 염화물을 용융 바닥 한천에 추가하여 최종 농도를 2.25 밀리머로 만듭니다. 병을 부드럽게 소용돌이어 섞습니다. 그런 다음 7 개의 깨끗한 페트리 요리를 내놓습니다. 하단에 각 접시에 미디어 이름과 준비 날짜로 레이블을 지정합니다. 그런 다음, 일곱 페트리 요리의 각각에 바닥 한고의 15 밀리리터를 부어. 플레이트를 실온에서 몇 시간 또는 하룻밤 동안 설정할 수 있습니다. 설정되면, 배양 플레이트는 응축을 최소화하기 위해 거꾸로, 필요한 경우 며칠 동안 섭씨 4도에 저장할 수 있습니다. 페트리 요리를 섭씨 4도에서 37도의 인큐베이터로 옮김한 후 1시간 전에 전달합니다.
분석 전날은 대장균을 배양해야 한다. 여기서, 대장균 배양의 10마이크로리터는 LB-Broth의 10 밀리리터로 접종되었다. 160 RPM에서 섭씨 37도로 설정된 흔들리는 인큐베이터에서 하룻밤 동안 자라도록 박테리아를 놓습니다. 그런 다음, 분석의 날에, 인큐베이터에서 세균 문화를 제거합니다. 하룻밤 문화의 0.5 밀리리터와 신선한 LB 국물의 신선한 10 밀리리터를 시드. 160 RPM에서 섭씨 37도로 설정된 흔들리는 인큐베이터로 자라도록 이 세포를 놓습니다. 다음으로, 분광계를 사용하여 이 배양이 0.5~0.7의 광학 밀도로 표시된 로그 상 성장에 도달할 때를 확인합니다. OD가 이 수준에 도달하면 세포 배양을 벤치로 이송하여 배양을 중지합니다. 그들은 이제 파지 오버레이 분석에 사용할 준비가되어 있습니다.
파지 타이터는 다른 파지 유형 및 샘플에 걸쳐 기하 급수적으로 다를 수 있습니다. 따라서 효과적으로 계산하려면 광범위한 파지 농도를 생성하기 위해 희석되어야 합니다. 분석 당일, 10배 희석 기법에 따라 10분의 1에서 100만 농도에 이르는 일련의 파지 희석제를 생성한다. 통계적으로 유의하고 정확한 데이터를 얻으려면 삼중 에서 직렬 희석을 수행합니다.
다음으로, 전자 레인지를 사용하여 고화 된 LB 상단 의 한고를 녹입니다. 그런 다음 1 시간 동안 섭씨 45도에서 미리 설정된 수조에 놓습니다. 1시간 후 인큐베이터에서 바닥 식천층이 들어 있는 페트리 요리를 수집합니다. 파지 농도 및 분석 날짜로 플레이트에 레이블을 지정합니다. 그런 다음 7 개의 깨끗한 테스트 튜브를 설정합니다. 각 테스트 튜브에 직렬 파지 희석 번호로 레이블을 지정하고 컨트롤로 지정합니다.
LB 상단 한천이 섭씨 45도에 도달하면 작업 용 벤치로 옮습니다. 이제 200 밀리리터 화루 에 1개의 어금니 칼슘 염화물 450마이크로리터를 추가하여 최종 농도2.25 밀리머를 만듭니다. 병을 부드럽게 소용돌이어 섞습니다. 다음으로, 멸균 원문 튜브에 LB 탑 한천 35밀리리터와 4밀리리터의 세균 현탁액을 첨가합니다. 부드럽게 소용돌이하여 세포를 균등하게 분배하지만 거품을 방지하기 위해 흔들리지 마십시오.
지금, 이 박테리아의 알리쿼트 5 밀리리터- 상단 한천 믹스 는 7 개의 시험 관의 각각에. 그런 다음, 연속적으로 희석된 박테리오파지 샘플 및 제어 매체의 100마이크로리터를 박테리아파지 없이 단순히 미디어로 전송하여 정중하게 표지된 시험관으로 옮겨야 합니다. 적절한 혼합을 보장하기 위해 혼합물을 부드럽게 소용돌이. 박테리아 혼합물 5밀리리터를 각각의 페트리 플레이트에 부드럽게 옮기십시오. 페트리 플레이트를 부드럽게 소용돌이치면 믹스를 표면 전체에 고르게 펴놓습니다.
모든 페트리 플레이트가 혼합으로 겹쳐지면 실온에서 15분 동안 배양하여 상단 층의 응고를 허용합니다. 이 단계를 완료한 후, 나머지 두 세트의 파지 희석제세트를 사용하여 페트리 접시의 두 번째 세트와 세 번째 세트에 대한 과정을 반복합니다. 각 접시를 파라필름으로 밀봉하고 실온에서 15분 동안 배양하세요. 배양판을 24시간 동안 또는 플라크가 발달할 때까지 적당한 온도로 거꾸로 놓습니다. 여기서 플레이트는 하루 동안 섭씨 37도 인큐베이터에 배치되었으며, 대장균과 T7 파지에 대한 자극적인 성장 상태입니다.
플라크는 세균성 종, 잠복기 조건 및 매체의 선택에 따라 1 ~ 5 일 간의 배양 후에 나타납니다. 이곳에서는 1일 37도에서 잠복한 후 플라크가 보였다. 먼저 플레이트표시 제어를 확인하고 바이러스 성 오염을 나타낼 수 있듯이 이 플레이트에 플라크가 형성되지 않았는지 확인하십시오. 원래 샘플에서 파지 티터를 확인하려면 가장 희석된 파지 샘플을 먼저 포함하는 플레이트로 시작하여 뚜껑을 제거하지 않고 플라크를 계산하여 이미 계산된 것을 표시합니다. 모든 세트의 각 플레이트에 대한 계수를 반복합니다. 일부 플레이트에는 계산할 플라크가 너무 많거나 너무 적어질 수 있습니다. 이상적인 플라크 수로 10에서 150을 고려하십시오.
다음으로 다른 희석및 복제에 대한 플라크 번호 값을 나열하는 테이블을 생성합니다. 그런 다음 이상적인 플라크 수를 포함하는 희석 판의 평균 플라크 번호 값을 계산합니다. 이 예에서, 이들은 마이너스 4 희석 플레이트에 마이너스 3 및 10에 10에서 형성된 플라크의 평균 수였다. 지금, 각 파지 희석 계수에 의해 얻어진 평균 플라크 값을 분할하여 파지 희석 계수를 조정한다. 여기서, 10~10~마이너스 3 및 10을 형성하여 4개의 희석플레이트로 형성된 플라크의 평균 수는, 파지 혼합물의 100마이크로리터에서 플라크 성형 단위, 또는 PfUs의 수를 얻기 위해 각각의 희석인자에 의해 분할되었다. 밀리리터당 PFU로 값을 변환하기 위해, 생성된 값을 10배 곱하고, 파지 희석 혼합물의 100마이크로리터만이 박테리오파지 오버레이 준비 단계에서 사용되어 10의 추가 희석계수를 생성했다. 마지막으로, 다른 희석 플레이트에서 얻은 값의 평균을 계산합니다. 이것은 밀리리터 당 PfUs의 평균 수를 줄 것이다. PfUs의 수는 원래 샘플의 감염 성 파지 입자의 수에 해당합니다.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
여러 가지 기술 발전에도 불구하고, 플라크 애스터는 바이러스 성 티터 (PFU로)의 결정에 대한 금 본위제남아 있으며 순수한 박테리오파지 집단의 격리에 필수적입니다. 취약한 숙주 세포는 2겹으로 겹쳐진 한천판의 상단 외투에서 재배되어 균일한 침대를 형성하여 바이러스 복제를 가능하게 합니다. lytic 수명 주기에 있는 고립된 박테리오파지가 세포를 감염시키고, 그 안에 복제하고, 결국 그것을 lyses하는 초기 사건은, 관찰하기에는 너무 작습니다. 그러나, 방출된 virions는 인접한 세포를 감염시켜, 그 후에 단일 PFU의 존재를 나타내는 청산 구역, 또는 패를 초래합니다.
Subscription Required. Please recommend JoVE to your librarian.
References
- Twort, F. An investigation on the nature of ultra-microscopic viruses. Lancet. 186 (4814): 1241-1243. (1915)
- d'Hérelle, F. An invisible antagonist microbe of dysentery bacillus. Comptes Rendus Hebdomadaires Des Seances De L Academie Des Sciences. 165: 373-375. (1917)
- Cisek AA, Dąbrowska I, Gregorczyk KP, Wyżewski Z. Phage Therapy in Bacterial Infections Treatment: One Hundred Years After the Discovery of Bacteriophages. Current Microbiology. 74 (2):277-283. (2017)
- Mirzaei MK, Maurice CF. Ménage à trois in the human gut: interactions between host, bacteria and phages. Nature Reviews Microbiology. 15 (7):397. (2017)
- Breitbart M, Bonnain C, Malki K, Sawaya NA. Phage puppet masters of the marine microbial realm. Nature Microbiology. 3 (7):754-766. (2018)
- Leung CY, Weitz JS. Modeling the synergistic elimination of bacteria by phage and the innate immune system. Journal of Theoretical Biology. 429:241-252. (2017)
- Dulbecco R. Production of Plaques in Monolayer Tissue Cultures by Single Particles of an Animal Virus. Proceedings of the National Academy of Sciences of the United States of America. 38 (8):747-752. (1952)
- Juarez D, Long KC, Aguilar P, Kochel TJ, Halsey ES. Assessment of plaque assay methods for alphaviruses. J Virol Methods. 187 (1):185-9. (2013)
- Clokie MRJ, Millard AD, Letarov AV, Heaphy S. 2011. Phages in nature. Bacteriophage. 1 (1):31-45. (2011)
- Moldovan R, Chapman-McQuiston E, Wu XL. On kinetics of phage adsorption. Biophys J. 93 (1):303-15. (2007)
- Garneau JE, Dupuis M-È, Villion M, Romero DA, Barrangou R, Boyaval P, Fremaux C, Horvath P, Magadán AH, Moineau S.. The CRISPR/Cas bacterial immune system cleaves bacteriophage and plasmid DNA. Nature. 468 (7320):67. (2010)





 (즉)
(즉)