Summary
Eine effizientes Screening-Protokoll wird für die Identifikation von kleinen Molekülen präsentiert, die Astroglial Differenzierung in Glioblastom Stammzellen (vorliegenden Allgemeinen Geschäftsbedingungen) zu fördern. Der Test basiert auf Stammzell-Differenzierung Reporter, wobei der Ausdruck der verbesserte GFP (eGFP) durch den menschlichen GFAP Projektträger angetrieben wird.
Abstract
Glioblastom (GBM) ist die häufigste und tödlichste primäre Gehirntumor bei Erwachsenen verursacht rund 14.000 Todesfälle pro Jahr allein in den USA. Mediane Überlebenszeit nach Diagnosestellung beträgt weniger als 15 Monate mit maximalen chirurgische Resektion, Strahlung und Temozolomid Chemotherapie. Die Herausforderungen bei der Entwicklung effektiver GBM Behandlungen immer deutlicher geworden, und gehören seine unnachgiebige Invasivität, seiner Beständigkeit gegenüber standard-Behandlungen, seine genetische Komplexität und molekulare Anpassungsfähigkeit und Subpopulationen von GBM Zellen mit phänotypischen Ähnlichkeit zu normalen Stammzellen, hierin als Glioblastom Stammzellen (vorliegenden Allgemeinen Geschäftsbedingungen) bezeichnet. Da die vorliegenden Allgemeinen Geschäftsbedingungen für Tumorwachstum und Progression erforderlich sind, stellt Therapie auf der Basis der Differenzierung eine praktikable Behandlungsmethode für diese unheilbaren Tumoren dar.
Das folgende Protokoll beschreibt eine Auflistung von Verfahren, die einen hohen Durchsatz screening-Plattform zur Benennung von kleinen Molekülen, die Förderung der GSC Astroglial Differenzierung zu schaffen. Das Herzstück des Systems ist ein glial fibrillary sauren Protein (GFAP) Differenzierung Reporter-Konstrukt. Das Protokoll enthält die folgenden allgemeinen Verfahren: (1) Festlegung GSC Differenzierung Reporter; (2) Prüfung/Validierung der Relevanz des Reporters GSC selbst-Erneuerung/klonogenen Kapazität; und (3) Hochleistungs-Durchflusszytometrie Drogen-Screening.
Die Screening-Plattform bietet einen einfache und kostengünstigen Ansatz um kleine Moleküle zu identifizieren, die vorliegenden Allgemeinen Geschäftsbedingungen Differenzierung fördern. Darüber hinaus hält Nutzung der Bibliotheken der FDA-zugelassene Medikamente das Potenzial für die Identifizierung der Agents, die schneller verwendet werden können. Außerdem sollen Therapien, die Krebs-Stammzell-Differenzierung fördern synergistisch mit aktuellen "Pflege" Standardtherapien zu arbeiten, die gezeigt worden, um gezielt zu beseitigen in erster Linie mehr differenzierte Krebszellen.
Introduction
Jüngste Studien haben gezeigt, dass Tumoren eine kleine Population enthalten von Zellen, die Krebs-Stammzellen (CSCs) oder Tumor-initiierenden Zellen bezeichnet sind verantwortlich für die Tumorprogression, Metastasierung und Resistenz gegen Chemo - und Radio-Therapien 1, 2. das Vorhandensein von Krebs-Stammzellen und ihre differenzierten Stammarten in Tumoren gilt als einen wichtigen Faktor zur Förderung intratumorale Heterogenität und stellt somit eine große Hürde bei der Behandlung von Krebserkrankungen3. Tumor Zelle Hierarchie, bereitgestellt durch die Krebs-Stammzellen-Theorie hat die Entwicklung neuer Strategien zur Behandlung von Krebserkrankungen 4inspiriert. Ein Ansatz für die Zielgruppenadressierung Krebsstammzellen ist zu identifizieren und hemmen Signalwege, die bekanntermaßen während der embryonalen Entwicklung des betroffenen Organs erforderlich sind. In der Tat haben wir und andere zuvor mehrere Papiere, beschreibt die laufende Anforderung für die neuronale Stammzellen-relevanten Signalwege Sonic Hedgehog und Kerbe in Glioblastom5,6,7veröffentlicht. Diese Arbeit hat dazu beigetragen, die Verfestigung der Grund für mehrere GBM klinische Studien. Ein zweiter Ansatz für Krebs-Stammzellen-targeting ist ihre Differenzierung zu fördern. Dieser Ansatz hat eine Menge Unterstützung aufgrund der günstigen Ergebnisse von präklinischen und klinischen Studien bei der Behandlung von akuten Promyelocytic Leukämie mit Retinsäuren (ATRA, ein Vitamin-A-Analog) erhalten. Hier fand ATRA, entfernen die Reifung Block zu Krebs Zelle Differenzierung8. Piccirillo und Kollegen haben in jüngerer Zeit, elegant gezeigt, dass BMP-4 GSC Differenzierung in Astrozyten mit bedeutenden Anti-GBM-Effekte in Vitro und in Vivo9fördert.
Die Gründe für die vorliegende Studie basiert auf einer "Reverse Engineering" Ansatz für die Ausrichtung der vorliegenden Allgemeinen Geschäftsbedingungen. Angesichts die große Heterogenität in GBM und schlechte Differenzierung als eines der Markenzeichen von Krebs, fragten wir, ob wir einen günstigeren Phänotyp - Differenzierung in eine Astrozyten-artigen Zustand fördern könnten. Hier haben wir keine Vorkenntnisse in der Signalwege, die vorliegenden Allgemeinen Geschäftsbedingungen in einem bestimmten Tumor-Exemplar zu erhalten, sondern eher einen gewünschten Phänotyp (z.B. GFAP Positivität) erreichen wollen.
Dieser Bericht beschreibt die Verfahren zum Herstellen von GSC Differenzierung Reporter-Linien von der Transduktion von GSC-angereicherten Kulturen zum GSC klonale Selektion verwendet. Die Glioblastom Neurosphäre Linien verwendet wurden im Labor von Professor Angelo Vescovi von Patienten mit der Diagnose einer primären Glioblastom am Krankenhaus San Raffaele - Mailand, Italien gegründet. Diese Zeilen wurden in mehreren Publikationen: 6,10,11,12,13,14ausgiebig untersucht. Es wird dringend empfohlen, dass Personen, die bei der Umsetzung dieser Techniken in ihrem Labor interessieren die Relevanz des Reporters zu Krebs Stammzell-Selbsterneuerung Kapazität in den Zellen bestimmen sie studieren möchten (Dies gilt für alle Reporter). Ein detailliertes Protokoll für eines der in-vitro- klonogenen-Assays im Bereich akzeptiert steht zur Verfügung, um diese15,16zu erreichen. Zu guter Letzt steht ein detailliertes Protokoll beschreibt die Nutzung der Differenzierung Reporter-Linien in einen Drogentest Durchflusszytometrie basiert am Ende zur Verfügung. Der Hinweis haben ähnlich zum Astroglial Differenzierung System hier beschrieben wird, wir erfolgreich etabliert und validiert GSC Reporter Linien einen MAP2:GFP (neuronale Differenzierung) Reporter zu integrieren. Daher beschreiben die Methoden in diesem Papier kann angewendet werden, um zellulare Unterscheidung in verschiedene Linien der Zelle zu studieren.
Einige der Zahlen in diesem Bericht finden Sie in einer kürzlich erschienenen Publikation: "Atracurium Besylate und anderen neuromuskulären Blockern Astroglial Differenzierung fördern und zum Abbau Glioblastom Stammzellen18."_FITTED
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Hinweis: Astroglial und neuronale Lentivirus Reporter Systeme wurden als abgepackte, konzentrierte Lentivirale Vorbereitungen gekauft. Grundlegende Kenntnisse der Flow Cytometry Technik ist erforderlich. Auch für eine vollständige Nutzung dieses Protokolls benötigt der Benutzer Zugang zu einem Durchflusszytometer mit hohen Durchsatzleistung (96-Well Platten als Aufnahmequelle akzeptiert).
1. Lentivirale transkriptionelle Reporter System
Hinweis: Alle Fluss durchflusszytometrischen Analyse verwenden Sie elterlichen, nicht ausgestrahlt, Zellen oder Vektor ausgestrahlt (nicht fluoreszierend) für die Festlegung der Baseline Fluoreszenz. Darüber hinaus beachten Sie, dass bei allen Schritten, wo mechanische Zerreibung gefordert ist, sanft. Rauen Verreibung kann töten eine bedeutende Anzahl von den fragilen vorliegenden Allgemeinen Geschäftsbedingungen und Flow Cytometry Ergebnisse beeinflussen.
- Platte 1 x 106 Zellen in 2 mL vollständig neuronale Stammzellen Wachstumsmedium in einer 6-Multiwell-Platte.
- Transduzieren Sie Zellen durch Zugabe von Lentivirus Reporter bei einer Vielzahl von Infektionen (Moi) gleich 5.
- Fügen Sie 2 µL des Polybrene für eine Endkonzentration von 8 µg/mL.
- Inkubieren Sie die Zellen bei 37 ° C und 5 % CO2 über Nacht.
- Ersetzen Sie am nächsten Tag Wachstumsmedium um ungebundene Virus zu entfernen. Die Platte wieder in den Inkubator bei 37 ° C und 5 % CO2 und 24 h inkubieren.
- 0,5 mL des Gesamtvolumens zu ernten; Spin-down Zellen bei 360 X g für 5 min bei Raumtemperatur in einem 15 mL konische Röhrchen und überstand durch Aspiration entfernen. Die verbleibenden Zellen 0,5 mL frische neurale Stammzellen Wachstumsmedium hinzu und die Platte in den Inkubator für eine weitere Expansion zurück.
- Fügen Sie 200 µL des Reagenz Dissoziation und 5 min bei 37 ° c inkubieren
- Sanft auf und ab pipettieren, um Zellen zu distanzieren.
Hinweis: Harte Verreibung kann erhebliche Tötung der vorliegenden Allgemeinen Geschäftsbedingungen, vollständige Dissoziation erfolgt in der Regel nach 20 - 30 Mal. - Zur Minimierung von Zellhaftung oder Aggregation fügen Sie 800 µL von Hank es ausgewogen Salz Lösung (HBSS) für ein Endvolumen von 1 mL hinzu.
- Übertragen Sie 200 µL jeder Zellsuspension auf einen Brunnen einer 96-Multiwell-Platte.
- Verwenden Sie bei diesem Vorgang ein Benchtop-Durchflusszytometer mit 96-Well-Platte-Funktion ausgestattet, mit einem blauen Laser Erregung und mit der Fähigkeit zur Erkennung von grün fluoreszierendes Protein. Führen Sie durchflusszytometrischen Analyse mit mindestens 10.000 lebensfähige Zellen für jede Akquisition.
- Bestimmen Sie den Anteil der GFP-positiven Zellen durch Durchflusszytometrie.
(2) subclone Auswahl, Expansion und Validierung
- Platte Zellen in 100 µL neurale Stammzellen Medium bei einer Dichte von 0,7 Zellen pro Bohrloch einer 96-Multiwell-Platte.
- Kultur-Klone für 11 Tage bei 37 ° C und 5 % CO2. Dieser Schritt ist sehr Zelltyp abhängig und benötigen wahrscheinlich eine Anpassung auf die Zell-Linie verwendet. Eine Kugel Durchmesser ≥ 100 µm ist in der Regel ein guter Indikator für das Vorhandensein der klonogenen vorliegenden Allgemeinen Geschäftsbedingungen in den Neurosphären.
- Markieren Sie mit einem fluoreszierenden Mikroskop mit einem FITC-Filter ausgestattet, die Brunnen, die eine einzelne Neurosphäre enthalten wo ~ 1-5 % der Zellen GFP-positiv sind.
Hinweis: Bestimmung den genauen Prozentsatz der GFP-positiven Zellen ist nicht zu kritisch zu diesem Zeitpunkt. Jeder der Subclones wird später durch Durchflusszytometrie ausgewertet werden. Dieser Schritt wird durchgeführt, um die Summe zu reduzieren Anzahl der Klone mit Schwerpunkt auf Neurosphären analysiert werden, die durch ihren Ursprung undifferenziert, GFAP-negativ, GSC. - Erweitern Sie ausgewählte Reporter Klone bis gibt es eine ausreichende Anzahl von Zellen für die Analyse von Durchflusszytometrie. Eine Sub-konfluierende gut einer 6-Multiwell-Platte mit ≤ 1.5x105 Zellen/mL sollte eine ausreichende Anzahl von Zellen.
Hinweis: Ein detailliertes Verfahren zur Isolierung und Ausbau der vorliegenden Allgemeinen Geschäftsbedingungen ist verfügbar 17.
3. Ermittlung der GFAP:GFP Ausdruck von Durchflusszytometrie
- Ernten Sie ein Aliquot der Zellen (0,5 mL) von jedem Reporter Klon und nicht ausgestrahlt Kontrollen der genaue Prozentsatz der GFP-positiven Zellen bestimmt. Wenn man bedenkt Reporter Klone, die ~ 1-5 % GFP-positiven Zellen enthalten.
- Spin-Zellen bei 360 X g für 5 min bei Raumtemperatur und überstand durch Aspiration entfernen.
- Jedes Pellet 200 µL der Zelle Dissoziation Reagenz hinzugeben und die Rohre in einem Wasserbad, eingestellt auf 37 ° c inkubieren
- Genannte Zellen vorsichtig, um eine einzelne Zelle Suspension (in der Regel zwischen 20 bis 30 Mal) zu erreichen.
- Zur Minimierung von Zellhaftung oder Aggregation fügen Sie 800 µL HBSS zu einem Endvolumen von 1 mL hinzu.
- Übertragen Sie 200 µL pro Bohrloch einer 96-Multiwell-Platte von jedem Zellsuspension.
- Verwenden Sie bei diesem Vorgang ein Benchtop-Durchflusszytometer mit 96-Well-Platte-Funktion. Führen Sie durchflusszytometrischen Analyse mit mindestens 10.000 lebensfähige Zellen für jede Akquisition.
4. ELDA Selbsterneuerung Assay klonogenen Kapazität bewerten
Hinweis: Für Steuerelemente, sowohl elterlichen, nicht ausgestrahlt, sowie mit dem Ausdruck der GFP Lentivirus ausgestrahlt Zellen, sollte verwendet werden, um festzustellen, das relative klonogenen Potenzial der GSC Differenzierung Reporter Linien auf die ursprünglichen GSC-Kulturen, aus denen sie waren abgeleitet.
- Differenzierung-Reporter Subclones in einzellige Suspensionen zu distanzieren, wie oben beschrieben.
- Platte Zellen in 96-Multiwell-Platten in 100 µL kompletten neurale Stammzellen Wachstumsmedien bei Zelldichten zwischen 5 und 500 Zellen pro Bohrloch.
- 9 bis 11 Tage bei 37 ° C und 5 % CO2inkubieren Sie Zellen.
- Ergebnis positive Vertiefungen durch direkte Visualisierung der Neurosphären unter einem Lichtmikroskop. Ein Brunnen sollte betrachtet werden, "positiv", wenn es mindestens einen einzigen großen Neurosphäre enthält.
- Stecken Sie die Daten: total Brunnen analysiert und die Anzahl der positiven Vertiefungen mit http://bioinf.wehi.edu.au/software/elda/index.html die ELDA Online-Schnittstelle zur Verfügung.
(5) Medikament Bibliothek Verdünnung Vorbereitung
- Bibliothek-Platten aus dem Speicher bei-80 ° C entfernen, mit Alufolie bedecken (Schutz der lichtempfindlichen Substanzen). Für etwa 30 min bis zu einer Stunde bei Raumtemperatur auftauen.
- Verwenden Sie ein 12-Kanal Mehrkanal-Pipette, um die Bibliothek-Verbindungen bis zu 0,2 mM komplette neurale Stammzellen Medium zu verdünnen. Verdünnte DMSO auf 10 % im Wachstumsmedium
Hinweis: Die Endkonzentration von DMSO sollte 0,1 % bei Zellen hinzugefügt werden. Eine höhere Konzentration von DMSO in der Kultur kann Toxizität führen. Aus diesem Grund empfiehlt es sich, Sensibilität für DMSO in der Zell-Linie verwendet, vor der Behandlung zu testen. - Verwenden Sie DMSO als Fahrzeugkontrolle zur Behandlung von Zellen in der linken und rechten Spalte jeder Platte (Spalten 1 und 12; Brunnen A bis H).
- Decken Sie die verdünnte Bibliothek-Platten mit Alu-Folie ab und wieder die ursprüngliche Bibliothek Platten-80 ° C Gefrierschrank für die Langzeitspeicherung.
(6) Drogentest
Hinweis: DMSO-behandelten Zellen sollte auf die Grundlinie Fluoreszenz einstellen und anpassen, gating verwendet werden.
- Platte 5 x 103 Zellen in einer 96-Multiwell-Platte in 99 µL kompletten neurale Stammzellen Wachstumsmedium.
- Mit einem 12-Kanal Mehrkanal-Pipette, behandeln Sie Zellen mit verdünnter Bibliothek Verbindungen auf eine Endkonzentration von 2 µM (1 µL 0,2 mM Droge in 99 µL Zellsuspension) oder mit DMSO (Kontrolle). Inkubieren Sie die Platten für 72 h bei 37 ° C und 5 % CO2.
- Ein 12-Kanal Mehrkanal-Pipette mit 150 µL Reagenz Zelle Dissoziation in jede Vertiefung hinzufügen und 20 min bei 37 ° c inkubieren
- Sanft mit einem 12-Kanal Mehrkanal-Pipette verreiben, bis einzelne Zellsuspension (in der Regel zwischen 20 bis 30 Mal) erreicht ist, um Zellen zu distanzieren. Die Zeitspanne, die Neurosphären vollständig distanzieren muss variiert zwischen GSC Linien. Während das empfohlene Zelle Dissoziation Reagenz (siehe Material) sicher ist und Inkubation für bis zu 45 Minuten keinen Einfluss auf die Lebensfähigkeit in GSC mehrzeilig getestet hatte, überprüfen Sie für jede Zeile der GSC in Screening verwendet werden.
Hinweis: Das Endvolumen in jedem sollte nun etwa 250 µL (100 µL Zellsuspension + 150 µL Reagenz Zelle Dissoziation). - Den Anteil der Zellen mit dem Ausdruck der GFAP:GFP Reporters von Durchflusszytometrie zu bestimmen. Verwenden Sie standard-gating-Strategie. Erstens, streut Handlung nach vorne und seitlich um ein allgemeines Gefühl der Zellengröße und Lebensfähigkeit zu erhalten. Dann legen Sie ein Tor auf die lebensfähige Population der einzelligen. Dies ist die Bevölkerung für die grünen Fluoreszenz (eGFP) bestimmt wird. Jede Verbindung, die Ergebnisse in eine Erhöhung des Anteils der GFP-positiven Zellen um mehr als drei Standardabweichungen Kontrolle (DMSO-behandelt) eine Positive "Hit." gilt als Diese Schwelle sollte je nach Anwendungsfall und die gewünschte Härte eingestellt werden.
Hinweis: Für den hohen Durchsatz ist Bildschirm mit einem einzigen GSC Reporter Subclone empfohlen. Nach erfolgreichen Identifizierung sollte jeder Treffer gegen zusätzliche Reporter Subclones aus der gleichen Linie GSC überprüft werden. Um das Vertrauen für wahre Hits zu erhöhen ist auch empfehlen Tests Verbindungen gegen Reporter Subclones isoliert aus verschiedenen GSC Neurosphären Linien.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Drei unabhängige Patienten abgeleitet Neurosphären Linien wurden mit dem Lentivirus Astroglial Reporter Codierung für eine grün-fluoreszierende Protein (GFP) verschmolzen in-Frame mit einer Zeocin Widerstand Kassette ausgestrahlt und angetrieben durch das menschliche GFAP-Promotor-Element ( Abbildung 1). Nächsten einzelnen Klone wurden durch Ausplattieren 0,7 Zellen pro Bohrloch in einer 96-well-Platte (Abbildung 2) isoliert, es folgten Fluss durchflusszytometrischen Bestimmung des Prozentsatzes der Zellen mit dem Ausdruck GFP (Abbildung 3). Neurosphäre Klone, abgeleitet von Einzelzellen, ≤5 % GFP-positiven Zellen werden bezeichnet als GL (GFAP Low) während Klone mit ≥75 % GFP-positiven Zellen als GH (GFAP hoch) bezeichnet werden und gelten im Vergleich zu den GL differenzierter Subclones (Abbildung 4).
Um Mittel und Wege, die Astroglial Differenzierung der vorliegenden Allgemeinen Geschäftsbedingungen steuern können zu identifizieren, wurde eine kleine Molekül Drogentest mit zwei NIH klinische Sammlung Bibliotheken durchgeführt. Zellen wurden behandelt, für 72 Stunden mit 727 Bibliothek-Agenten aus der NIH klinische Sammlung I und II, bei einer Konzentration von 2 µM oder ein gleiches Volumen an DMSO als Steuerelement gesetzt. Die Wirkung dieser Mittel wurde im Zellviabilität in allen unseren Patienten abgeleitet GBM Neurosphäre Linien bei Konzentrationen von 0,2 µM bis 20 µM, bevor der Wirkstoff-Screening getestet. Die Konzentration in diesem Protokoll erlaubt uns, Verbindungen zu identifizieren, die Astroglial Differenzierung veranlassen konnten und zur gleichen Zeit verwendet, minimiert es potenziell Ziel toxische Wirkungen durch höhere Konzentrationen des Medikaments.
Nach Inkubation haben wir den Anteil der Zellen mit dem Ausdruck der Astroglia-GFP-Reporters durch Durchflusszytometrie festgestellt. Baselines für Rentabilität und den Prozentsatz der GFP-positiven Zellen wurden in mindestens drei Brunnen für jede Bibliothek Platte bestimmt, und ein positiver Hit wurde als eine Erhöhung des Anteils von GFP-positiven Zellen der drei Standardabweichungen über der Grundlinie (DMSO) bestimmt und eine Mindestzahl von 25 % GFP-positiven Zellen. Wir haben 12 Medikamente, die ausreichende Zunahme der GFP-positiven Bevölkerung (Tabelle 1) induziert identifiziert.
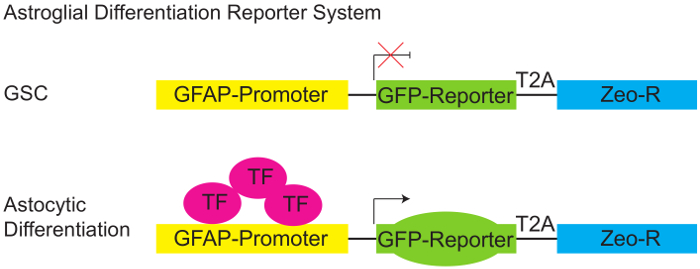
Abbildung 1: Astroglial Differenzierung Reporter System.
Schematische Darstellung der pGreenZeo GFAP:GFP Reporter. Vorliegenden Allgemeinen Geschäftsbedingungen nicht ausdrücklich die geeignete Kombination von Transkriptionsfaktoren erforderlich, den glial fibrillary sauren Protein (GFAP) Projektträger zu aktivieren und GLP (Oberseite) werden daher nicht ausdrücken. Wenn die entsprechenden Transkriptionsfaktoren sind jedoch vorhanden (z.B. wenn Zellen erwerben ein Astroglial Schicksal - differenzieren) der Astroglia Promoter aktiv wird und die Zellen werden die GFP-Reporter (Bodenplatte) zum Ausdruck bringen. (GSC - Gliom Stammzelle, T2A-Protein Linker, Zeo-R - Zeocin-Resistenz-Gen, TF - Transkriptionsfaktor). Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2: Astroglial Differenzierung - Subclone Auswahl.
Repräsentative Bilder der HSR-GBM1 GSC Subclones auszudrücken, niedrigen Niveaus (GL) oder hohen (GH) der GFAP:GFP-Reporter mit Fluoreszenz-Mikroskopie (40 X Vergrößerung wird angezeigt). Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3: Durchflusszytometrie zur Bestimmung der grün fluoreszieren.
HSR-GBM1 Patienten abgeleitet Neurosphäre Linie mit GFAP:GFP Reporter Lentivirus ausgestrahlt wurde und mehrere Subclones wurden ausgewählt, basierend auf GFP Expression in der Neurosphäre Einleitung-Zelle und Durchflusszytometrie bestätigt. Diese Klone wurden entweder GL (GFAP Low) oder GH (GFAP hoch) benannt. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 4: Funktionelle Charakterisierung der HSR-GBM1 GFAP:GFP subclones.
GL Subclones sind weitere klonogenen in Vitro wie durch GSC Frequenzen erhöht, die durch Extreme Begrenzung Verdünnung Analyse (ELDA) gemessen werden. Bitte klicken Sie hier für eine größere Version dieser Figur.
| Name | Falte Zunahme der GFP + Zellen | Beschreibung | Blut-Hirn-Schranke | Medikament Bank Wahrscheinlichkeit |
| Vinorelbin | 8.97 | Anti-mitotische Chemotherapie | - | 0,88 |
| Diphenoxylate | 13.89 | Diarrhö | + | 0,96 |
| Lomerizine | 10,89 | Calcium-Kanal-Blocker / zerebralen Vasodilatator | NA | NA |
| Phenprobamate | 10,73 | Anxiolytische / Muscle Relaxant, zentral wirkenden | NA | NA |
| 6-Azauridine | 15.07. | Antimetabolite / antivirale | NA | NA |
| Irinotecan | 14.14 | Topisomerase ich Inhibitor | + | 0,63 |
| Atracurium einer | 8.16 | Nondepolarizing Skelett Muskelrelaxans | + | 0.93 |
| Glimepirid | 8,75 | Antidiabetika | + | 0,73 |
| Hexachlorophens | 9,83 | Antiseptische | + | 0,92 |
| Digoxin | 8.23 | Kardiotonische Glykosid | - | 0,72 |
| Flecainide | 10 | Anti-Arrhythmie-agent | + | 0,86 |
| Nisoldipin | 5.05 | Calcium-Kanal-blocker | - | 0.95 |
Tabelle 1: Kleine Moleküle induzierende GFAP-GFP Reporter Ausdruck im HSR-GBM1 GL-1
Zwölf Verbindungen wurden gefunden, um den Prozentsatz der GFP exprimierenden Zellen deutlich erhöhen (fachen Anstieg wird angezeigt) und erfüllt die strengen Kriterien von ≥3 Standardabweichungen über der Grundlinie, DMSO-behandelten Zellen und mit nicht weniger als 25 % GFP-positiven Zellen. Die Fähigkeit und die Wahrscheinlichkeit, dass ein gegebenes Mittel, überqueren Sie die Blut-Hirn-Schranke (Drug Bank (−). Abkürzung: NA (Info nicht verfügbar).
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Während die meisten der bisherigen Studien der vorliegenden Allgemeinen Geschäftsbedingungen konzentriert sich hauptsächlich auf die Markierungen, die sie definieren, in dieser Studie haben wir beschlossen das umgekehrte Vorgehen. Wir konzentrieren uns in erster Linie auf die differenzierten Stammarten erzeugt durch die vorliegenden Allgemeinen Geschäftsbedingungen (z. B. Zellen, die mit dem Ausdruck Astroglial und neuronale Marker). Hier zeigen wir Ihnen die Nutzung von zellbasierten Hochdurchsatz-Drogen-screening-System, das auf menschliche GFAP Promotor-abhängige Expression von GFP beruht. Die Experimente wurden durchgeführt nutzen Patienten abgeleitet Neurosphäre Glioblastom-Zell-Linien. Ein detailliertes Protokoll beschreibt die Isolierung und den Ausbau dieser Linien wird in Galli Et Al17beschrieben.
Das System unterstützt uns nicht nur bei der Identifizierung von kleinen Molekülen, die in der Lage, induzieren zelluläre Differenzierung der vorliegenden Allgemeinen Geschäftsbedingungen, sondern half uns um eindeutig festzustellen, dass der Ausdruck des Astroglial Differenzierung Markers GFAP bestimmt auch die klonogenen Kapazität einzelner GBM-Zellen durch den Vergleich der GSC-Frequenzen. Die ELDA-Assay wurde von Yifang Hu und Gordon K. Smyth entwickelt. Die Leser werden aufgefordert, das Manuskript für ein vertieftes Verständnis der Stärken und Grenzen Assay15zu lesen. Die Kolonie Bildung scoring Schritt ist höchst Zelltyp abhängig und benötigen wahrscheinlich eine Anpassung auf die Zell-Linie verwendet. Außerdem ist, wie in der Regel verwenden wir Kugel Durchmesser ≥100 µm als ein guter Indikator, dass die Neurosphäre von einem klonogenen GSC entstanden war.
Darüber hinaus das Drogen-screening-System wir hier beschreiben ermöglicht die Identifikation der neuartige Wege (insbesondere Acetylcholin und Kalzium-Transport), die erforderlich sind, um die vorliegenden Allgemeinen Geschäftsbedingungen in der undifferenzierten Zustand zu erhalten (siehe Tabelle 1). Ab Wirkstoffkonzentration variieren basierend auf der Bibliothek und Zelle Zeile genutzt. Auch kann der Zeitaufwand für zellulare Unterscheidung Anpassung nötig. Darüber hinaus erfordert die tumorigenic Validierung der Droge Hits Tumorentstehung in Vivo assay 18.
Potenziell ist eine geringfügige Einschränkung dieser Technik, dass spontane Differenzierung unweigerlich in jeder Kultur Stammzellen angereichert erfolgt, und dieses Phänomen neigt dazu, mit der Anzahl der Passagen in der Kultur zu erhöhen und unterscheidet sich zwischen den einzelnen Subclones. In der Tat beobachteten wir spontane Differenzierung in unserer Subclones in der Regel nach Abschnitt 15. Daher haben wir unsere Differenzierung Analysen zu Kulturen auf Durchgang Zahlen nicht mehr als fünf beschränkt.
Daher vielleicht der kritischste Punkt in dieser Methodik besteht darin, in-vitro-Passagierung der vorliegenden Allgemeinen Geschäftsbedingungen auf ein Minimum und bei in-vitro-, zu arbeiten zu halten pflegen Kultur Dichte unter 1.5x105 Zellen/mL. Darüber hinaus empfiehlt es sehr, dass jedes Medikament, die "hit" gegen zusätzliche Reporter Subclones aus der gleichen Linie GSC, sowie gegen Reporter Subclones überprüft wird von anderen Patienten abgeleitet GSC Neurosphären Linien isoliert. Dies erhöht das Vertrauen, das eine echte "Hit" zur hand ist.
Die Vielseitigkeit der Methodik beschrieben in diesem robusten Protokoll stärkt den therapeutischen Wert eines Medikamenten-induzierten Krebs Stammzelldifferenzierung und soll dazu beitragen, neue Medikamente als potenzielle neue therapeutische Strategien zu identifizieren, für GBM und anderen Tumoren. Schließlich kann der Test optimiert werden, um mit nicht-neoplastischen neurale Stammzellen, andere Krebsarten, und mit verschiedenen Differenzierung Reporter verwendet werden.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Die Autoren haben nichts preisgeben.
Acknowledgments
Diese Arbeit wurde teilweise von NIH R01CA187780 unterstützt.
Materials
| Name | Company | Catalog Number | Comments |
| ESGRO Complete Accutase | EMD Millipore | SF006 | |
| Dimethyl Sulfoxide (DMSO) | Sigma Aldrich | D2650 | |
| HBSS (Hank's Balanced Salt Solution) | Sigma Aldrich | H6648 | |
| Human GFAP Differentiation Reporter (pGreenZeo, Virus) | SBI (System Biosciences) | SR10015VA-1 | |
| 50 ml sterile disposable reagent reservoirs | Corning | 4870 | |
| 6 well plate | Thermo Fisher Scientific | 130184 | |
| 96 well plate | Falcon | 353072 | |
| Biolite T25 cm² Flask Vented | Thermo Fisher Scientific | 130189 | |
| Biolite T75 cm² Flask Vented | Thermo Fisher Scientific | 130190 | |
| 15 ml Centrifuge tubes | Celltreat | 229411 | |
| 1.5ml Microcentrifuge tubes | Fisher Scientific | 05-408-129 | |
| Ovation Multi Channel Pipette, 12 Channel, 0.5 - 20uL | VistaLab Technologies | 1060-0020 | |
| Ovation Multi Channel Pipette, 12 Channel, 5-250uL | VistaLab Technologies | 1060-0250 | |
| Multi 12-channel pipette tips 25 μl | VistaLab Technologies | 4060-1002 | |
| Multi 12-channel pipette tips 250 μl | VistaLab Technologies | 4060-9025 | |
| Guava easyCyte 5HT Benchtop Flow Cytometer | EMD Millipore | 0500-4005 | |
| NIH Clinical Collections 1 and 2 small molecule libraries | Evotec | ||
| Name | Company | Catalog Number | Comments |
| For the preparation of neural stem cell media (500 mL) | Final concentration | ||
| BSA | GoldBio.com | A-421-250 | 0.20% |
| DMEM/F12 10X | Corning | 90-091-PB | 1X |
| Heparin sodium salt | Sigma Aldrich | H3149 | 0.0002% |
| HEPES 1M | Sigma Aldrich | H4036 | 5.4 mM |
| Insulin-Transferrin- Selenium (ITS -G) (100X) | Life Technologies | 41400-045 | 1X |
| NaHCO3 | Sigma Aldrich | S-5761 | 14.5 mM |
| Penicillin-Streptomycin (10,000 U/mL) 100X | Gibco | 15140-122 | 1X |
| Progesterone | Sigma Aldrich | P8783 | 16 nM |
| Putrescine | Sigma Aldrich | P5780 | 4.8 µM |
| Basic FGF (FGF2), Human | GoldBio | 1140-02-50 | 10 ng/ml |
| EGF, Human | GoldBio | 1150-04-100 | 20 ng/ml |
| Bottle-Top Filter, 150ml, 33mm, 0.22um, Pes, S, Ind | Corning | 431160 | Use to filter sterlize media |
References
- Maher, E. A., et al. Malignant glioma: genetics and biology of a grave matter. Genes Dev. 15 (11), 1311-1333 (2001).
- Bonavia, R., Inda, M. M., Cavenee, W. K., Furnari, F. B. Heterogeneity maintenance in glioblastoma: a social network. Cancer Res. 71 (12), 4055-4060 (2011).
- Bao, S., et al. Glioma stem cells promote radioresistance by preferential activation of the DNA damage response. Nature. 444 (7120), 756-760 (2006).
- Sul, J., Fine, H. A. Malignant gliomas: new translational therapies. Mt Sinai J Med. 77 (6), 655-666 (2010).
- Bar, E. E., Chaudhry, A., Farah, M. H., Eberhart, C. G. Hedgehog signaling promotes medulloblastoma survival via Bc/II. Am J Pathol. 170 (1), 347-355 (2007).
- Chu, Q., Orr, B. A., Semenkow, S., Bar, E. E., Eberhart, C. G. Prolonged inhibition of glioblastoma xenograft initiation and clonogenic growth following in vivo Notch blockade. Clin Cancer Res. 19 (12), 3224-3233 (2013).
- Schreck, K. C., et al. The Notch target Hes1 directly modulates Gli1 expression and Hedgehog signaling: a potential mechanism of therapeutic resistance. Clin Cancer Res. 16 (24), 6060-6070 (2010).
- Warrell, R. P. Jr, et al. Differentiation therapy of acute promyelocytic leukemia with tretinoin (all-trans-retinoic acid). N Engl J Med. 324 (20), 1385-1393 (1991).
- Piccirillo, S. G., et al. Bone morphogenetic proteins inhibit the tumorigenic potential of human brain tumour-initiating cells. Nature. 444 (7120), 761-765 (2006).
- Bar, E. E., et al. Cyclopamine-mediated hedgehog pathway inhibition depletes stem-like cancer cells in glioblastoma. Stem Cells. 25 (10), 2524-2533 (2007).
- Bar, E. E., Lin, A., Mahairaki, V., Matsui, W., Eberhart, C. G. Hypoxia increases the expression of stem-cell markers and promotes clonogenicity in glioblastoma neurospheres. Am J Pathol. 177 (3), 1491-1502 (2010).
- Kahlert, U. D., et al. CD133/CD15 defines distinct cell subpopulations with differential in vitro clonogenic activity and stem cell-related gene expression profile in in vitro propagated glioblastoma multiforme-derived cell line with a PNET-like component. Folia Neuropathol. 50 (4), 357-368 (2012).
- Lim, K. S., et al. Inhibition of monocarboxylate transporter-4 depletes stem-like glioblastoma cells and inhibits HIF transcriptional response in a lactate-independent manner. Oncogene. 33 (35), 4433-4441 (2014).
- Kahlert, U. D., et al. ZEB1 Promotes Invasion in Human Fetal Neural Stem Cells and Hypoxic Glioma Neurospheres. Brain Pathol. 25 (6), 724-732 (2014).
- Hu, Y., Smyth, G. K. ELDA: extreme limiting dilution analysis for comparing depleted and enriched populations in stem cell and other assays. J Immunol Methods. 347 (1-2), 70-78 (2009).
- Meyer, M., et al. Single cell-derived clonal analysis of human glioblastoma links functional and genomic heterogeneity. Proc Natl Acad Sci U S A. 112 (3), 851-856 (2015).
- Galli, R., et al. Isolation and characterization of tumorigenic, stem-like neural precursors from human glioblastoma. Cancer Res. 64 (19), 7011-7021 (2004).
- Spina, R., Voss, D. M., Asnaghi, L., Sloan, A., Bar, E. E. Atracurium Besylate and other neuromuscular blocking agents promote astroglial differentiation and deplete glioblastoma stem cells. Oncotarget. 7 (1), 459-472 (2016).



