Summary
Her presenterer vi en protokoll for å studere frekvensen av programmert celledødsinitiering ved kontinuerlig avbildning av inokulerte blader etter celledødsinduksjon.
Abstract
Oversensitiv respons (HR)-gitt resistens er en effektiv forsvarsrespons som kan bestemmes av N-resistensgenene. HR manifesteres som dannelsen av celledødssoner på inokulerte blader. Her presenteres en protokoll for å studere frekvensen av celledødsinitiering ved å avbilde inokulerte blader i tiden mellom celledødsinitiering og celledødsutseendet ved hjelp av et digitalt mikroskop. Det digitale mikroskopet muliggjør en kontinuerlig avbildningsprosess i ønskede intervaller, noe som muliggjør en nøyaktig bestemmelse av initieringshastighet for celledød opp til minutter nøyaktig, i motsetning til timer i tradisjonelle metoder. Avbildning med det digitale mikroskopet er også uavhengig av lys og kan derfor brukes dag og natt uten å forstyrre plantens døgnrytme. Ulike patosystemer som resulterer i programmert celledødsutvikling kan studeres ved hjelp av denne protokollen med mindre modifikasjoner. Samlet sett tillater protokollen dermed enkel, nøyaktig og billig identifisering av initieringsrate for celledød.
Introduction
Potet er en av verdens mest dyrkede matvekster, fjerdeplass bak ris, hvete og mais. Potetproduksjonen kan imidlertid bli sterkt påvirket av potetvirus Y (PVY), som i dag regnes som det viktigste viruspatogenet 1,2. I potetplanter cv. Rywal, flere stammer av PVY (inkludert PVY-stamme N-Wilga) utløser overfølsom respons (HR)-overdratt resistens, hvor patogenets begrensning til infeksjonsstedet manifesterer seg som nekrotiske lesjoner på inokulerte blader3. I dette patosystemet medieres HR av Ny-1-resistensgen, som er temperaturavhengig, da planter dyrket ved lavere temperaturer effektivt utvikler nekrotiske lesjoner, mens i planter dyrket konstitutivt ved forhøyet (28 °C) temperatur er abort av resistens demonstrert som mangel på lesjonsdannelse og systemisk virusspredning 3,4. Når plantene overføres til en lavere temperatur (22 °C), initieres celledød, som kan utnyttes til å følge frekvensen av celledødsinitiering ved å avbilde inokulerte blader i tiden mellom celledødsinitiering og celledød.
Denne protokollen demonstrerer en enkel metode for bestemmelse av initieringshastighet for celledød ved hjelp av et digitalt mikroskop. Ved å avbilde de inokulerte bladene etter overføring fra 28 °C til 22 °C, muliggjør et digitalt mikroskop kontinuerlig observasjon av bladet i ønskede intervaller. I motsetning til bruken av andre metoder (for eksempel konfokalmikroskopi eller observasjon av lesjonsdannelse med det blotte øye), tillater dette bestemmelse av den nøyaktige tiden for lesjonsdannelse og derfor celledødsinitieringshastigheten opp til minutter nøyaktig, i motsetning til timer i de nevnte metodene 5,6. Bruk av digitalt mikroskop er også uavhengig av lys og kan derfor brukes både dag og natt. Denne protokollen kan også brukes til å identifisere komponenter involvert i initiering av celledød eller for å bestemme effekten av forskjellige komponenter på initieringshastigheten for celledød hvis brukte planter er transgene og har endrede nivåer av komponenter av interesse.
Protocol
MERK: Avsnitt 1 og 2 beskriver en modifisert protokoll for fremstilling av plantemateriale basert på metodene skissert av Lukan et al.7. Spesielt ble det gjort noen modifikasjoner av kontrollerte miljøforhold og inokulumforberedelse.
1. Dyrking av potetplanter
- Dyrk sunn potet cv. Rywal planter i stamme node vevskultur8.
- Etter 6-8 uker, kutt ti 1 cm lange eksplanter som inneholder noder fra potetplanter på sterilt papir under sterile forhold ved hjelp av steril pinsett og en skalpellkniv.
- Overfør dem til plastkasser med Murashige og Skoog (MS30) medium (figur 1A) og dyrk dem under kontrollerte miljøforhold (22 °C i lyset og 19 °C i mørket med 250 μE eller μmol/m2/s stråling og en 16-timers fotoperiode, ved en relativ fuktighet på 55 % ± 5 %).
- Overfør dem til jorden 2 uker etter mikropropagasjon.
- Fyll pottene (r = 10 cm) med jord. Bruk en finger til å lage et 3-4 cm dypt hull i jorden midt i en gryte, fyll hullet med vann og vent til det absorberes.
- Plasser en plante per potte i hullet, og la bladene ligge over overflaten. Dekk røttene forsiktig med jord (figur 1B).
MERK: Noen planter kan ikke utvikle røtter. Ekskluder disse plantene fra analysen.
- Dyrk plantene i jord i et vekstkammer under kontrollerte miljøforhold (22 °C i lyset og 19 °C i mørket, med en relativ fuktighet på 55 % ± 5 %, med 250 μmol/m2/s stråling og en 16-timers fotoperiode).
- Etter 3-4 uker er plantene klare. Bruk disse plantene til å bli inokulert.
MERK: Planter bør ha minst 3-4 fullt utviklede blader med synlige brosjyrer (figur 1C). De skal se sunne ut, uten synlige symptomer (gule eller brune blader), som kan forveksles med lesjoner forårsaket av PVY. For å oppnå sammenlignbare resultater, bør planter inokuleres samtidig (f.eks. kl. 9) i alle eksperimenter for å unngå mulige effekter av sirkadisk rytme på planteimmunrespons og lesjonsdannelse 9,10,11.
2. Inokulumpreparasjon og potetinokulering
- Inokuler planten med PVY-stamme N-Wilga (PVYN-Wi; tiltredelse nr. EF558545) inokulum som angitt nedenfor.
MERK: Flere planter kan inokuleres parallelt hvis mer enn ett digitalt mikroskop er tilgjengelig. Planter bør ha minst tre fullt utviklede blader før inokulering (figur 1C). PVYN-Wi multipliseres og vedlikeholdes i potet cv. Pentland.- Forbered fosfatbuffer, supplert med natriumdietyldithiokarbamat (DIECA), for inokulering: Bland 1,3 ml 0,2 M NaH 2 PO 4, 8,7 ml 0,2M Na2HPO4 og 0,225 g DIECA. Gjør opp volumet til 100 ml ved hjelp av ddH20. Juster pH til 7,6 ved å legge til 1 M NaOH eller 1 M HCl-løsning.
- Høst 6-8 uker gammel PVYN-Wi infisert potet cv. Pentlandsplanter fra vevskultur i ekstraksjonsposer med filternett (0,5 g per 6 planter) og tilsett fosfatbuffer supplert med DIECA (4x masse plantemateriale, masse: volumforhold). Bruk en håndhomogenisator i 1-2 minutter for å oppnå en homogen løsning.
- Støv lett de tre første nederste fullt utviklede bladene av 3-4 uker gamle potetplanter (fra trinn 1.6) med karborundumpulver.
MERK: Juster mengden karborundumpulver. For mye kan forårsake skade, mens for lite kan føre til ineffektiv infeksjon. Optimalt brukes 0,1 mg/cm karborundumpulver, som er ca. 1,5 mg pulver per blad av gjennomsnittlig størrelse (ca. 15 cm2). - Gni forsiktig bladene med inokulumet (~ 100 μL per blad). Etter 10 min, vask bladene grundig med vann fra springen.
- Vær forsiktig så du ikke skader bladene. Ikke overskrid inkubasjonstiden. Juster mengden av inokulum i henhold til bladstørrelse - 6,5 μL / cm, som er ca. 100 μL per blad med gjennomsnittlig størrelse (ca. 15 cm2).
- Overfør plantene til et vekstkammer og dyrk dem under kontrollerte miljøforhold (28 °C i lys og 28 °C i mørket ved en relativ fuktighet på 55 % ± 5 %, med 250 μmol/m2/s stråling og en 16 timers fotoperiode) i 3 dager.
3. Planteforberedelse og bruk av det digitale mikroskopet for registrering av lesjonsutvikling
- Overfør inokulerte planter fra vekstkammeret opprettholdt ved 28 °C til et vekstkammer ved 22 °C 3 dager etter inokulering, med andre forhold som beskrevet i trinn 1.5.
- Velg en plante for observasjon. Immobiliser det andre inokulerte bladet ved hjelp av tape (figur 1D). Forsikre deg om at ønsket blad er helt immobilisert før du starter med avbildning (figur 1D).
- Installer et program for bildeopptak på den bærbare datamaskinen. Koble det digitale mikroskopet til datamaskinen. Åpne programvaren.
MERK: Forsikre deg om at anlegget, det digitale mikroskopet og den bærbare datamaskinen er plassert på hyllen i nærheten av kontakten for å koble til datamaskinen. Beslutningen om valg av blader som skal overvåkes, kan avhenge av det biologiske spørsmålet som studeres, for eksempel hvilken type prosess som fører til dannelsen av begrenset programmert celledød. - Juster mikroskopet over det immobiliserte bladet. Fokuser ved hjelp av hjulet på det digitale mikroskopet (vist i figur 1E).
- Sørg for at synslinjen er så bred som mulig for å øke sjansene for å fange dannelsen av lesjonen, men fortsatt forstørret nok til å oppdage lesjonens utseende (vanligvis brukes 25x forstørrelse).
- Still inn kamerainnstillingene. Klikk på Innstillinger-knappen øverst til høyre i bildet (figur 2A, sirklet del 1) og juster kamerainnstillingene: Lysstyrke (60-70), Kontrast (10-15), Hue (0), Hvitbalanse, Metning (45-50), Skarphet (0), Gamma (5) (figur 2B). Innstillingene som ble brukt i denne studien var som følger: Lysstyrke (64), Kontrast (14), Hue (0), Metning (47), Skarphet (0), Gamma (5).
MERK: Kamerainnstillingene bør justeres til utelys for å sikre best mulig bildekvalitet. Innstillingene kan tilpasses i henhold til brukerens forhold i vekstkammeret. - Still inn innstillingene for bildeopptak ved å klikke på ikonet for Image Capture (figur 2C, sirklet del 2). Klikk på knappen Time-Lapsed Video og still inn Image Capture hvert 15. minutt i 24 timer (figur 2C).
MERK: Intervallet mellom bildene som er tatt og bildevarigheten er fullt fleksibelt og kan tilpasses i henhold til eksperimentets behov. I tiden mellom bildeopptak slås LED-lyset av. LED-lampen slås automatisk på under bildeopptak. - Start bildeopptak ved å klikke på START-knappen (figur 2C).
MERK: Etter å ha blitt overført fra 28 ° C til 22 ° C, bør planter begynne å utvikle lesjoner innen 24 timer. Hvis ikke, kan dette være et tegn på ineffektiv inokulasjon. Juster mengden karborundumpulver, sørg for at tidspunktet for inokuluminkubasjon på bladene var riktig, og bestem virusoverflod i inokulumet ved qPCR. - Hvis du vil lagre bilder, markerer du alle bildene og klikker på Lagre-ikonet (figur 2B, sirklet rundt del 3). Angi eksportalternativer. Sett PPT til maksimum (300) (figur 2D). Etter lagring, slett alle bildene i programmet.
- For bildeanalyse er ethvert program for bildevisning / redigering tilstrekkelig. Bruken av gratis programvare for bilderedigering, ImageJ, er forklart nedenfor.
- Importer tidssekvensen for bilder fra ett enkelt synsfelt (klikk på Fil øverst til venstre, velg Importer og deretter Bildesekvens). Lim inn banen til katalogen med lagrede bilder og trykk på OK-knappen for å starte konverteringen.
- Etter konverteringen åpner programvaren automatisk en intern videospiller som viser den endelige videoen. Eksporter videofilen ved å klikke på filet > Lagre som alternativet og velge AVI-format. Et lite vindu åpnes. Sett bildefrekvensen som 0.3 bilder per sekund og trykk OK for å lagre videoen som en AVI-videofil.
MERK: Tidspunktet for lesjonsutvikling kan også bestemmes ved å manuelt sjekke alle bildene og finne et bilde der lesjonen vises.
Representative Results
Denne studien demonstrerer en trinnvis protokoll for å studere celledødsinitiering gjennom lesjonsforekomst på potet-cv. Rywal, med et digitalt mikroskop. Dette gjør det mulig å bestemme det nøyaktige tidspunktet for initiering av programmert celledød.
Planter som har utviklet røtter ble satt i jord 2 uker etter potet cv. Rywal mikropropagasjon (figur 1A,B). Etter 3-4 ukers vekst under beskrevne forhold ble planter med minst 3-4 fullt utviklede blader med synlige brosjyrer som så friske ut, uten tegn til abscission, brukt til videre analyse (figur 1C). Ved hjelp av et digitalt mikroskop som beskrevet i denne protokollen, observerte vi det samme området på det inokulerte bladet med 15 minutters mellomrom og bestemte lesjonens forekomst og ekspansjon i tid (figur 3). Lesjonen oppsto ved 15 t 30 min (figur 3).

Figur 1: Planteforberedelse for analyse med digitalt mikroskop . (A) En plastboks med MS 30 medium og potet cv. Rywal plante eksplanter som inneholder noder. (B) Potet cv. Rywal plante i jord (2 uker etter mikropropagasjon). (C) Potet cv. Rywal plante, klar for inokulering (4 uker etter å ha blitt satt i jord), har minst tre fullt utviklede blader. (D) Andre inokulerte blad (pil) av potet cv. Rywal plante plassert og immobilisert (pil) med tape. (E) Plante plassert under det digitale mikroskopet med pilen pekende på hjulet som brukes til fokusering. Klikk her for å se en større versjon av denne figuren.

Figur 2: Digital programvareinnstilling for registrering av lesjonsutvikling. (A) Programvaregrensesnitt - sirklet med rødt er alternativer for knappen for (1) kamerainnstillinger, (2) innstillinger for bildeopptak og (3) lagring av bilder. (B) Vindu med kamerainnstillinger, som åpnes med et klikk på (1) i panel A. Lysstyrke, kontrast, metning, skarphet og gamma skal justeres riktig. (C) Vindu med innstillinger for bildeopptak, som åpnes med et klikk på (2) merket i panel A. (D) Vindu med innstillinger for bildelagring, som åpnes med et klikk på (3) merket i panel A. Klikk her for å se en større versjon av denne figuren.

Figur 3: Lesjonsdannelse på det inokulerte bladet observert under det digitale mikroskopet. Bilder av den sentrale delen av PVY-inokulert potetblad ved 23,6x forstørrelse sett under det digitale mikroskopet, tatt med intervaller på 5 min. Inokulerte planter ble satt ved 28 °C i 3 dager, og på den tredje dagen startet observasjonen med et digitalt mikroskop ved 22 °C kl. 07.00. (A) Klokken 21:02 er lesjonen ennå ikke synlig, (B) 90 min senere, klokken 22:32, er lesjonen synlig. (C) Lesjonsutvidelsen ble observert kl. 01:02 og (D) 07:32 neste morgen. Forsøket ble gjentatt to ganger, og lesjonene oppsto henholdsvis 8 t 15 min og 12 timer etter oppstart av celledød. Klikk her for å se en større versjon av denne figuren.
Discussion
Den demonstrerte protokollen lar brukeren nøyaktig bestemme initieringshastigheten for celledød ved kontinuerlig å avbilde inokulerte blader i tiden mellom celledødsinitiering og celledødsutseende ved hjelp av et digitalt mikroskop. Selv om det er mange måter å overvåke lesjon og forekomst av plantesykdommerpå 12,13,14,15, presenterer denne protokollen fordelen med lysuavhengig måling uten å forstyrre plantens døgnrytme, da lyset slås av mellom målingene.
Etter inokuleringen skal plantene vokse ved 28 °C i 3 dager. Ny-1-resistensgenet , som induserer en overfølsom respons, er temperaturavhengig, og i planter dyrket ved høyere temperaturer fører det til abort av resistens, noe som manifesteres som mangel på lesjonsdannelse og systemisk virusspredning3. Etter at plantene er overført til 22 °C, startes celledød, så for nøyaktige resultater bør observasjon med et digitalt mikroskop starte så snart som mulig etter denne overføringen. Et annet viktig skritt i forberedelsen av planten for avbildning er immobiliseringen av bladet (figur 1D), da planten vil fortsette å vokse under avbildning, noe som kan flytte det observerte bladet ut av fokus, eller et slikt oppsett vil ikke gi ønskede resultater.
Hvis den beskrevne protokollen brukes på transgene planter med endrede komponenter av interesse, antatt å være involvert i initiering av celledød, gjør protokollen det mulig for brukeren å avgjøre om det reduserte nivået av en studert komponent påvirker frekvensen av celledødsinitiering. Ved det kan komponenter involvert i celledødsinitiering identifiseres i patosystemer, hvor programmert celledød oppstår, ved hjelp av denne protokollen. Andre metoder for å identifisere disse komponentene er for eksempel transkriptomisk analyse som RNA-seq eller ulike former for mikroskopi, som kan være kostbart og tidkrevende16. Metoden beskrevet i denne protokollen muliggjør enkel og billig identifisering av komponenter involvert i celledødsinitiering ved å observere forskjeller i initieringsrater for celledød mellom transgene og kontrollanlegg. Optimalt, i et slikt oppsett, må to digitale kameraer brukes, da et transgent anlegg skal analyseres parallelt med et kontrollanlegg innenfor samme eksperiment.
I denne protokollen ble PVY-stamme N-Wilga brukt; Imidlertid kan andre stammer av dette viruset, for eksempel GFP-merket PVY (PVY-N605 (123) -GFP) 7, også brukes. Videre kan andre patosystemer, som resulterer i programmert celledødsutvikling, studeres ved hjelp av denne protokollen med mindre modifikasjon.
Disclosures
Forfatterne erklærer at de ikke har noen interessekonflikter.
Acknowledgments
Vi takker Barbara Jaklič for teknisk assistanse. Denne forskningen ble støttet økonomisk av det slovenske forsknings- og innovasjonsbyrået (forskningskjernefinansiering nr. P4-0165 og prosjekt Z4-3217: Dekryptere redoksrelatert signaleringssammenkobling i potetresistens mot virus).
Materials
| Name | Company | Catalog Number | Comments |
| Alcohol burner | Mikro+Polo | SH-234002455 | For tweezers and scalpel sterilization |
| Autoclave A-21 CAV | Kambi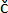 |
N/A | |
| Bacto Agar | Becton, Dickinson and Company | 214010 | |
| Carborundum powder | VWR Chemicals | 22505297 | |
| DinoCapture 2.0 | Dino-Lite | Version 2.0 | software for digital microscope |
| Dino-Lite Edge AM7915MZTL digital microscope | AnMo Electronics Corporation | AM7915MZTL | |
| Ethanol, 70% | Stella Tech | P94000 | For tweezers and scalpel sterilization |
| Extraction bags | Bioreba | 420100 | |
| Growth chamber FS-WI | Photon Systems Insturments | N/A | |
| Hand homogenizer | Bioreba | 400010 | |
| Hawita Special Substrate | HAWITA Gruppe | 2000000071701 | Ready to use substrate, made using peat (H4-H6 and H6-H8) |
| Hydrochloric acid (HCl) | Merck | 109057 | |
| Label tape | Sigma | L8144-5EA | |
| Laptop computer with installed DinoCapture 2.0 | HP | Z2V77EA#BED | Computer needs to be transferable as experiment takes part in a growth chamber |
| Murashige and Skoog medium | Duchefa Biochemie | M02220100 | |
| Na2HPO4 | Emsure | 1065860500 | |
| NaH2PO4 | Emsure | 1064700250 | |
| Pasteur pipette 0.5 mL | Brand | 21500209 | |
| pH-meter | Mettler Toledo | ML1601 | |
| Plastic boxes | Cvetlice Dornig | VCG10.5 | Radius = 10.5 cm |
| Plastic pots | Lab Associates | DIS40003 | Radius = 11.5 cm (top), Radius = 9.8 cm (bottom) |
| Saccharose | Kemika d.d. | 1800408 | |
| Sodium Diethyldithiocarbamate (DIECA) | Sigma-Aldeich | 228680 | Sodium diethyldithiocarbamate trihydrate, ACS reagent |
| Sodium hydroxide (NaOH) | Merck | 106462 | |
| Sterile surgical blades | Braun | 4511733633 | |
| Tweezers | Braun | BD033R |
References
- Karasev, A. V., Gray, S. M. Continuous and emerging challenges of potato virus y in potato. Annual Review of Phytopathology. 51, 571-586 (2013).
- Quenouille, J., Vassilakos, N., Moury, B. Potato virus Y: A major crop pathogen that has provided major insights into the evolution of viral pathogenicity. Molecular Plant Pathology. 14 (5), 439-452 (2013).
- Szajko, K., et al. The novel gene Ny-1 on potato chromosome IX confers hypersensitive resistance to Potato virus Y and is an alternative to Ry genes in potato breeding for PVY resistance. Theoretical and Applied Genetics. 116 (2), 297-303 (2008).
- Szajko, K., Strzelczyk-Żyta, D., Marczewski, W. Ny-1 and Ny-2 genes conferring hypersensitive response to potato virus Y (PVY) in cultivated potatoes: Mapping and marker-assisted selection validation for PVY resistance in potato breeding. Molecular Breeding. 34 (1), 267-271 (2014).
- Lukan, T., et al. Cell death is not sufficient for the restriction of potato virus Y spread in hypersensitive response-conferred resistance in potato. Frontiers in Plant Science. 9, 168 (2018).
- Baebler, Š, et al. Salicylic acid is an indispensable component of the Ny-1 resistance-gene-mediated response against Potato virus y infection in potato. Journal of Experimental Botany. 65 (4), 1095-1109 (2014).
- Lukan, T., Coll, A., Baebler, Š, Gruden, K. Analysis of virus spread around the cell death zone at spatiotemporal resolution using confocal microscopy. Methods in Molecular Biology. 2447, 261-270 (2022).
- Vinterhalter, D., Dragiüeviü, I., Vinterhalter, B. Potato in vitro culture techniques and biotechnology. Fruit, Vegetable and Cereal Science and Biotechnology. 2, Special Issue 16-45 (2008).
- Wang, W., et al. Timing of plant immune responses by a central circadian regulator). Nature. 470, 110-115 (2011).
- Roden, L. C., Ingle, R. A. Lights, rhythms, infection: The role of light and the circadian clock in determining the outcome of plant-pathogen interactions. Plant Cell. 21 (9), 2546-2552 (2009).
- Srivastava, D., et al. Role of circadian rhythm in plant system: An update from development to stress response. Environmental and Experimental Botany. 162, 256-271 (2019).
- Mulaosmanovic, E., et al. High-throughput method for detection and quantification of lesions on leaf scale based on trypan blue staining and digital image analysis. Plant Methods. 16, 62 (2020).
- Martinelli, F., et al. Advanced methods of plant disease detection. A review. Agronomy for Sustainable Development. 35, 1-25 (2015).
- Ali, M., Bachik, N., Muhadi, N. A., Tuan Yusof, T. N., Gomes, C. Non-destructive techniques of detecting plant diseases: A review. Physiological and Molecular Plant Pathology. 108, 101426 (2019).
- Sankaran, S., Mishra, A., Ehsani, R., Davis, C. A review of advanced techniques for detecting plant diseases. Computers and Electronics in Agriculture. 72 (1), 1-13 (2010).
- Rowarth, N. M., et al. RNA-Seq analysis reveals potential regulators of programmed cell death and leaf remodelling in lace plant (Aponogeton madagascariensis). BMC Plant Biology. 21 (1), 375 (2021).



