Overview
מקור:ג'ונתןפ. בלייז 1 , אליזבת סוטר1, וכריסטופר פ קורבו1
1 המחלקה למדעי הביולוגיה, מכללת וגנר, דרך הקמפוס 1, סטטן איילנד ניו יורק, 10301
הערכה כמותית של פרוקריוטים יכולה להיות מכבידה בהתחשב בשפע שלהם, נטייתם להתפשטות מעריכית, מגוון מינים באוכלוסייה וצרכים פיזיולוגיים ספציפיים. בנוסף לאתגר זה, הוא הטבע הארבע-פאזי שבו חיידקים משתכפלים (עיכוב, יומן, נייח ומוות). היכולת להעריך במדויק את ריכוז המיקרואורגניזם נחוצה לזיהוי מוצלח, בידוד, טיפוח ואפיון (6). ככזה, מיקרוביולוגים השתמשו בדילול סדרתי וטכניקות ציפוי שונות במשך למעלה ממאה שנה כדי לכמת באופן אמין עומס חיידקי ויראלי בסביבות מעבדה קליניות, תעשייתיות, פרמצבטיות ואקדמאיות (2,4,6). תיאורים של מתודולוגיה זו הופיעו לראשונה בשנת 1883 כאשר המדען והרופא הגרמני רוברט קוך פרסם את עבודתו על סוכנים הגורמים למחלות זיהומיות (2). הטכניקות הידועות מראש של קוך, המכונות לעתים קרובות אבי הבקטריולוגיה המודרנית, הפכו לסטנדרט הזהב לספירת מיקרואורגניזמים, הניתנים לפולחן או אחר, ברחבי העולם.
דילול סדרתי הוא הפחתה שיטתית של ישות ידועה או לא ידועה (solute, אורגניזם, וכו ') באמצעות השעיה מחדש רצופה של פתרון ראשוני (פתרון0) לתוך נפחים קבועים של דילול נוזלי (ריק). החסרים האלה מורכבים בדרך כלל 0.45% מלוחים, אם כי הרכב יכול להיות מגוון (7). בעוד שנסיין יכול לבחור כל אמצעי אחסון עבור כל דילול, זה לרוב כפולה של 10, להקל על הפחתה לוגריתמית של המדגם. לדוגמה, פתרון0 מכיל סך של 100 תאי E. coli מושעים ב 10 מ"ל של מרק מיזיני. אם 1 מ"ל של פתרון0 מוסר ומתווסף 9 מ"ל של מלוחים (דילול1),הפתרון החדש (פתרון1)יכיל 1/10th של הריכוז הראשוני של E. coli. בדוגמה זו, הפתרון החדש (פתרון1) יכיל 10 תאי E. coli. חזרה על תהליך זה על ידי הסרת 1 מ"ל של פתרון1 והוספתו עוד 9 מ"ל של מלוחים (דילול2) יניב פתרון2, המכיל רק תא E. coli יחיד. מכיוון שכל פתרון חדש (9 מ"ל של דילול + 1 מ"ל של פתרון) מכיל סך של 10 מ"ל, אנו יכולים להסיק כי גורם הדילול להפחתה זו הוא 10 או שזה היה דילול סדרתי פי 10 (איור 1). מכיוון שהתחלנו רק עם 100 תאים בדוגמה זו ואנחנו מדללים בגורם של 10, רק שני שלבים נדרשים כדי להגיע לריכוז המינימלי המוחלט של תא אחד.
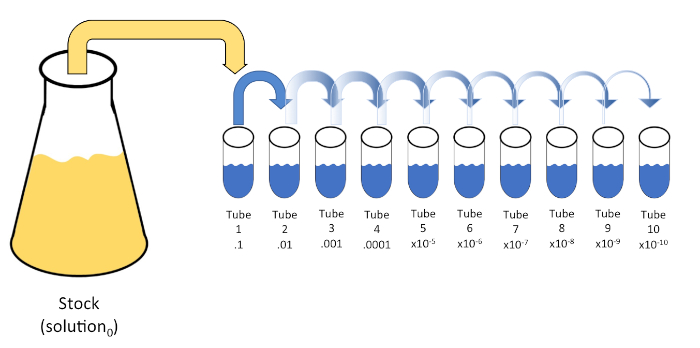
איור 1: דילול סדרתי של פתרון מניות. 1 מ"ל aliquot של פתרון המניה (פתרון0) מתווסף צינור 1 אשר מכיל 9 מ"ל של 0.45% מלוחים (dilent1); המוצר של תערובת זו הוא פתרון1. חזור על ידי aliquoting 1 מ"ל של פתרון חדש שנוצר1 והוספתו צינור 2. Aliquoting ו resuspension ממשיך בצורה זו עד הצינור הסופי הוא הגיע, דילול ריכוז המניה על ידי גורם של 10 כל אחד עם כל צעד. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
דילול סדרתי הוא הטכניקה הפשוטה ביותר להשגת ריכוזים לניהול של אורגניזם רצוי והוא משלים פסים של צלחת פטרי והתפשטות, רק שתיים מטכניקות ציפוי רבות המשמשות מיקרוביולוגים. יתרון זה של גישה זו הוא כי הנסיין יכול לקצור זנים טהורים של מין אחד או זנים נפרדים מאוכלוסייה מעורבת (7). פסים מתבצעים על ידי החדרת אורגניזם למדיום מוצק (בדרך כלל מורכב אגרוז) כי הוא יגדל על אם החומרים המזינים המתאימים זמינים. ניקוי עדין של לולאת חנק סטרילית על פני המדיום (כך שיישאר פס עדין) בתבנית סינוסואידית נוקשה, תפיץ את האורגניזם באופן פרופורציונלי לתדירות צורת הגל של הנסיין. חלוקת צלחת הפטרי לשליש או לרבעים (רצף רבעים) והפחתת התדירות של כל פס כאזור חדש של המנה נכנס בהדרגה להפחית את מספר מיקרואורגניזמים שיכולים לכבוש את האזור הזה, לייצר מושבות בודדות במקום דשא חיידקי בלתי ניתן לערעור. ציפוי ממרח אינו מדלל בנוסף דגימות; מפיץ זכוכית סטרילי משמש להפצת עליקוט של מדיית השעיה על פני צלחת פטרי שלמה(איור 2). המושבות הגדלות על צלחת ההתפשטות נובעות מתא יחיד וניתן לספור כל מושבה בצלחת כדי להעריך את מספר היחידות היוצרות מושבה למיליליטר (CFU) בהשעיה נתונה, המיוצגת כ- CFU / mL (6) (איור 3) אגר רך וציפוי משוכפל הם וריאציות של הטכניקות הנ"ל ומאפשרים בידוד של בקטריופאז 'והקרנה מוטנטית, בהתאמה (1,7).
איור 2: צלחת פסים לספירת חיידקים ובידוד מתחים. סמן את תחתית צלחת הפטרי עם פרטי זיהוי (שם חיידק, תאריך, מדיה) וחלק לשליש. לאחר בחירת דילול מתאים של מדגם המלאי, לקחת לולאת חנק סטרילית (חד פעמית או להבה) ולהטביע אותו במבחנה (כאן, T3). להעלות מעט את כיסוי צלחת פטרי בצד אחד, כך רק לולאה מכחיק יכול לגשת אגר. גלה את הלולאה המחוסנת על פני החלק העליון של התקשורת בצורה זיג-זג נזהר לא להתפשר על אגר. סובב את הלוח בערך פי1/3 (~ 118°) והפחית את תדירות תנועת זיג-זג. סובב בפעם האחרונה והפחת את תדירות הזיג-זג פעם נוספת. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
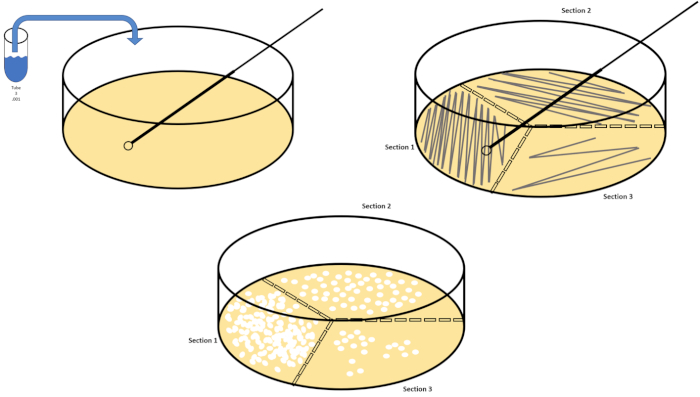
איור 3: למרוח ציפוי. גרם אחד של האזור האירובי היה תוחם מחדש ב- T1 ולאחר מכן מדולל באופן סדרתי. זכוכית סטרילית או מוט מתפשט חד פעמי פלסטיק משמש להפצת אינוקולום בכל מנה. זה חזר על עצמו עם 1 גרם של האזור אנאירובי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
כמו בדילול סדרתי, קנה מידה לוגריתמי משמש כדי לבטא ריכוז אורגניזמי. ניתן למנות ידנית את מספר המושבות הגדלות בצלחות פטרי סטנדרטיות בגודל 100 מ"מ x15 מ"מ (או אוטומטיות בעזרת עיבוד חישובי) על ידי זיהוי אשכולות מבודדים של צמיחה. ספירות הכוללות פחות מ- 30 או יותר מ- 300 צריכות להיות מוגדרות כמעטות מכדי לספור (TFTC) או רבות מכדי לספור (TNTC), בהתאמה. במקרה של האחרון, דילול סדרתי צריך להתבצע כדי להפחית את הריכוז לפני restreaking צלחת פטרי חדשה. ממוצע מספר המושבות העצמאות שזוהו משלוש מנות פטרי נפרדות והכפלת הממוצע על ידי גורם הדילול יניבו CFU / mL; התווייתיומן 10 של CFU / mL נגד הזמן תחשוף את זמן הדור הממוצע של האורגניזם (7).
Procedure
1. הגדרת
- תרשים זרימה המפרט את כל החומרים, פרוטוקול ניסיוני צעד ושיטה למחיקת חומרים מתכלים צריכים להיכתב במחברת מעבדה ושמר ליד סביבת העבודה הניסיונית.
- יש לעקר סביבות עבודה עם חומר חיטוי מתאים (70% אתנול) ועל הנסיין למתן את סכנת הזיהום על ידי לבישת בגדי מעבדה נקיים המגינים עליהם גם מפני אנומליות חשיפה. בגדים מתאימים כוללים אך אינם מוגבלים לחלוק מעבדה, כפפות לטקס או ניטריל, גוגל, מכונות הנשמה ונעליים סגורות. זה קריטי כדי לשמור על טכניקה אספטית בכל עת.
- הכן 90 מ"ל של 0.45% מלוחים. באמצעות גליל בוגר נקי, למדוד 90 מ"ל של מים סטריליים ולהעביר אותו בקבוקון Erlenmeyer נקי שכותרתו 0.45% מלוחים. שקלו 0.405 גרם נתרן כלורי (סיגמא-אולדריץ' NaCl S9888) והוסיפו אותו לבקבוקון שכותרתו 0.45% מלוחים. מערבבים שוב ושוב עד שאף מבול לא נשאר גלוי.
- עם השלמת, הנסיין צריך לעקר מחדש את כל המשטחים ולהשליך כל אורגניזמים לא רצויים, מלאי דילול, צלחות פטרי, או לולאות חנק חד פעמיות על פי הנחיות OSHA. ניתן להסיר בגדי מעבדה לפני שטיפת ידיים.
2. הכנה לתקשורת
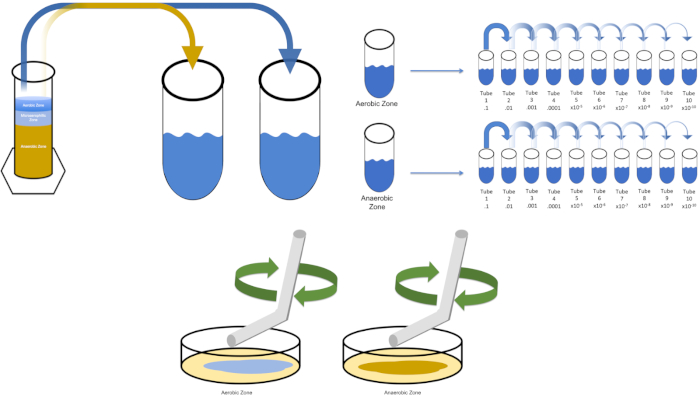
- בחר מדיה המתאימה לטיפוח אורגניזם רצוי. ברוב התרחישים, מרק יאפשר צמיחה חיידקית מספקת. מאז אורגניזמים מפרוטוקול וינוגרדסקי רצויים כאן, טור המורכב סידן פחמתי, גופרית, תאית ובוץ הורכב ונשאר ללא הפרעה במשך 7 ימים. הטור המופרד לחלקים אירוביים, מיקרואורופיליים ואנאירוביים.
- בחר מדיום המתאים ל ציפוי האורגניזם של עניין. תוספי של מדיה נוזלית עם אגר כיתה מיקרוביולוגיה מועסק בדרך כלל כסוכן מתגבש. LB בינוני / אגר מספיק בעת קצירת דגימות מאזורים אירוביים, מיקרואורופיליים ואנאירוביים של הטור forenamed. הערה: דגימות מהאזור המיקרואורופילי לא נקצרים עבור הליך זה. עם זאת, אורגניזמים אלה צריכים להיות מעובדים בצנצנות נרות. החדרת נר לתא הטיפוח הזה לפני האיטום יוצרת סביבת חמצן נמוכה המתאימה להתפשטות מיקרואורופילית.
- מאז אנחנו רוצים להכין 250 מ"ל, להשתמש 500 מ"ל (או גדול יותר) צלוחיות Erlenmeyer כדי למנוע boil-over בעת autoclaving. תייג אחד "מרק" והשני "אגר".
- קבע את כמות המדיה הדרושה ליצירת כל פתרון על-ידי ביצוע המלצות הריכוז של היצרן. LB אגר, המשמש כאן, מוכן על ידי שילוב 25 גרם / L עם מים אולטרה pure. נפח של 250 מ"ל שלנו דורש פתרון של 6.25 LB אגר / 250 מ"ל מים. באופן דומה, מרק LB מוכן על ידי שילוב אותו יחס של מרק LB ומים. מאז זה לא בתוספת עם סוכן מתגבש, זה לא להקשיח כאשר מקורר.
- שקול את המדיה ומערבב אותה עם מים בפרופורציות העולות בקנה אחד עם המלצות היצרן. הוסף 6.25 גרם של LB אגר לבקבוקון שכותרתו "אגר", ו 6.25 גרם של מרק LB לבקבוקון שכותרתו "מרק". מוסיפים 250 מ"ל מים אולטרה-תפותיים לכל בקבוקון.
- עטפו רדיד אלומיניום על כל בקבוקון והשתמשו ב-autoclave כדי לעקר את המדיה למשך 15 דקות לפחות ב-121 מעלות צלזיוס, 15 פסאיי.
- באמצעות כפפה או כרית עמידים בחום, להסיר את הבקבוקונים מן autoclave עם השלמת המחזור ומניחים אותם באמבט מים 40-50 מעלות צלזיוס.
- לאחר הטמפרטורה המתאימה כבר הגיע, לשפוך את התוכן של הבקבוקון שכותרתו "מרק" לתוך 250 מ"ל Erlenmeyer, או בקבוקון עגול התחתון. תייג את הבקבוקון 250 מ"ל "פתרון0".
- להשיג 10, 100mm x 15 מ"מ צלחות פטרי סטריליות ולתייג אותם עם התאריך, שם, סוג המדיה בשימוש ואת אזור העמודה Winogradsky כי אורגניזמים ייקצרו.
- מוציאים את הבקבוקון שכותרתו "אגר" מאמבט המים ומתחילים לשפוך לתוך כל אחת מעשר מנות הפטרי. לא יותר מ 15 מ"ל יש להוסיף לכל מנה. זה יכול להתבצע גם עם pipettor ו 25 מ"ל סרולוגי pipette כדי לשפר את הדיוק. השתמש קצה pipette סטרילי כדי להסיר את כל הבועות הקיימות, ולאחר מכן לכסות עם מכסי הצלחת ולהשאיר להתמצק לילה.
3. הכנה מדוללת
- הכן עשר מבחנה המסוגלות לאחסן 20 מ"ל או יותר בארון תקשורת ולתייג אותן T1-T10. כל מספר צינור עולה בקנה אחד עם גורם הדילול אליו הוא מתאים (כלומר, T4 = 1x10-4 או 0.0001 או 1/10,000th של ריכוז מלאי).
- צינור 9 מ"ל של 0.45% מלוחים לתוך כל אחת מ -10 המבחנות.
- כדורי סרק מלוחים מוכנים כעת לעוקר על ידי autoclave. השתמש בנייר אלומיניום כדי לכסות כל אחת מ -10 המבחנות ולאחר מכן העבר אותן למתלה מבחנה תואם אוטומטית. לחטא במשך מינימום של 15 דקות ב 121°C, 15 פסאיי.
- הסר ריק באמצעות כפפות עמידות בחום ולאפשר להתקרר. לכסות ולאחסן בטמפרטורה של 4 מעלות צלזיוס עד הצורך כאשר הצינורות הגיעו לטמפרטורת החדר, או כאשר קריר למגע.
4. טיפוח אורגניזם היעד
- לחסן " פתרון0" עם מושבה אחת מצלחת מפוספסת בעבר או 50 μL של מלאי קפוא. אפשר זמן האורגניזם היעד לשכפל על ידי הצבת " פתרון0" מחוסן לתוך אינקובטור 37 מעלות צלזיוס לילה עם רועד (במידת הצורך). (הערה: הבקבוקון צריך להיות מכוסה כדי למנוע זיהום. אם האורגניזם היעד הוא אירובי, השתמש גזה סטרילית ותקעים כותנה כדי למנוע זיהום. אם בוחנים אזורים בעמודה של וינוגרדסקי, פשוט הסירו גרם אחד מכל אזור רצוי (אירובי ואנאירובי למטרות מחקר זה) והיתכנו מחדש ב- T1 לפני שתמשיכו לשלב 5.3.
5. דילול סדרתי
- להשיג את הבקבוקון שכותרתו "מרק מיזים" מן האינקובטור ולנער במרץ.
- Pipet 1 מ"ל של " פתרון0" לתוך המבחנה שכותרתו T1. מערבולת T1. אם בוחנים את Explants ווינגרדסקי, שקול 1 גרם של האזור הרצוי ולהוסיף אותו T1 לפני מערבולת. (הערה: 1 מ"ל משמש כאן לפשטות - ניתן להשתמש גם בנפחים קטנים יותר או גדולים יותר של דילול).
- הסר 1 מ"ל מבחנה T1 ולהוסיף אותו מבחנה T2. מערבולת T2.
- הסר 1 מ"ל מבחנה T2 ולהוסיף אותו במבחנה T3. מערבולת T3.
- הסר 1 מ"ל מבחנה T3 ולהוסיף אותו במבחנה T4. מערבולת טי-4.
- הסר 1 מ"ל מבחנה T4 ולהוסיף אותו במבחנה T5. מערבולת T5.
- הסר 1 מ"ל מבחנה T5 ולהוסיף אותו מבחנה T6. מערבולת T6.
- הסר 1 מ"ל מבחנה T6 ולהוסיף אותו במבחנה T7. מערבולת T7.
- הסר 1 מ"ל מבחנה T7 ולהוסיף אותו מבחנה T8. מערבולת T8.
- הסר 1 מ"ל מבחנה T8 ולהוסיף אותו במבחנה T9. מערבולת טי-9.
- הסר 1 מ"ל מבחנה T9 ולהוסיף אותו במבחנה T10.
6. ציפוי התפשטות
- Pipet 100 μL של מדגם מדולל מ T1 ישירות על צלחת פטרי. שלב זה יכול להיות, אבל לא צריך להיות, חוזר על עצמו עבור כל צינור.
- יש להשיג מוט מתפשט סטרילי וחד פעמי או להבה לחטא מוט התפשטות זכוכית. בתנועה בכיוון השעון/נגד כיוון השעון, החלק האופקי של מוט ההתפשטות כדי לחלק את המדגם באותה מידה בתוך צלחת הפטרי.
- חזור על הפעולה עבור כל אזור בעמודה Winogradsky שיש להעריך.
- לוחות דגירה באינקובטור של 37 מעלות צלזיוס במשך 24 שעות. עבור אורגניזמים אנאירוביים, השתמש בתא אנאירובי.
7. פסים
- בחר דילול מתאים של אורגניזם היעד שלך. לדוגמה, פתרון4 יניב דילול של 1/10,000 של הריכוז הראשוני שלך. בדרך כלל, דילול של 1/1,000th (T3/Solution), 1/1,000,000th (T6/Solution6)ו-1/1,000,000,000th (T9/Solution9) מוערכים כדי למנות חיידקים.
- באמצעות לולאת חנק חד פעמית סטרילית מפלסטיק או לולאת חנק מתכת לשימוש חוזר שהייתה תחת אש במשך לא פחות מ -10 שניות, לטבול את הפתרון הרצוי מהשלב 5. לולאות חקינה מכוילות אמורות להעביר 0.01 מ"ל. (אזהרה: אין לאפשר לולאה להבה ליצור קשר עם חיידקים מיד לאחר הסרת מהחום)
- להעלות מעט את כיסוי צלחת פטרי בצד אחד, כך רק לולאה מכחיק יכול לגשת אגר. גלה את הלולאה המחוסנת על פני החלק העליון של התקשורת בצורה זיג-זג נזהר לא להתפשר על אגר. מנמיכים את מכסה צלחת הפטרי.
- השתמש בלולאת פיקוח חד פעמית חדשה או עיקור מחדש של הלולאה הניתן לשימוש חוזר.
- סובב את הלוח בערך פי1/3 (~ 118°) והפחית את תדירות תנועת זיג-זג.
- שוב, השתמש בלולאה חד פעמית חדשה או עקר מחדש לולאת מתכת לפני סיבוב בפעם האחרונה והפחית את תדר הזיג-זג פעם נוספת. מנמיכים את מכסה צלחת הפטרי.
- חזור על שלבים 7.2 - 7.6 עד שלפחות שלוש מנות פטרי פוספסו במשך שלושה דילולים שונים, באמצעות לולאה חד פעמית חדשה או על ידי הלולאה לשימוש חוזר(איור 2).
- הניחו בין לילה מנות פטרי מפוספסות באינקובטור של 37 מעלות צלזיוס. עבור אורגניזמים אנאירוביים, השתמש בתא אירובי.
8. ניתוח נתונים ותוצאות
- תרבויות נקצרו מהאזורים האוקסיים והאנוקסיים של טור וינוגרדסקי בן 7 ימים. אזורים אלה מתאימים לאנרובים הטרוטרופיים ומחמצן ברזל, בהתאמה.
- מסלקי העמודים היו מדוללים באופן סדרתי לפני פסים או התפשטות על לוחות אגר LB.
- פסים חשפו אוכלוסייה מעורבת מכל אחד מאזורי וינוגרדסקי שהוערכו. לוחות התפשטות הניבו תוצאות דומות.
- כדי לחשב CFU/mL או CFU/g, ממוצע מספר המושבות שנספרו משלוש לוחות. הכפל את המספר הממוצע של מושבות על ידי גורם הדילול ולחלק בסכום aliquoted. לדוגמה, אם נספרו בממוצע 65 מושבות על לוחות שחוסנו עם 0.1 מ"ל של פתרון6 (T6) הנוסחה שתוארה בעבר תהיה שווה ל- 650,000,000 יחידות רה-תכליתיות /mL.
- כעת ניתן לבחור מושבות מבודדות מכל צלחת לשימוש בבדיקות העשרה כדי לקבוע את זהות המינים.
לפעמים, כדי לזהות וללמוד חיידקים אנחנו צריכים קודם לבודד ולהעשיר אותם מדגם. לדוגמה, דגימות המתקבלות מטור וינוגרדסקי מעורבות, כלומר הן מכילות מינים מרובים או זנים של חיידקים, כך שלחקור חיידק בודד או למנות את הסוגים השונים הקיימים יכול להיות מאתגר. כדי לשים קץ לכך, טכניקות דילול סדרתי וזיהוי טורי משמשות בדרך כלל לכימות אמין של עומס חיידקים ולבודד מושבות בודדות.
דילול סדרתי הוא תהליך שבאמצעותו הריכוז של אורגניזם, חיידקים בדוגמה זו, מופחת באופן שיטתי באמצעות resuspension רצופה בכמויות קבועות של דילול נוזלי. בדרך כלל הנפח של דילול הוא כפולה של 10 כדי להקל על הפחתה לוגריתמית של האורגניזם המדגם. לדוגמה, גרם אחד של משקעים מוסר תחילה מאזור העניין של וינוגרדסקי ומתווסף ל -10 מיליליטר של מדיום נוזלי מתאים. לאחר מכן, מיליליטר אחד של דילול ראשון זה מתווסף צינור אחר המכיל תשעה מיליליטר של בינוני. ניתן לחזור על התהליך עד שהוכנו מספר ריכוזים שונים של חיידקים. דילול סדרתי הוא המפתח לספירת חיידקים בדוגמה זו, שכן דגימות מעורבות מעמודת וינוגרדסקי מכילות מספר לא ידוע, לעתים קרובות גדול, של חיידקים.
לאחר מכן, ציפוי פסים ופתית התפשטות מאפשרים בידוד והספירה של חיידקים בתוך מדגם, בהתאמה. פסים מתבצעים על ידי החדרת מדגם מדולל לחלק אחד של המדיום המוצק בתוספת חומרים מזינים, אשר מחולק לשליש. אינוקולום זה מתפרש על כל שליש מהצלחת בתבנית זיג-זג. כמו חלקים שונים של הצלחת הם פסים, חוצה מן המדגם הקודם רק פעם אחת, המדגם מתפשט דק יותר. משמעות הדבר היא כי ייתכן שיהיה עליך רק פס מדילול אחד כדי להשיג מושבות בודדות בחלקים המאוחרים יותר. לאחר הדגירה, הלוחות המפוספסים מאפשרים תצפיות של מורפולוגיה של המושבה, מידע שיכול לעזור להבדיל בין מינים חיידקיים שונים.
לחלופין, אם המטרה העיקרית היא הספירה של החיידקים ב ציפוי התפשטות המדגם עשוי לשמש. ב ציפוי התפשטות, aliquot של מדגם אחד מתפשט באופן שווה על פני השטח כולו של מדיום מוצק. בדרך כלל, מכיוון שאיננו יודעים את מספרי החיידקים במדגם המעורב, צלחת התפשטות נעשית עבור כל אחד מהדיקלים או מדגם מייצג שלהם. לאחר הדגירה, ניתן לבצע הספירה באמצעות לוחות פריסה אלה. כל לוחיות עם מושבה סופר פחות מ -30 יש להשליך, שכן ספירות קטנות כפופות לשגיאה גדולה יותר. באופן דומה, כל ספירה מעל 300 יש להשליך כי צפיפות המושבה וחפיפה יכול להוביל להמעיט בספירת המושבות. אם המושבה סופרת של כל אחת מהמנות הנותרות נרשמת ומוכפלת על ידי גורם הדילול, ולאחר מכן מחולקת על ידי נפח מצופה, זה מניב את המושבה להרכיב יחידות, או CFUs, לכל מיליליטר של השעיה. בסרטון זה תלמדו כיצד להעריך באופן איכותי וכמותי מדגם המכיל חיידק ידוע, ואת הקהילות המיקרוביות הכלולות באזורים שונים של טור וינוגרדסקי באמצעות דילול סדרתי, ציפוי התפשטות וציוץ פסים.
ראשית, לבשו ציוד מגן אישי מתאים הכולל חלוק מעבדה, כפפות ומשקפי מגן. לאחר מכן, לעקר את סביבת העבודה עם 70% אתנול ולנגב את פני השטח. לאחר מכן, לאסוף שני בקבוקונים 500 מיליליטר ארלנמאייר ולתייג מרק אחד ואת אגר השני. כדי להכין פתרון אגר LB, לערבב כ 6.25 גרם של אגר LB, שלושה גרם של אגר טכני, ו 250 מיליליטר של מים מזוקקים בבקבוקון שכותרתו אגר.
לאחר מכן, להכין מרק LB על ידי שילוב 2. 5 גרם של מדיה LB ו 100 מיליליטר של מים מזוקקים בבקבוקון שכותרתו מרק. לאחר autoclaving הבקבוקונים, להשתמש בכפפה עמידה בחום כדי להסיר את הבקבוקונים מן autoclave ומניחים אותם באמבט מים 40 עד 50 מעלות צלזיוס. לאחר הבקבוקונים הם 50 מעלות צלזיוס, בזהירות להכין שלושה aliquots 100 מיליליטר של פתרון המרק ולתייג כל פתרון aliquot אפס. לאחר מכן, לאסוף 10 צלחות פטרי סטריליות ולתייג אותם עם התאריך, שם, סוג של מדיה בשימוש, ואת אזור טור Winogradsky כי האורגניזמים ייקצרו. פיפטה 15 מיליליטר של אגר מבקבוק אגר לכל צלחת פטרי. לאחר מכן, השתמש בקצה pipette כדי להסיר את כל הבועות, להחליף את מכסי הצלחת, ולאפשר להם להתמצק על הספסל העליון לילה.
למחרת, לנגב את הספסל העליון עם 70% אתנול. לאחר מכן, תווית 10 20 מ"ל מבחנה T1 עד T10 ומניחים אותם בארון תקשורת. פיפטה 9 מיליליטר של 0.45% תמיסת מלח לכל צינור. עכשיו, לכסות כל אחד מ -10 מבחנה באופן רופף עם הכובעים שלהם ולהעביר אותם למתלה מבחנות תואם autoclave. לאחר השלמת המחזור, להסיר את החסר מלוחים באמצעות כפפות עמידות בחום ולאפשר להם להתקרר. לאחסן את הצינורות בטמפרטורת החדר עד שהם הגיעו כ 22 מעלות צלזיוס.
כדי לטפח אורגניזם יעד ידוע, E. coli בדוגמה זו, לחסן 100 מיליליטר של פתרון אפס עם מושבה אחת מצלחת פסים בעבר. לאחר מכן, לכסות את הצינור ולדגירה אותו במשך הלילה ב 37 מעלות צלזיוס. כדי להעריך את האזורים של טור Winogradsky, להוסיף כ גרם אחד של חומר מהאזור האירובי ל- T1 ו resuspend על ידי מערבולת. לאחר מכן, חזור על תהליך זה עם גרם אחד של חומר מהאזור ה אנאירובי.
הסר את הצינור המכיל פתרון אפס מחוסן עם E. coli מן האינקובטור ולנער אותו. לאחר מכן, pipette אחד מיליליטר של הפתרון לתוך מבחנה T1 מערבולת לערבב. הסר מיליליטר אחד של פתרון מ T1 ולהעביר אותו T2, מערבולת לערבב. חזור על תהליך זה באמצעות צינור T10. כדי להעריך את האזורים האירוביים והאנאירוביים של עמודת וינוגרדסקי, הסר מיליליטר אחד של פתרון מכל אחד מצינורות T1 שהוכנו בעבר והעביר אותו לצינורות T2 המתאימים. לאחר מכן, המשך את הדילול הסדרתי דרך צינורות T10 כפי שהוכח בעבר.
כדי להפיץ צלחת, pipette 100 microliters של מדגם מדולל מכל צינור T3 על צלחת פטרי המקבילה. לאחר מכן, השתמש מוט מתפשט סטרילי כדי להפיץ בעדינות את המדגם על צלחת פטרי ולהחליף את מכסה הצלחת. חזור על תהליך זה עבור דילול T6 ו- T9, כפי שהודגם בעבר. לדגור על הלוחות המכילים אורגניזמים אירוביים באינקובטור 37 מעלות צלזיוס במשך 24 שעות. לדגור על הלוחות המכילים אורגניזמים אנאירוביים בתא אנאירובי להגדיר 37 מעלות צלזיוס במשך 24 שעות. למחרת להסיר את לוחות דילול T3, T6, ו- T9 מן האינקובטור ואת החדר אנאירובי ולהעביר אותם לספסל העליון. עבודה עם צלחת אחת בכל פעם, להחליק לולאת חנק סטרילי על פני החלק העליון של התקשורת בתבנית זיג-זג. לאחר מכן, להחליף את מכסה צלחת פטרי. לאחר מכן, לסובב את הלוח על ידי 1/3 ולחטא את הלולאה כדי להפחית את התדירות של דפוס זיג-זג שנעשו בעבר. שוב, לאחר עיקור הלולאה, לסובב את הלוח על ידי 1/3, להפחית את התדירות של דפוס זיג-זג בפעם האחרונה, ולהחליף את המכסה. חזור על שיטת פסים זו עבור הלוחות הנותרים, כפי שהוצג בעבר. לאחר מכן, מניחים את הלוחות המפוספסים המכילים אורגניזמים אירוביים באינקובטור של 37 מעלות צלזיוס בן לילה ואת הלוחות המפוספסים המכילים אורגניזמים אנאירוביים בתא אנאירובי שנקבע ל -37 מעלות צלזיוס בן לילה.
תרבויות נקצרו מהאזורים האירוביים והאנאירוביים של טור וינוגרדסקי בן שבעה ימים. לאחר מכן, התרבויות היו מדוללות באופן סדרתי לפני פסים והתפשטות על לוחות אגר LB. פסים חשפו אוכלוסייה מעורבת מכל אחד מאזורי וינוגרדסקי המוערכים, ולוחות ההתפשטות הניבו תוצאות דומות. צלחת מפוספסת מאוכלוסייה מעורבת תגרום למושבות חיידקים בצורות, גדלים, מרקמים וצבעים שונים. לעומת זאת, הלוחות המפוספסים והפזרים המכילים את האורגניזם הידוע, אי קולי, הדגימו אוכלוסייה הומולוגית. בדרך כלל, עדיף לחשב CFUs למיליליטר באמצעות ספירת המושבה הממוצעת של שלוש לוחות להתפשט עם אותו מדגם גורם דילול. הכפל את המספר הממוצע של מושבות על ידי גורם הדילול ולחלק בסכום aliquoted. לבסוף, מושבות מבודדות שנבחרו מכל צלחת יכולות לשמש מבוחות העשרה נוספות כדי לקבוע את זהות המינים.
Applications and Summary
הספירה החיידקית ובידוד המתח על ידי ציפוי דורש ריכוזים לניהול של אורגניזמים היעד. ציפוי מוצלח מותנה אפוא בדילול סדרתי. ככזה, הטכניקות הנ"ל נשארות אבן הפינה של בדיקה מיקרוביולוגית וניסויים. למרות פשוט על ידי עיצוב, גורמי דילול וטכניקת ציפוי ניתן לשנות על ידי הנסיין כדי לחזק את התוצאות מבלי להתפשר על השלמות של כל שיטה. התוויית ארבעת השלבים של צמיחת חיידקים יכולה להיות מועילה בעת אפיון החיידקים הרצויים. שלבים אלה, עיכוב, יומן, נייח ומוות, מסומנים על ידי שינויים בשכפול חיידקים. שלב ההשהיה כולל צמיחה איטית עקב הסתגלות פיזיולוגית, שלב היומן הוא התקופה של התפשטות מקסימלית הכוללת עלייה מעריכית בתאים בני קיימא, שלב נייח מגיע לאחר מכן בשל מגבלות סביבתיות והצטברויות של רעלים, לפני שלב המוות שבו ספירת התאים מתחילה ליפול. זה יכול להתבצע על ידי דילול סדרתי (או דילול שלב אחד כדי למנוע בלבול) פתרון0 כל שעה במשך סך של 8 שעות, החל בזמן0 (פתרון0 צריך להיות מוחזר אינקובטור רועד לאחר כל דילול). חשב את יומן הרישום10 של CFU/ml עבור דילול יחיד של זמן0 והתוויה בציר ה- Y. חזור על חישוב זה עבור זמןהדגימה 1 (הקפד לחשב CFU / mL באמצעות אותו גורם דילול כמו זמן0). חזור על הפעולה עד בכל פעם (זמן1-Time8) יתווו על ציר ה- X.
References
- Allen, M.E., Gyure, R.A. (2013) An Undergraduate Laboratory Activity Demonstrating Bacteriophage Specificity. Journal of Microbial Biological Education 14: 84-92.
- Ben-David, A., Davidson, C.E. (2014) Estimation Method for Serial Dilution Experiments. Journal of Microbiological Methods 107:214-221.
- Goldman, E., Green, L.H. (2008) Practical Handbook of Microbiology.
- Koch, R. (1883) New Research Methods for Detection of Microcosms in Soil, Air and Water.
- Lederberg, J., Lederberg, E.M. (1952) Replica Plating and Indirect Selection of Bacterial Mutants. Journal of Bacteriology 63:399-406
- Pepper, I., Gerba, C., Ikner, L. (2019) Bacterial Growth Curve Analysis and its Environmental Changes. JoVE Science Education Database. Environmental Microbiology.
- Sanders., E.R. (2012) Aseptic Laboratory Technique: Plating Methods. JoVE 63:e3063.




