FIM التصوير وFIMtrack: اثنان أدوات جديدة تسمح عالية الإنتاجية والتكلفة تحليل تحرك الفعال
Summary
FIM هو نظام الرواية، تكلفة التصوير فعالة مصممة لتتبع الأجسام المتحركة الصغيرة مثل C. ايليجانس، المستورقات أو يرقات ذبابة الفاكهة. تم تصميم هذا البرنامج FIMTrack المصاحب لتقديم تحليل البيانات بسرعة وكفاءة. معا، وهذه الأدوات تتيح تحليل الإنتاجية العالية من الصفات السلوكية.
Abstract
تحليل أداء الشبكة العصبية يتطلب قياس موثوق من الصفات السلوكية. منذ سلوك الحيوانات تتحرك بحرية هو متغير إلى درجة معينة، وكثير من الحيوانات لديها ليتم تحليلها، للحصول على بيانات ذات دلالة إحصائية. وهذا بدوره يتطلب بمساعدة الحاسوب الكمي الآلي من أنماط تنقل. للحصول على صور عالية التباين للكائنات شفافة تقريبا وصغيرة تتحرك، وقد تم تطوير تقنية تصوير جديدة على أساس بالاحباط الانعكاس الكلي الداخلي دعا FIM. في هذا الإعداد، هي مضيئة الحيوانات فقط مع ضوء الأشعة تحت الحمراء في موقف محدد جدا من ملامسة سطح الزحف الأساسي. نتائج هذه المنهجية في النقيض من الصور عالية جدا. بعد ذلك، تتم معالجة هذه الصور عالية التباين باستخدام أنشئت كفاف خوارزميات تتبع. وبناء على هذا، قمنا بتطوير البرمجيات FIMTrack، والذي يعمل على استخراج عدد من الميزات المطلوبة لوصف كميا مجموعة كبيرة ومتنوعة للتنقلالخصائص. خلال تطوير مجموعة من البرامج هذه، ركزنا جهودنا على بنية مفتوحة المصدر مما يتيح إضافة سهلة للمزيد من الوحدات. ويعمل البرنامج منصة مستقلة ويترافق مع واجهة المستخدم الرسومية بديهية توجيه المستخدم من خلال تحليل البيانات. يتم إعطاء كل القيم المعلمة تنقل في شكل ملفات CSV السماح يحلل المزيد من البيانات. وبالإضافة إلى ذلك، عارض نتائج دمجها في تتبع البرنامج يوفر الفرصة لاستعراض تفاعلي وضبط الإخراج، كما قد تكون هناك حاجة خلال التكامل التحفيز. ويتجلى قوة FIM وFIMTrack من خلال دراسة تحرك من يرقات ذبابة الفاكهة.
Introduction
معظم الحيوانات لديها القدرة على التحرك بطريقة متطورة للغاية والسيطرة عليها. فك أساس الوراثية السيطرة تنقل الأساسية وهي ملزمة لتقييم كمي لأنماط سلوكية مختلفة. وفي هذا الصدد، يمكن أن ذبابة الفاكهة بمثابة نموذج مثالي. تتبع من الطيران بحرية ذبابة الفاكهة ومحيرة 1-4 ولكن الزحف من يرقات ذبابة الفاكهة يحدث في بعدين على سرعة منخفضة نسبيا وبالتالي يمكن رصدها بسهولة. وتستخدم الاجهزة القائمة على الكاميرا جنبا إلى جنب مع الإضاءة المناسبة للحصول على الصور 5. ويعمل كل من الحادث أو الضوء المرسل في التجارب السلوكية 6،7. ولكن نظرا للجسم شبه شفافة من اليرقات وانعكاسات الضوء ممكنة من الزحف سطح التسجيل المؤمنين من الحركات اليرقات يمكن أن يكون تحديا. للتغلب على هذه المشاكل، وقد وضعت بعض الأساليب المعقدة. مؤخرا، تم إدخال الإضاءة الحقل المظلمة لتعزيز الصدارة / تابع الخلفيةراست 8. كبديل للتسجيل القائم على الكاميرا والتصوير الضوئي عدسة أقل وصورة استشعار أقل أدخلت على رقاقة تقنيات اكتساب 9-11.
وقد تم إدخال العديد من البرامج تتبع مؤخرا، بما في ذلك البرمجيات المتاحة تجاريا 12 والعرف الحلول. أمثلة لبرامج تتبع الإنتاجية العالية هي دودة متعدد المقتفي (MWT) 13 و Multianimal المشي والمسار (MAGAT) 8. وقد مشتركة، يمكن تتبع كل من أن الحيوانات متعددة في الساحة الحقل المفتوح واحدة بحيث الحيوانات الاصطدام تؤدي إلى هويات متعددة حيوان جديدة. للتغلب على هذا القيد، تم إدخال الإعداد متعددة جيدا فصل 12 الحيوانات في الآبار الفردية 14. لا يمكن أن يتحقق الكمي الدقيق للتنقل الأفراد واحد باستخدام مرحلة تتبع المنقولة في تركيبة مع المجهر 15. ومع ذلك، كل هذه الأساليب هي إما غير فعالة التكلفة، وعدم إعادة كافيةحل أو قتا أطول من اللازم لارتفاع الإنتاجية phenotyping.
FIM للتغلب على القيود المذكورة أعلاه، قمنا بتطوير (الطريقة التصوير مقرها FTIR) على أساس بالاحباط انعكاس إجمالي الداخلية (FTIR) 16 (الشكل 1). ويوفر هذا النهج التصوير الجديد على النقيض من ارتفاع غير مسبوق، وحتى يسمح تسجيل متعددة الألوان من الزحف الحيوانات (16). مبدأ الكامنة وراء هذا الأسلوب مفيد وفعال أمرا سهلا. وأغرقت لوحة زجاج الاكريليك مع الضوء (على سبيل المثال، 875 نانومتر الأشعة تحت الحمراء). بسبب مؤشرات الانكسار مختلفة من الزجاج الاكريليك والهواء، وينعكس الضوء تماما على الحدود الزجاج / الهواء. يلاحظ أي تسخين الزجاج الاكريليك 16. إلا إذا الكائنات مع معامل الانكسار أعلى تلمس الجدول غمرت الخفيف، يمكن أن تضيء إدخال هذه الكائنات. إذا كانت الحيوانات تلمس السطح، وينعكس الضوء ويمكن الاستيلاء عليها من أدناه (الشكل 1). ونتيجة لذلك، فقط الاتصاليبدو مجال الحيوانات باعتبارها نقطة مضيئة، والذي يسمح التصوير مفصل مع خلفية سوداء الشاملة. وهكذا، FIM التصوير يسمح لتسجيل الأفلام مثالية لخوارزميات رؤية الكمبيوتر. استخدام بسيط وقوي من FIM يجلب الآن مفصل تحليل إنتاجية عالية من السلوك الحيواني معقدة في متناول اليد ويمكن استخدامها لدراسة معالجة المعلومات: على سبيل المثال، الشم 8، 16؛ رؤية 17 أو 18 thermosensation.
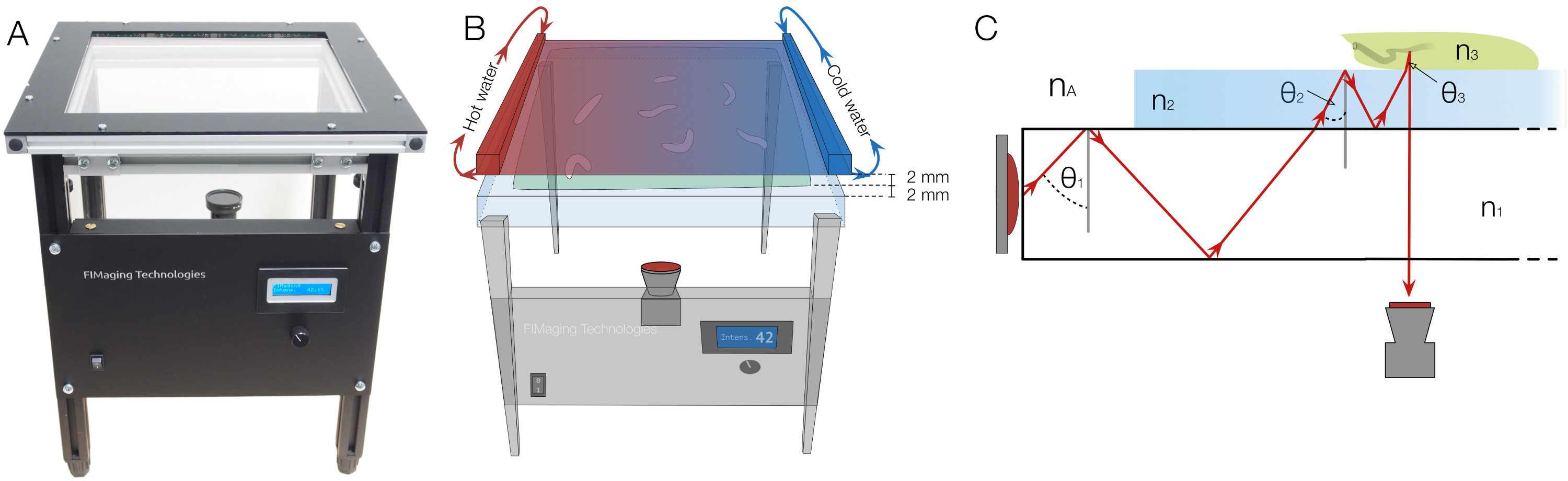
الشكل 1. الإعداد FIM مع التكامل الحرارة التحفيز والمبادئ الفيزيائية الأساسية. (A) الإعداد FIM. يمكن أن ينظم شدة الإضاءة في اللوحة الأمامية. (B) لتقديم التحفيز الحرارة، ورسمت لوحة الألومنيوم الأسود، مع perfused المياه الباردة والساخنة في كلا الجانبين، يتم وضع 2 مم فوق سطح أجار التينفسه هو 2 مم. يتم تأسيس التدرج على لوحة المبرد الحرارة وآغار من الاختلافات في درجة الحرارة (C) والمبدأ المادي للبالإحباط الانعكاس الكلي الداخلي: مضاءة لوحة زجاج الاكريليك بواسطة الأشعة تحت الحمراء. θ 1، 2 θ، وθ 3 تشير إلى زوايا انعكاس الضوء. ن A، ن 1، ن 2 و 3 ن دلالة على مؤشرات الانكسار من الهواء، زجاج الاكريليك، وأجار واليرقة على التوالي وتحقيق المساواة ن A <ن 1 <ن 2 <ن 3. بسبب الانكسار، تتغير زاوية انعكاس أثناء المرحلة الانتقالية. إذا كانت الزاوية أقل من الزاوية الحرجة، لا ينعكس ضوء بعد الآن، يمكن أن تمر عبر طبقات ويمكن التقاط من الأسفل. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
ليرة سوريةectrum من العمليات التي يمكن تحليلها من قبل FIM واسع. دون أي تعديلات أخرى، والتصوير FIM يمكن استخدامها لمراقبة جميع مراحل اليرقات ذبابة الفاكهة (الشكل 5B) أو يمكن استخدامها لمتابعة القدم مطبوعات عالية من الكبار ذبابة الفاكهة 19. وبالمثل، مسارات C. ايليجانس أو حركة الديدان المفلطحة مستورقة يمكن تسجيلها بسهولة (الشكل 5C). ويبدو حتى تحليل الفطرية خوط أو الشعر الجذر النمو ممكنا 19. لدينا في الإعداد FIM الحالي، يتم دمج 4 × 16 الثنائيات الخفيفة الأشعة تحت الحمراء (IR- المصابيح) إلى 32 × 32 سم 2 لوحة زجاج الاكريليك، ودعا الجدول تتبع (الشكل 1). يتم ضبط شدة IR-المصابيح تبعا لوزن الأشياء على الطاولة تتبع، والذي يمكن القيام به بسهولة عن طريق التحكم الجزئي متصلا الدوائر عن طريق نبض العرض التحوير (PWM). FIM ينتج النقيض من الصور عالية جدا على طائفة واسعة من شدة الإضاءة. الأهم من ذلك أنها جنرالerates نتائج ممتازة في منخفض بالفعل irridation الأشعة تحت الحمراء بشكل عام.
يتم وضع الكاميرا مع فلتر الأشعة تحت الحمراء أسفل الجدول تتبع، والذي يسمح التكامل من المحفزات إضافية في الإعداد. المحفزات الحرارة يمكن تطبيقها بسهولة عن طريق لوحة المبرد الحرارة ويتم تطبيقها المنبهات الخفيفة عن طريق جهاز عرض LCD. كما عطور يمكن احتواؤها في التدرجات التي كتبها أغطية بسيطة 8. للتجارب التدرج الحرارة، وperfused للوحة المبرد الحرارة مع المياه الباردة والساخنة على كلا الجانبين على التوالي ووضعها 2 مم فوق اليرقات (الشكل 1B).
توليد التباين العالي، والأفلام عالية الجودة يفتح إمكانية للكمبيوتر يعمل بنظام متطور تحليل الصور، وبالتالي نحن تنفذ البرنامج FIMTrack لاستخراج مجموعة كبيرة من الميزات من الصور (الشكل 2). وقد تم تحديد ستة الميزات الأساسية الأولى من كفاف من الحيوان (الشكل 3A). توفر هذه الميزات خط الأساسلمزيد من حساب ستة ملامح الثانوية التي تصف شكل الحيوانات وموقفها في بعض المحفزات في نقطة زمنية معينة (الشكل 3B). حاليا، يتم احتساب تسعة ميزات التعليم العالي التي يتم دمج الجوانب الزمنية وبالتالي تميز تنقل من الحيوان جنبا إلى جنب مع ميزات الابتدائية والثانوية (الشكل 3C).
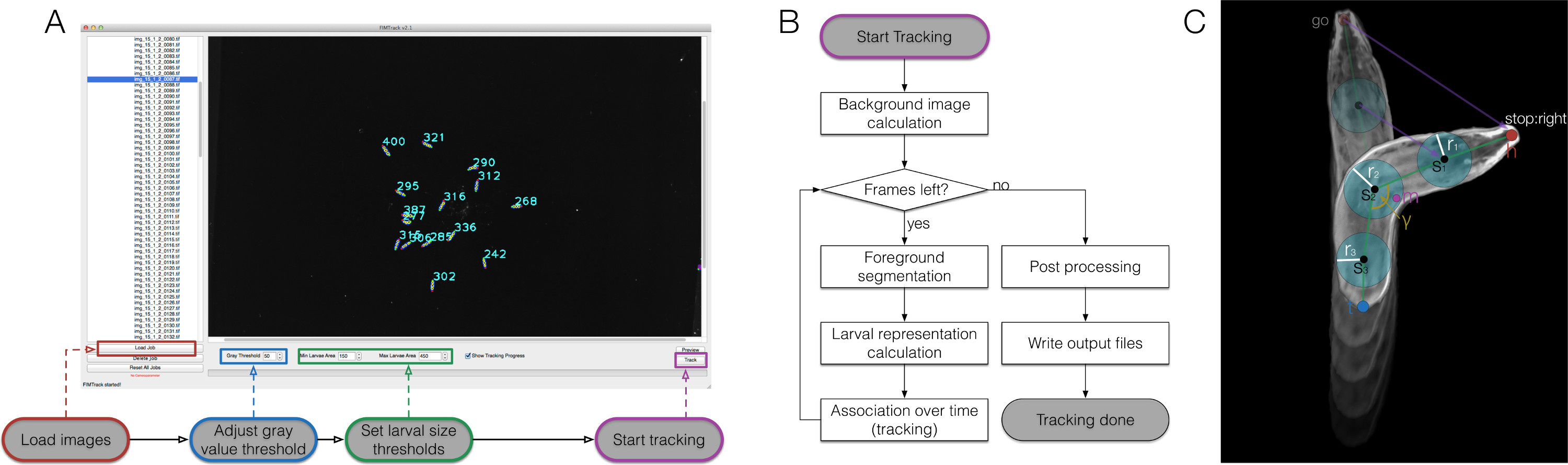
الشكل 2. نظرة عامة FIMTrack، وسير العمل حسابي والتمثيل اليرقات. (A) كيفية استخدام FIMTrack. يتم تحميل الصور. يجب تعيين عتبة قيمة الرمادية وعتبات حجم اليرقات تحديد اليرقات واحدة. يجب أن تكون منطقة اليرقات في [الحجم دقيقة، كحد أقصى الحجم]. بدء تتبع من قبل على زر تسليط الضوء عليها. (ب) تتبع سير العمل. بعد النقر فوق الزر ابدأ، وصورة الخلفية هي كاليفورنيا lculated (شدة الحد الأدنى مع مرور الوقت). طالما هناك أطر اليسار، تتم تجزئة اليرقات على أساس عتبة الرمادية وmin- وعتبة ماكس الحجم. لجميع الانقسامات وتحسب تمثيل اليرقات (قارن إلى (C)). ويرتبط كل نموذج جديد لمسار معين إذا كان المسار الصحيح هو متاح. إذا تم الوصول إلى الإطار الأخير، ويتم ذلك يتبع الصيغة النهائية مرحلة ما بعد المعالجة من قبل الجيل الانتاج. (C) تمثيل اليرقات. يتكون الحيوان من الرأس والذيل نقطة (ح و ر). بين هذه النقاط عدد فردي تعسفي من النقاط العمود الفقري ق ط يمكن تعيين نصف قطرها ص ط. وبالإضافة إلى ذلك، يتم حساب مركز كتلة m والجسم الرئيسي الانحناء γ زاوية. ورسمت العديد من المعلمات الحركة المتعلقة بخطوط الأرجواني. يرجى النقر هنا لمشاهدة نسخة أكبر من هذا الرقم.

الشكل 3. ميزات تحسب FIMTrack. (A) ميزات الأولية بناء على كفاف من الحيوانات. (B) ميزات الثانوية، استنادا إلى الميزات الأساسية. (C) ميزات التعليم العالي، على أساس الميزات الرئيسية في إطارات متتالية ومدخلات إضافية الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
Protocol
Representative Results
Discussion
في علم الأعصاب السلوكي هو إلزامي على فك كميا الصفات السلوكية المعقدة. هناك حاجة إلى إجراءات وبالتالي، يجب مراعاتها أعداد كبيرة من الأفراد بدقة عالية والآلي للتحليل الإحصائي. هنا، يتم وصف التصوير FIM، رواية، بسيطة وقوية الإعداد والتصوير، والتي تنص على وسائل لمراقبة تحرك من مجموعة واسعة من الحيوانات. تم اختبار فعالية الإعداد والتصوير FIM استخدام يرقات ذبابة الفاكهة، الديدان المفلطحة مستورقة وC. الديدان ايليجانس. توفر تكنولوجيا FIM التباين العالي جوهريا للكشف حتى الهياكل الداخلية للحيوانات، مثل الدماغ والقصبة الهوائية والأمعاء أو الغدية. الأهم من ذلك، ويتم تحديد هذه الهياكل الداخلية بقوة حتى يتمكنوا من خدمة إلى التعرف تلقائيا على التوجه للحيوان 19.
يمكن أن تتأثر نوعية الأفلام التي كتبها كمية زائدة من المياه على سطح الزحف. وبالتالي، فمن الأهمية بمكان لالتحكم في الرطوبة من أجار. المياه أجار أو أكثر من اللازم قديمة جدا على سطح يمكن أن يسبب التحف. وبالمثل، تأكد من أن يتم تضمين أية فقاعات الهواء في سطح الزحف. بشكل عام، على سطح أجار معدة إعدادا جيدا يسمح تسجيل الأفلام لمدة 4 ساعة.
يرجع ذلك إلى المبادئ الفيزيائية الأساسية التصوير FIM يولد الضوضاء تقريبا التسجيلات صورة حرة، مما أدى إلى جودة صورة رائعة. وهذا بدوره يسهل لاحقا تحليل الصور القائم على الحاسوب وتمكن إنتاجية عالية. ومع ذلك، يتم تقييد منهجية لتحليل الحيوانات التي الاتصال مباشرة على سطح أجار. وتحدى البرمجيات تتبع من قبل الحيوانات تشكيل شكل دونات. على الرغم من أن مؤشر ثنائي يعترف شكل دونات، قد تحسب العمود الفقري الخطأ.
نتيجة لبناء وحدات من الجدول تتبع المزدوج والثلاثي التصوير اللون هو في متناول اليد. وعلاوة على ذلك، يمكن للمحفزات إضافية (الضوء، عطور، المحفزات الكهربائية أو الميكانيكية) تكون بسهولة ديلivered من فوق. برنامج FIMTrack مصممة لتتناسب مع قوة التصوير FIM يمكن اعتمادها بسهولة لتتبع يرقات ذبابة الفاكهة، C. ايليجانس أو planarians. وهكذا، ونظرا لبنائه واضحة ورخيصة (انظر http://FIM.uni-muenster.de)، والتصوير FIM هو ممكن لمجموعة واسعة من التطبيقات الطبية الحيوية وعلى وجه الخصوص يسمح حاجة ماسة دراسات إنتاجية عالية.
Disclosures
The authors have nothing to disclose.
Acknowledgements
ونحن ممتنون لS. توماس الذي بدأ هذا المشروع، J. هيرمان وU. Burgbacher للمساعدة في بناء الإعداد FIM. وقد تم تمويل هذا العمل من قبل DFG (SFB 629 B6).
Materials
| Name of the Material/Equipment | Source | Catalog Number | Comments |
| FIM setup | Custom | details for construction or purchase of setups is available upon request | |
| Acrylic glass plate | Custom | Additional for agar pouring | |
| Heat radiator plate | Custom | Aluminum plate (paintet in matt black) perfusable on opposing sites with adjustable mounting | |
| Water calorifier/cooling pumps and hoses | Custom | based on GE healthcare MultiTempIII (No.: 18-1102-78) and Dr Bruno Lange GmBH (Typ: LTG013) | |
| Standard Camera (4 MP) | Basler | acA2040-25gm | Camera defaultly used for the FIM setup |
| Test Camera (1.4 MP) | QImaging | 1394 firewire (01- QIC-F-M-12 MONO) | Camera used for comparison |
| Test Camera (0.8 MP) | Point Grey | Dragonfly 2 (DR2-13S2M/C-CS) | Camera used for comparison |
| Test Camera (0.3 MP) | Sony | PS Eye USB2.0 camera | Camera used for comparison |
| Computer | Custom | equipped with at least i5 Intel processor or better, 16 GB RAM and sufficient HDD storage space [>1TB] | |
| Standard Fly food | Custom | ||
| Standard Fly vials 135 ml | Sarstedt AG&Co, Nümbrecht, Germany | 78,895 | |
| Petri dishes 9cm | Sarstedt AG&Co, Nümbrecht, Germany | 821,473 | |
| Ultrapure deionized water | Merck Millipore, Darmstadt, Germany | Synergy | |
| NaCl | Carl Roth GmbH, Karlsruhe, Germany | 3957.2 | |
| Food grade agar | AppliChem GmbH, Darmstadt, Germany | A0917,5000 | |
| Paintbrush (small and large) | Milan | Aquarell 310 Size 0 and 2 | |
| Pyrometer | Trotec | BP20 |
References
- Maimon, G., Straw, A. D., Dickinson, M. H. A Simple Vision-Based Algorithm for Decision Making in Flying Drosophila. Current Biology. 18 (6), 464-470 (2008).
- Frye, M. A., Dickinson, M. H. Closing the loop between neurobiology and flight behavior in Drosophila. Current opinion in neurobiology. 14 (6), 729-736 (2004).
- Fry, S. N. The Aerodynamics of Free-Flight Maneuvers in Drosophila. Science. 300 (5618), 495-498 (2003).
- Risse, B., Berh, D., Tao, J., Jiang, X., Klette, R., Klämbt, C. Comparison of two 3D tracking paradigms for freely flying insects. EURASIP Journal on Image and Video Processing. 2013 (1), 57 (2013).
- Yilmaz, A., Javed, O., Shah, M. Object tracking: A Survey. ACM Computing Surveys. 38 (4), (2006).
- Pistori, H., et al. Mice and larvae tracking using a particle filter with an auto-adjustable observation model. Pattern Recognition Letters. 31 (4), 337-346 (2010).
- Ramot, D., Johnson, B. E., Berry, T. L., Carnell, L., Goodman, M. B. The Parallel Worm Tracker: a platform for measuring average speed and drug-induced paralysis in nematodes. PloS one. 3 (5), e2208 (2008).
- Gershow, M., et al. Controlling airborne cues to study small animal navigation. Nature Methods. 9 (3), 290-296 (2012).
- Cui, X., et al. Lensless high-resolution on-chip optofluidic microscopes for Caenorhabditis elegans and cell imaging. Proceedings of the National Academy of Sciences of the United States of America. 105 (31), 10670-10675 (2008).
- Heng, X., et al. Optofluidic Microscopy – a Method for Implementing a High Resolution Optical Microscope on a Chip. Lab on a chip. 6 (10), 1274-1276 (2006).
- Liu, P., Martin, R. J., Dong, L. Micro-electro-fluidic grids for nematodes: a lens-less, image-sensor-less approach for on-chip tracking of nematode locomotion. Lab on a chip. 13 (4), 650-661 (2013).
- Spink, A. J., Tegelenbosch, R. A., Buma, M. O., Noldus, L. P. The EthoVision video tracking system–a tool for behavioral phenotyping of transgenic mice. Physiology. 73 (5), 731-744 (2001).
- Swierczek, N. A., Giles, A. C., Rankin, C. H., Kerr, R. A. High-throughput behavioral analysis in C. elegans. Nature methods. 8 (7), 592-598 (2011).
- Yu, C. -. C. J., Raizen, D. M., Fang-Yen, C. Multi-well imaging of development and behavior in Caenorhabditis elegans. Journal of neuroscience methods. 223, 35-39 (2014).
- Wang, S. J., Wang, Z. -. W. Track-A-Worm, An Open-Source System for Quantitative Assessment of C. elegans Locomotory and Bending Behavior. PloS one. 8 (7), e69653 (2013).
- Gomez-Marin, A., Stephens, G. J., Louis, M. Active sampling and decision making in Drosophila chemotaxis. Nature communications. 2, 441 (2011).
- Kane, E. A., et al. Sensorimotor structure of Drosophila larva phototaxis. Proc. Natl. Acad. Sci. U.S.A. 110 (40), E3868-E3877 (2013).
- Luo, L., et al. Navigational decision making in Drosophila thermotaxis. Journal of Neuroscience. 30 (12), 4261-4272 (2010).
- Risse, B., Thomas, S., Otto, N., Löpmeier, T., Valkov, D., Jiang, X., Klämbt, C. FIM, a Novel FTIR-Based Imaging Method for High Throughput Locomotion Analysis. PLoS one. 8 (1), e53963 (2013).
- Risse, B., Otto, N., Jiang, X., Klämbt, C. Quantifying subtle locomotion phenotypes of Drosophila larvae using internal structures based on FIM images. Comput Biol Med. 14, (2014).

