FIM 이미징 및 FIMtrack : 높은 처리량 및 비용 효율적인 로코 분석을 허용하는 두 가지 새로운 도구
Summary
FIM은 C. 작은 이동 물체를 추적하도록 설계된 신규 한 비용 효율적인 이미징 시스템 엘레, planaria 초파리 애벌레. 첨부 FIMTrack 프로그램은 빠르고 효율적인 데이터 분석을 제공하도록 설계되었습니다. 이 도구들을 함께 행동 특성의 높은 처리량 분석을 할 수 있습니다.
Abstract
신경 네트워크 기능의 분석은 행동 특성의 신뢰성있는 측정이 필요합니다. 자유롭게 움직이는 동물의 행동이 어느 정도 변수이기 때문에, 많은 동물은 유의 한 데이터를 획득하기 위해 분석되어야한다. 이는 다시 운동 패턴의 컴퓨터를 이용한 자동화 된 정량화가 필요합니다. 반투명의 작은 거의 움직이는 물체의 콘트라스트가 높은 화상을 얻기 위해,라는 FIM 좌절 전반사에 기초한 새로운 자기 공명 영상 법이 개발되었다. 이 설정에서, 동물은 기본 크롤링 표면과의 접촉 매우 특정한 위치에서 적외선 빛으로 조명. 이 방법론은 매우 높은 콘트라스트 이미지를 초래한다. 이어서, 이들의 높은 콘트라스트 이미지는 설정된 윤곽 추적 알고리즘을 사용하여 처리된다. 이를 바탕으로, 우리는 정량적 운동의 큰 다양성을 설명하는 데 필요한 특징을 추출하는 역할을 FIMTrack 소프트웨어 개발특성. 이 소프트웨어 패키지의 개발 과정에서, 우리는 추가 모듈을 쉽게 추가 할 수 있도록 오픈 소스 아키텍처에 우리의 노력을 집중했다. 프로그램은 플랫폼 독립적 인 동작 및 데이터 분석을 통해 사용자를 안내 직관적 GUI 수반한다. 모든 운동 매개 변수 값은 상기 데이터 분석 있도록 CSV 파일의 형태로 주어진다. 또한, 추적 소프트웨어에 통합 결과 뷰어 대화식 검토 자극 적분 동안 필요할 수있는 바와 같이, 출력을 조정하는 기회를 제공한다. FIM과 FIMTrack의 힘은 초파리 애벌레의 운동을 연구에 의해 입증된다.
Introduction
대부분의 동물은 매우 정교하고 제어 된 방식으로 이동할 수있는 능력을 가지고있다. 유전 적 기초 기본 운동 제어를 해독하기 위해서는 정량적으로 다른 행동 패턴을 평가하는 것이 필수입니다. 이러한 관점에서, 초파리는 이상적인 모델이 될 수있다. 자유롭게 비행 초파리의 추적 감질 1-4 발생하지만 상대적으로 낮은 속도로 두 가지 차원에서 초파리 애벌레의 크롤링 때문에 쉽게 모니터링 할 수있다. 적절한 조명과 함께 카메라 기반의 설정은 이미지 5를 획득하는 데 사용됩니다. 사건이나 투과광 모두 행동 실험 6,7에 사용된다. 그러나, 애벌레와 애벌레 운동의 크롤링 표면 충실한 기록 가능한 빛의 반사의 반투명 몸에 도전 할 수있다. 이러한 문제를 극복하기 위해, 어떤 복잡한 방법이 고안되었다. 최근, 암시 야 조명은 전경 / 배경 계속을 향상시키기 위해 도입되었다RAST 8. 카메라로 기록, 렌즈가없는 광학 이미징에 대한 대안으로 이미지 센서리스 온칩 (on-chip) 획득 기술은 9 ~ 11 도입되었습니다.
여러 추적 프로그램은 상용 소프트웨어 (12) 및 사용자 정의 솔루션을 포함하여, 최근에 도입되고있다. 높은 처리량 추적 프로그램에 대한 예는 멀티 웜 추적기 (MWT) 아르 (13)과 Multianimal 보행 그리고 트랙 (MAGAT) 8. 충돌 동물 여러 새로운 동물 정체성으로 이어질 수 있도록 모두 공통으로, 여러 개의 동물은 하나의 오픈 필드 경기장에서 추적 할 수있다. 이러한 한계를 극복하기 위해, 멀티 웰 설정 개별 웰 (14) (12)으로 분리하는 동물을 도입 하였다. 단일 개인의 운동을 정밀하게 정량화 현미경 (15)과 결합하여 가동 추적 스테이지를 사용함으로써 달성 될 수있다. 그러나, 이러한 모든 접근 방식 중 하나를 비용 효율적이지, 부족 충분한 재솔루션 또는 높은 처리량 표현형에 대한 소요 시간이 너무.
좌절 전체 내부 반사 (FTIR) (16) (도 1)에 기초하여 상기 언급 된 한계를 극복하기 위해, 우리가 개발 한 FIM (FTIR 기반 이미징 방법). 이 새로운 이미징 방식은 전례없는 높은 콘트라스트를 제공하고, 심지어 동물 (16)를 크롤링의 멀티 컬러 녹음을 할 수 있습니다. 이 편리하고 효과적인 방법의 기본 원리는 쉽다. 아크릴 유리판을 빛으로 범람 (예를 들어, 875 적외선 ㎚). 아크릴 인해 유리 및 공기의 굴절률이 다른으로, 광은 완전히 유리 / 공기 경계에서 반사된다. 아크릴 유리의 어떠한 가열 (16)을 언급하지 않습니다. 높은 굴절률을 가진 물체가 빛을 홍수 테이블을 터치하는 경우에만 이러한 개체를 입력 빛을 수 있습니다. 동물이 표면을 터치하면 빛이 반사되어 (그림 1) 아래에서 캡처 할 수 있습니다. 이에 의해, 접촉 만동물의 영역은 전반적으로 검은 배경으로 상세한 영상을 수있는 밝은 반점으로 나타납니다. 따라서, FIM-영상은 컴퓨터 비전 알고리즘에 대한 완벽한 동영상을 녹화 할 수 있습니다. FIM의 간단하고 강력한 사용 해주기로 이동할 복잡한 동물 행동의 상세한 분석 높은 처리량을 제공 및 처리 내용을 연구에 사용될 수있다 : 예를 들어, 후각 (8), (16); 비전 17 thermosensation (18).
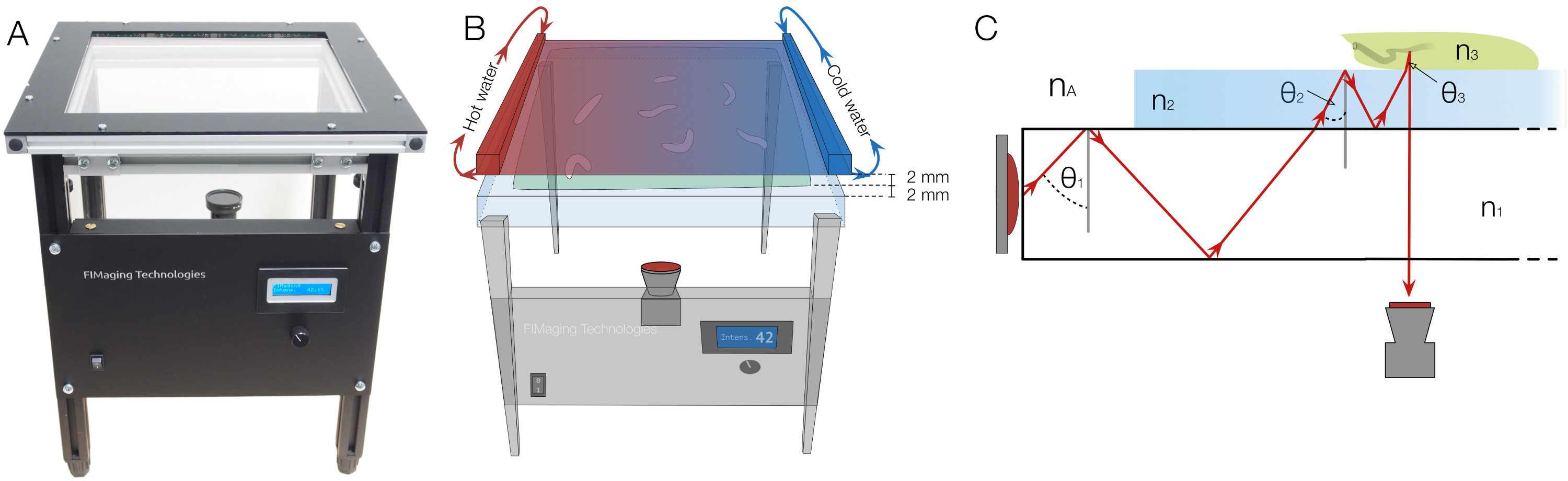
열 자극 통합 및 기본 물리적 원리 1. FIM 설치 그림. (A) FIM 설치. 조명 강도는 전면 패널에서 조절 될 수있다. (B) 열 자극을 제공하기 위해, 블랙, 알루미늄 판을 그린 양쪽에 온수와 냉수 관류, 한천 표면 위에 2mm를 배치되는자체는 두께 2mm이다. 구배는 온도차에 의해 방열기 판과 한천에 확립된다 (C) 좌절 전반사의 물리적 원리는 :. 아크릴 유리판 외광에 의해 조명된다. θ 1, θ 2, θ 3은 빛의 반사 각도를 나타냅니다. N 1, N 2, N 3 n은 각각 공기, 아크릴 유리, 한천과 유충의 굴절률을 표시하고 불평등 N <n은 1 <n은 2 <없음 3을 충족해야합니다. 굴절로 인해, 반사각 전환하는 동안 변경한다. 각도가 임계각 이하인 경우, 빛이 더 이상 반영되지 않습니다, 층을 통과 할 수 아래에서 캡처 할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
SPFIM 분석 할 수있는 프로세스의 ectrum은 광범위합니다. 더 이상의 조정없이, FIM 이미지는 초파리 (도 5b)의 모든 유생을 모니터링하는 데 사용할 수있는 성인 초파리 19 피트의 인쇄를 수행하기 위해 사용될 수있다. C.의 마찬가지로, 궤적 엘레 또는 플라나리아 편형 동물의 이동이 용이 (그림 5C)를 기록 할 수있다. 곰팡이 균사 또는 루트 모발 성장에도 분석이 가능한 19 나타납니다. 현재 FIM 설정에서, 4 × 16 적외선 발광 다이오드 (IR-LED)는 (그림 1) 추적 테이블이라고, 32 X 32cm 2 아크릴 유리판에 통합되어 있습니다. IR-LED의 강도를 용이 펄스 폭 변조 (PWM)를 통해 회로에 접속 된 마이크로 제어기에 의해 수행 될 수있는 추적 테이블 물체의 무게에 따라 조정된다. FIM은 조명 강도의 넓은 범위에 걸쳐 매우 높은 콘트라스트 이미지를 산출한다. 중요한 것은 세대이미 전반적으로 낮은 적외선 irridation에서 우수한 결과를 로지로.
적외선 필터와 카메라가 설치에 추가 자극에 통합 할 수 있습니다 추적 테이블 아래에 배치됩니다. 열 자극에 쉽게 방열기 판에 의해 도포 될 수 있고, 광 자극은 LCD 프로젝터에 의해 적용된다. 또한 방향제 간단한 뚜껑 (8)에 의해 기울기에 함유 될 수있다. 열 구배 실험을 위해, 방열기 판은 각각 양측에 냉온수 관류 및 유충 (도 1b) 위에 2mm 배치.
고 대비, 고품질의 영화의 생성을 정교한 컴퓨터 기반 이미지 분석을위한 가능성을 열어, 따라서 우리는 이미지에서 기능의 큰 세트를 추출 할 수있다 (그림 2) FIMTrack 소프트웨어를 구현했습니다. 상반기 주요 기능은 동물 (그림 3A)의 윤곽에서 정의되었다. 이러한 기능은베이스 라인을 제공주어진 시점 (그림 3B)에서 동물 모양과 특정 자극에 자신의 위치를 설명 여섯 보조 기능의 추가로 계산. 현재, 아홉 급 기능 시간적 측면을 통합함으로써 기본 및 보조 기능 (도 3c)와 함께 동물의 운동을 특성화되는 계산된다.
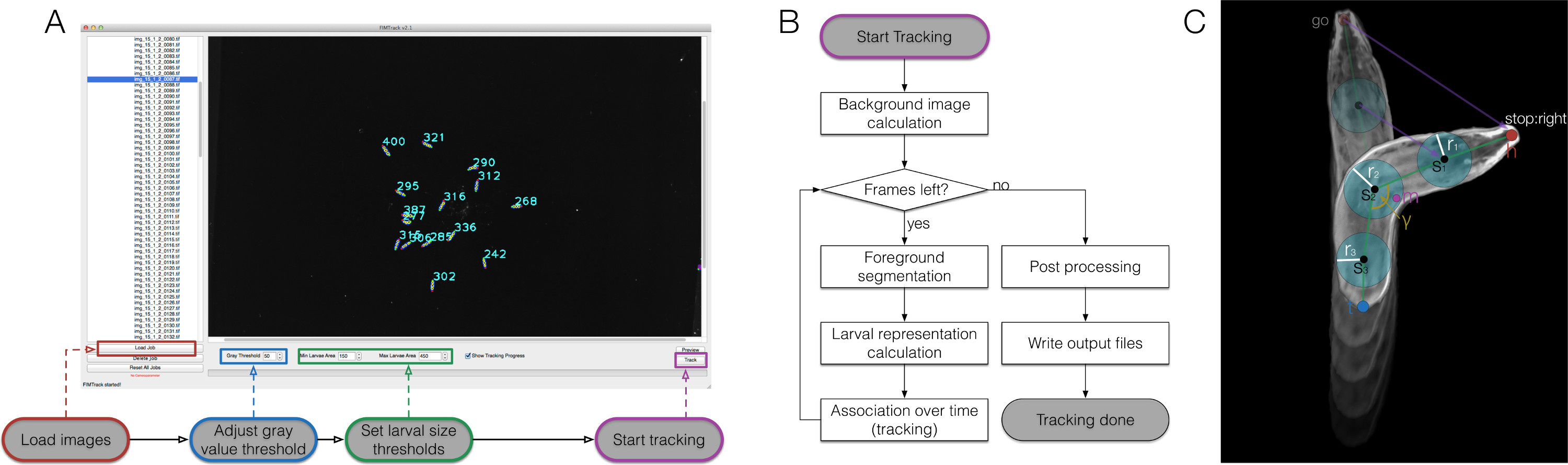
그림 2. FIMTrack 개요, 알고리즘 워크 플로우와 애벌레 표현입니다. (A) 어떻게 FIMTrack를 사용합니다. 이미지가로드됩니다. 회색 값을 임계 값과 하나의 유충을 정의 애벌레 크기 임계 값을 설정해야합니다. 애벌레 지역은 [최소 크기, 최대 크기]에 있어야합니다. 추적 강조 표시된 버튼으로 시작됩니다. (B) 추적 워크 플로우를. 시작 버튼이 클릭되면, 배경 이미지는 CAlculated (시간에 최소한의 강도). 만큼 왼쪽 프레임이 있기 때문에, 유충은 회색 임계 값과 min- 및 최대 크기 임계 값을 기준으로 분할된다. 애벌레 표현이 계산되는 모든 세분화를 들어 ((C)에 비교). 각각의 새로운 모델이 올바른 트랙을 사용할 수있는 경우 주어진 궤도에 연결되어 있습니다. 최종 프레임에 도달하면, 마무리 처리 후 출력 생성 뒤에 행해진 다. (C) 유생 표현. 동물은 머리와 꼬리 포인트 (시간 및 t)로 구성되어 있습니다. 이들 점 사이의 척추 포인트 S의 임의의 홀수 번호가 나는 반경 R I로 설정 될 수있다. 또한, 질량 m과 각도 γ 굽힘 본체의 중심이 계산된다. 여러 운동 관련 매개 변수가 보라색 선으로 스케치한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

FIMTrack에 의해 계산 3. 특징을 그림. 동물의 윤곽에 따라 (A) 1 차 기능을 제공합니다. (B) 보조 기능, 주요 기능을 기반으로. (C) 고등 기능, 연속적인 프레임 및 추가 입력의 기본 기능에 따라 이의 더 큰 버전을 보려면 여기를 클릭하십시오 그림.
Protocol
Representative Results
Discussion
행동 신경 과학에서는 정량적으로 복잡한 행동 특성을 해독 필수입니다. 따라서, 많은 개인은 고해상도로 관찰 자동화되어야 절차는 통계 분석을 위해 필요하다. 여기서, FIM 이미지는, 동물의 넓은 범위의 운동을 모니터링하는 수단을 제공하는 신규 한 간단하고 강력한 촬상 설정을 설명한다. FIM 영상 설정의 효능은 초파리 애벌레, 플라나리아 편형 동물와 C를 사용하여 테스트 하였다 엘레 웜. FIM 기술은 뇌, 기관, 창자 또는 proventriculus 같은 동물의 경우에도 내부 구조를 감지하는 본질적으로 높은 콘트라스트를 제공합니다. 그들은 자동적 동물 (19)의 방향을 식별하는 역할을 할 수 있도록 중요한 것은,이 내부 구조는 견고하게 식별된다.
영화의 품질은 크롤링 표면에 물 과잉에 의해 영향을받을 수있다. 따라서,에 중요한천의 수분을 제어 할 수 있습니다. 표면에 너무 오래 한천 또는 물을 너무 많이 아티팩트가 발생할 수 있습니다. 마찬가지로, 기포가 크롤링 표면에 포함되지 않도록. 일반적으로, 잘 준비된 한천 표면은 4 시간 동안 동영상을 녹화 할 수 있습니다.
때문에 실제 기본 원칙을 FIM 이미징은 최상의 이미지 품질의 결과, 거의 소음 무료 이미지 기록을 생성합니다. 이것은 차례로 후속 컴퓨터 기반 이미지 분석을 용이하게하고 높은 처리량을 가능하게한다. 그러나, 방법론은 직접 한천 표면에 접촉 동물을 분석 제한됩니다. 추적 소프트웨어는 도넛 모양을 형성하는 동물에 의해 도전한다. 이진 표시가 도넛 모양을 인식하고 있지만, 잘못된 척추가 계산 될 수 있습니다.
때문에 추적 테이블 듀얼 및 트리플 컬러 이미지의 모듈 구성에 도달입니다. 또한, 추가 자극 (빛, 냄새 물질, 전기 또는 기계적 자극)을 쉽게 할 수 있습니다 델위에서 ivered. FIM 이미지의 힘과 일치하도록 설계 FIMTrack 프로그램 용이 초파리 애벌레 C.을 추적 채용 할 수있다 엘레 또는 플라나리아. 따라서 인해 그것의 간단하고 저렴한 구성에 (http://FIM.uni-muenster.de 참조), FIM 이미징은 생물 의학 응용 프로그램의 광범위한 가능하다 특히 긴급 높은 처리량 연구를 필요로 허용한다.
Disclosures
The authors have nothing to disclose.
Acknowledgements
우리는 FIM 설치의 건설에 도움이 프로젝트를 시작했습니다 S. 토마스 J. 헤르만과 미국 Burgbacher에 감사드립니다. 이 작품은 DFG (SFB 629 B6)에 의해 투자되었다.
Materials
| Name of the Material/Equipment | Source | Catalog Number | Comments |
| FIM setup | Custom | details for construction or purchase of setups is available upon request | |
| Acrylic glass plate | Custom | Additional for agar pouring | |
| Heat radiator plate | Custom | Aluminum plate (paintet in matt black) perfusable on opposing sites with adjustable mounting | |
| Water calorifier/cooling pumps and hoses | Custom | based on GE healthcare MultiTempIII (No.: 18-1102-78) and Dr Bruno Lange GmBH (Typ: LTG013) | |
| Standard Camera (4 MP) | Basler | acA2040-25gm | Camera defaultly used for the FIM setup |
| Test Camera (1.4 MP) | QImaging | 1394 firewire (01- QIC-F-M-12 MONO) | Camera used for comparison |
| Test Camera (0.8 MP) | Point Grey | Dragonfly 2 (DR2-13S2M/C-CS) | Camera used for comparison |
| Test Camera (0.3 MP) | Sony | PS Eye USB2.0 camera | Camera used for comparison |
| Computer | Custom | equipped with at least i5 Intel processor or better, 16 GB RAM and sufficient HDD storage space [>1TB] | |
| Standard Fly food | Custom | ||
| Standard Fly vials 135 ml | Sarstedt AG&Co, Nümbrecht, Germany | 78,895 | |
| Petri dishes 9cm | Sarstedt AG&Co, Nümbrecht, Germany | 821,473 | |
| Ultrapure deionized water | Merck Millipore, Darmstadt, Germany | Synergy | |
| NaCl | Carl Roth GmbH, Karlsruhe, Germany | 3957.2 | |
| Food grade agar | AppliChem GmbH, Darmstadt, Germany | A0917,5000 | |
| Paintbrush (small and large) | Milan | Aquarell 310 Size 0 and 2 | |
| Pyrometer | Trotec | BP20 |
References
- Maimon, G., Straw, A. D., Dickinson, M. H. A Simple Vision-Based Algorithm for Decision Making in Flying Drosophila. Current Biology. 18 (6), 464-470 (2008).
- Frye, M. A., Dickinson, M. H. Closing the loop between neurobiology and flight behavior in Drosophila. Current opinion in neurobiology. 14 (6), 729-736 (2004).
- Fry, S. N. The Aerodynamics of Free-Flight Maneuvers in Drosophila. Science. 300 (5618), 495-498 (2003).
- Risse, B., Berh, D., Tao, J., Jiang, X., Klette, R., Klämbt, C. Comparison of two 3D tracking paradigms for freely flying insects. EURASIP Journal on Image and Video Processing. 2013 (1), 57 (2013).
- Yilmaz, A., Javed, O., Shah, M. Object tracking: A Survey. ACM Computing Surveys. 38 (4), (2006).
- Pistori, H., et al. Mice and larvae tracking using a particle filter with an auto-adjustable observation model. Pattern Recognition Letters. 31 (4), 337-346 (2010).
- Ramot, D., Johnson, B. E., Berry, T. L., Carnell, L., Goodman, M. B. The Parallel Worm Tracker: a platform for measuring average speed and drug-induced paralysis in nematodes. PloS one. 3 (5), e2208 (2008).
- Gershow, M., et al. Controlling airborne cues to study small animal navigation. Nature Methods. 9 (3), 290-296 (2012).
- Cui, X., et al. Lensless high-resolution on-chip optofluidic microscopes for Caenorhabditis elegans and cell imaging. Proceedings of the National Academy of Sciences of the United States of America. 105 (31), 10670-10675 (2008).
- Heng, X., et al. Optofluidic Microscopy – a Method for Implementing a High Resolution Optical Microscope on a Chip. Lab on a chip. 6 (10), 1274-1276 (2006).
- Liu, P., Martin, R. J., Dong, L. Micro-electro-fluidic grids for nematodes: a lens-less, image-sensor-less approach for on-chip tracking of nematode locomotion. Lab on a chip. 13 (4), 650-661 (2013).
- Spink, A. J., Tegelenbosch, R. A., Buma, M. O., Noldus, L. P. The EthoVision video tracking system–a tool for behavioral phenotyping of transgenic mice. Physiology. 73 (5), 731-744 (2001).
- Swierczek, N. A., Giles, A. C., Rankin, C. H., Kerr, R. A. High-throughput behavioral analysis in C. elegans. Nature methods. 8 (7), 592-598 (2011).
- Yu, C. -. C. J., Raizen, D. M., Fang-Yen, C. Multi-well imaging of development and behavior in Caenorhabditis elegans. Journal of neuroscience methods. 223, 35-39 (2014).
- Wang, S. J., Wang, Z. -. W. Track-A-Worm, An Open-Source System for Quantitative Assessment of C. elegans Locomotory and Bending Behavior. PloS one. 8 (7), e69653 (2013).
- Gomez-Marin, A., Stephens, G. J., Louis, M. Active sampling and decision making in Drosophila chemotaxis. Nature communications. 2, 441 (2011).
- Kane, E. A., et al. Sensorimotor structure of Drosophila larva phototaxis. Proc. Natl. Acad. Sci. U.S.A. 110 (40), E3868-E3877 (2013).
- Luo, L., et al. Navigational decision making in Drosophila thermotaxis. Journal of Neuroscience. 30 (12), 4261-4272 (2010).
- Risse, B., Thomas, S., Otto, N., Löpmeier, T., Valkov, D., Jiang, X., Klämbt, C. FIM, a Novel FTIR-Based Imaging Method for High Throughput Locomotion Analysis. PLoS one. 8 (1), e53963 (2013).
- Risse, B., Otto, N., Jiang, X., Klämbt, C. Quantifying subtle locomotion phenotypes of Drosophila larvae using internal structures based on FIM images. Comput Biol Med. 14, (2014).

