Summary
Bestehende Ansätze für den Bau chronisch implantierbarer peripherer Nervenmanschettenelektroden für den Einsatz bei kleinen Nagetieren erfordern oft spezielle Ausrüstung und/oder hochqualifiziertes Personal. In diesem Protokoll zeigen wir einen einfachen, kostengünstigen Ansatz zur Herstellung chronisch implantierbarer Manschettenelektroden und ihre Wirksamkeit für die Vagusnervstimulation (VNS) bei Ratten.
Abstract
Periphere Nervenmanschettenelektroden werden seit langem in den Neurowissenschaften und verwandten Bereichen zur Stimulation beispielsweise von Vagus- oder Ischiasnerven eingesetzt. Mehrere neuere Studien haben die Wirksamkeit von chronischen VNS bei der Verbesserung der Plastizität des zentralen Nervensystems gezeigt, um die motorische Rehabilitation, das Lernen zum Aussterben und die sensorische Diskriminierung zu verbessern. Der Bau chronisch implantierbarer Geräte für den Einsatz in solchen Studien ist aufgrund der geringen Größe von Ratten eine Herausforderung, und typische Protokolle erfordern eine umfassende Schulung des Personals und zeitaufwändige Mikrofertigungsmethoden. Alternativ können handelsübliche implantierbare Manschettenelektroden zu deutlich höheren Kosten erworben werden. In diesem Protokoll stellen wir eine einfache, kostengünstige Methode für den Bau kleiner, chronisch implantierbarer peripherer Nervenmanschettenelektroden für den Einsatz bei Ratten vor. Wir validieren die kurz- und langfristige Zuverlässigkeit unserer Manschettenelektroden, indem wir nachweisen, dass VNS bei Ketamin/Xylazin-Anästhesisierten Ratten eine Abnahme der Atemfrequenz im Einklang mit der Aktivierung des Hering-Breuer-Reflexes produziert, sowohl zum Zeitpunkt der Implantation als auch bis zu 10 Wochen nach der Implantation des Geräts. Darüber hinaus zeigen wir die Eignung der Manschettenelektroden für den Einsatz in chronischen Stimulationsstudien, indem wir VNS mit einer geschickten Hebelpressleistung koppeln, um die plastische Plastizität der motorischen Kartkarte zu induzieren.
Introduction
In letzter Zeit ist die Nachfrage nach chronisch implantierbaren Manschettenelektroden zur Stimulation peripherer Nerven gestiegen, da Studien zunehmend die präklinische Nützlichkeit dieser Technik zur Behandlung zahlreicher entzündlicher Erkrankungen1,2,3 und neurologische Erkrankungen4,5,6,7,8,9,10,11,12,13,14,15. Chronische VNS, zum Beispiel, hat sich gezeigt, dass die neokortikale Plastizität in einer Vielzahl von Lernkontexten zu verbessern, Verbesserung der motorischen Rehabilitation4,5,6,7,8, Aussterben lernen10,11,12,13,14, und sensorische Diskriminierung15. Kommerziell erhältliche periphere Nervenmanschettenelektroden sind oft mit längeren Zeiten für die Auftragserfüllung und relativ hohen Kosten verbunden, die ihre Zugänglichkeit einschränken können. Alternativ bleiben die Protokolle für die "in-house" Herstellung von chronisch implantierbaren Manschettenelektroden begrenzt, und die Nagetieranatomie stellt aufgrund ihrer geringen Größe besondere Herausforderungen dar. Aktuelle Protokolle zur Konstruktion von Manschettenelektroden für chronische Nagetierexperimente erfordern oft den Einsatz komplexer Geräte und Techniken sowie eines intensiv geschulten Personals. In diesem Protokoll zeigen wir einen vereinfachten Ansatz für die Herstellung von Manschettenelektroden auf der Grundlage zuvor veröffentlichter und weit verbreiteter Methoden16,17. Wir validieren die Funktionalität unserer chronisch implantierten Elektroden bei Ratten, indem wir zeigen, dass zum Zeitpunkt der Manschettenimplantation um den linken Hals-Emeritus-Nerv die Stimulation der Manschettenelektroden erfolgreich zu einem Abbruch der Atmung und des Tropfens SpO2 führte. Die Stimulation der afferenten Pulmonator-Vagalfasern ist dafür bekannt, den Hering-Breuer-Reflex zu beeinflussen, bei dem die Hemmung mehrerer Atemkerne im Hirnstamm zur Unterdrückungsinspiration18führt. Somit bieten die Einstellung der Atmung im Einklang mit dem Hering-Breuer-Reflex und dem daraus resultierenden Rückgang in SpO2 einen einfachen Test für die richtige Elektrodenimplantation und Manschettenfunktion bei betääuten Ratten. Um die Langzeitfunktionalität chronisch implantierter Manschettenelektroden zu validieren, wurden reflexartige Reaktionen zum Zeitpunkt der Implantation gemessen und mit den Reaktionen verglichen, die bei denselben Tieren sechs Wochen nach der Implantation erhalten wurden. Eine zweite Gruppe von Ratten wurde nach einem Verhaltenstraining an einer Hebelpressaufgabe mit VNS-Manschettenelektroden implantiert. Bei diesen Ratten führte VNS gepaart mit der korrekten Aufgabenleistung zu einer Reorganisation der kortikalen Motorkarte, die mit den zuvor veröffentlichten Studien19,20,21,22übereinstimmte. Zum Zeitpunkt der motorkortikalen Kartierung unter Narkose, die 5–10 Wochen nach der Implantation des Geräts stattfand, validierten wir die Manschettenfunktion bei VNS-behandelten Tieren weiter, indem wir bestätigten, dass VNS erfolgreich eine Einstellung der Atmung und einen Rückgang von mehr als 5 % in SpO2induzierte.
Die kürzlich veröffentlichten Protokolle von Childs et al.17 und Rios et al.16 bieten einen gut validierten Ausgangspunkt für einen vereinfachten Ansatz zur Herstellung von Manschettenelektroden, da diese beliebte Methode von mehreren Labors verwendet wurde, die chronische VNS-Studien an Nagetieren1,2,3,4,5,6,7,8,9,10,11. Das ursprüngliche Verfahren umfasst mehrere hochpräzise Schritte zur Manipulation der feinen Mikrodrähte, so dass die Herstellung von Manschettenelektroden mehr als eine Stunde dauert, und umfangreiches Training, um zuverlässig zu arbeiten. Der hier beschriebene vereinfachte Ansatz erfordert deutlich weniger Materialien und Werkzeuge und kann in weniger als einer Stunde von minimal geschultem Personal absolviert werden.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Alle in diesem Protokoll beschriebenen Verfahren werden in Übereinstimmung mit dem NIH-Leitfaden für die Pflege und Verwendung von Labortieren durchgeführt und vom Institutional Animal Care and Use Committee der University of Texas in Dallas genehmigt.
1. Stimulierende Manschettenelektroden-Fertigung
- Bereiten Sie die Manschettenschläuche vor.
- Schneiden Sie mit einer Rasierklinge ein Stück Polymerschläuche mit einer Länge von 2,5 mm. Setzen Sie Zangenspitzen oder eine Büroklammer durch den Schlauch und verwenden Sie die Klinge, um einen Schlitz längs durch die Wand des Schlauches auf einer Seite der Manschette zu machen.
- Entfernen Sie die Zange aus dem Schlauch und legen Sie eine große Nähnadel durch die Mittellinie der Manschette, senkrecht zur langen Achse. Setzen Sie die Nadel durch den Schlitz (oben) und in die Mitte des Rohres gegenüber (unten). Legen Sie die Nadel in die Schaumstoffplatte, um die Manschette während der verbleibenden Montageschritte an Ort und Stelle zu fixieren.
- Legen Sie Naht zur Sicherung Manschettenverschluss während der Implantation.
- Legen Sie die kleine Nähnadel durch die Wand der Manschette, auf der Mittellinie, etwa 0,5 mm vom oberen Schlitz auf einer Seite. Setzen Sie die Nadel von innen nach außen ein, um eine Beschädigung der Manschettenschläuche zu vermeiden. Legen Sie eine 2 cm lange 6/0 Naht durch das Nadelöhr und ziehen Sie die Nadel durch die Wand des Schlauches, um die Naht in die Manschette einzufädeln.
- Lassen Sie den Faden an Ort und Stelle, entfernen Sie die Nadel und durchstechen Sie ein zweites Loch durch die Rohrwand etwa 0,5 mm unterhalb des ersten Lochs, entlang der Mittellinie der Manschette. Legen Sie die Naht durch das Nadelöhr und ziehen Sie die Nadel durch die Schlauchwand, um die Naht wieder durch die Manschette zu fädeln.
- Beide Enden des Nahtfadens sollten nun auf der Außenseite der Manschette sein. Passen Sie die Naht so an, dass sich 1,5 cm vom oberen Loch und 0,5 mm vom unteren Loch aus ausdehnen.
- Tragen Sie eine kleine Menge UV-Härtekleber auf das kurze Ende der Naht auf, die sich vom unteren Loch aus erstreckt, und ziehen Sie das längere Nähtedesende, bis der untere Schwanz mit der Außenwand des Schlauches fast bündig ist. Verwenden Sie den UV-Stab, um den Klebstoff auszuhärten und halten Sie die Naht fest an Ort und Stelle.
- Wiederholen Sie die Schritte 1.2.1 bis 1.2.3 auf der gegenüberliegenden Seite der Manschette.
- Platzieren Sie die Platinum:Iridium (Pt:Ir) Drahtleitungen.
- Verwenden Sie die kleine Nähnadel, um 4 Löcher in der Manschettenwand zu machen. Jedes Lochpaar sollte etwa 0,5–0,8 mm von der senkrechten Mittellinie entfernt platziert werden, wobei ein Loch etwa 0,5–0,8 mm vom oberen Schlitz auf beiden Seiten der Manschette entfernt ist.
VORSICHT: Für die gleichmäßigste und genaueplatzierung der Leitungen, legen Sie die Nadel von innen nach außen, um alle Löcher zu machen, mit der Nahtplatzierung als Führung. - Setzen Sie die Nähnadel erneut ein, diesmal arbeiten Sie von außen nach innen, durch Bleiloch 1. Legen Sie ca. 0,5 cm einer 7,5 cm langen Pt:Ir-Drahtdurchleitung durch das Nadelöhr und ziehen Sie die Nadel durch den Schlauch, um die Drahtleitung durch die Manschettenwand zu fädeln. Stellen Sie den Draht so ein, dass sich auf der Außenseite der Manschette 4,5 cm verlängern (Abbildung 1A).
- Setzen Sie die Nadel durch Bleiloch 1 wieder ein, arbeiten Sie wieder von außen nach innen, und setzen Sie die Nadel zusätzlich durch Bleiloch 2 direkt gegenüber dem Bleiloch 1 ein. Legen Sie 0,5 cm des kürzeren (innen) Endes des Pt:Ir-Drahtes durch das Nadelöhr und ziehen Sie die Nadel durch den Schlauch, um den Drahtdurchschlag durch die Manschettenwände zu fädeln.
HINWEIS: Beide Enden des Pt:Ir-Drahtes sollten nun auf der Außenseite der Manschette sein, und eine Drahtschlaufe wird um die Schlitzkante und durch Bleiloch 1 gebildet (Abbildung 1B). - Wiederholen Sie die Schritte 1.3.1 bis 1.3.3, um Pt:Ir-Draht durch die Bleibohrungen 3 und 4 zu platzieren.
- Entfernen Sie mit einem Butanfeuerzeug die Isolierung vorsichtig von einer Länge von 5–6 mm am Ende der Pt:Ir-Drähte, die sich von Bleiloch 2 und Bleiloch 4 erstrecken.
VORSICHT: Isolieren Sie die Enden der Leitungen vorsichtig vom Rest der Manschettenanordnung, um schäden an der Manschette zu vermeiden. Verwenden Sie Werkzeuge, um die Drähte zu halten, um Verletzungen zu vermeiden. - Richten Sie den nackten Draht innerhalb der Manschette aus, um die Leitungen an ihren endgültigen Positionen zu platzieren. Ziehen Sie dazu vorsichtig am Ende des Pt:Ir-Drahtes, der sich von Loch 1 aus erstreckt, bis der nicht isolierte Teil des Drahtes mit Loch 1 bündig ist. Wiederholen Sie dies mit der anderen Leitung, um das nicht isolierte Ende des Drahtes auszurichten, der durch die Bleibohrungen 3 und 4 gefädelt wird.
- Tragen Sie eine kleine Menge UV-Härtekleber auf die Drahtschlaufen an der Außenseite der Manschette an den Bleilöchern 1 und 3 auf. Verwenden Sie den UV-Stab, um den Klebstoff zu härten und die Leitungen an Ort und Stelle zu sichern.
- Verwenden Sie eine kleine Pipettenspitze, um die ungedämmten Pt:Ir-Drahtleitungen gegen die Innenwand der Manschette zu schieben. Sobald die Leitungen an Ort und Stelle sind, schneiden Sie die Enden der Drähte, die sich von den Bleilöchern 2 und 4 erstrecken, so dass sich ca. 1 mm Draht über das Äußere der Manschettenwand hinaus erstreckt.
- Falten Sie die 1 mm Schwänze des Drahtes flach gegen die Außenfläche der Manschette, wobei darauf geachtet wird, sie nicht zusammen zu verkurzen. Tragen Sie eine kleine Menge UV-Härtekleber auf, um nur die beiden Schwänze zu bedecken und den Klebstoff auszuhärten, um die Bleiplatzierung zu sichern und eine elektrische Isolierung zu gewährleisten.
VORSICHT: Es ist wichtig, die von außen belichteten Pt:Ir-Oberflächen vollständig mit Klebstoff zu bedecken, um die Drähte zu isolieren und eine Off-Target-Stimulation zu vermeiden.
- Verwenden Sie die kleine Nähnadel, um 4 Löcher in der Manschettenwand zu machen. Jedes Lochpaar sollte etwa 0,5–0,8 mm von der senkrechten Mittellinie entfernt platziert werden, wobei ein Loch etwa 0,5–0,8 mm vom oberen Schlitz auf beiden Seiten der Manschette entfernt ist.
- Sichern Sie die Pt:Ir Drahtleitungen an Ort und Stelle mit Nahtsicherung.
- Entfernen Sie die große Nadel mit der Manschettenanordnung von der Schaumstoffplatte. Legen Sie eine 3 cm lange 6/0 Naht durch das Nadelöhr und ziehen Sie die Nadel durch den Schlauch, um die Naht durch den Boden der Manschette in der Mitte zu fädeln.
- Wechseln Sie zur kleinen Nähnadel, um das Nahtgewinde für die Pt:Ir-Bleisicherung zu vervollständigen. Setzen Sie die Nadel durch das gleiche Mittellinienloch und arbeiten Sie wieder von innen nach außen, um eine Verformung der Schläuche und der Drahtleitungen zu vermeiden. Setzen Sie den äußeren Schwanz der Naht durch das Nadelöhr und ziehen Sie die Nadel durch die Manschettenwand, um eine Nahtscheine um den Rand der Manschette zu erstellen (Abbildung 1C).
HINWEIS: Verwenden Sie Zangen und arbeiten Sie unter dem Mikroskop, um sicherzustellen, dass die Naht entlang der langen Achse der Manschette ausgerichtet ist und flach gegen den Schlauch liegt. Dieser Schritt stellt sicher, dass die Leitungen auf der Innenseite der Manschette getrennt bleiben und seitlich zur Manschette midline gehalten werden. - Erstellen Sie eine zweite Schleife um das gegenüberliegende Ende der Manschette, indem Sie die Enden der Naht in einem halben Knoten an der Außenseite der Manschette binden. Stellen Sie sicher, dass die Naht entlang der langen Achse der Manschette verläuft und flach gegen den Schlauch liegt. Während Sie den Knoten fest halten, so dass er flach gegen den Schlauch liegt, eine kleine Menge UV-Härtekleber auf den Halbknoten auftragen und aushärten, um an Ort und Stelle zu halten.
- Schneiden Sie die Enden des Nahtgewindes vorsichtig so nah wie möglich am Knoten. Verwenden Sie bei Bedarf eine kleine Menge zusätzlichen UV-Härtekleber, um die kurzen Enden der Naht zu kleben, so dass sie flach gegen den Schlauch legen (Abbildung 1D).
- Lötsteckerstifte an den Pt:Ir-Drahtleitungen.
- Entfernen Sie mit einem Butanfeuerzeug die Isolierung von 3 mm am Ende jeder der Pt:Ir-Drahtleitungen. Löten Sie die Becherseite eines Goldstifts (siehe Tabelle der Materialien)an das nicht isolierte Ende jeder Leitung.
- Testen Sie die Impedanz des montierten Geräts.
- Schließen Sie die Goldstifte an die Eingänge eines LCR-Meter- oder Elektrodenimpedanzprüfmoduls an und stellen Sie die Prüffrequenz auf 1 kHz ein. Untertauchen Sie die Manschettenschläuche (und Pt:Ir Stimulationskontakte innen zur Manschette) in einem kleinen Becher, der mit Einer Linie gefüllt ist, und achten Sie darauf, die goldenen Bleistifte und Sondenverbinder trocken zu halten. Vergewissern Sie sich, dass die montierte Manschette eine Impedanz von weniger als 2 kHz aufweist, bevor Sie mit der Implantation fortfahren.
HINWEIS: Hohe Impedanz weist oft auf eine unzureichende Pt:Ir-Oberfläche hin, die durch Faktoren wie unzureichende Entfernung der Isolierung, versehentliches Auftragen von Klebstoff im Manschetteninneren, gebrochene Drahtstränge usw. entstehen kann. Manschetten sollten auch auf gebrochene oder schlecht platzierte Drahtstränge untersucht werden, die zu kurzen Kontakten mit langzeitigem Gebrauch führen können.
- Schließen Sie die Goldstifte an die Eingänge eines LCR-Meter- oder Elektrodenimpedanzprüfmoduls an und stellen Sie die Prüffrequenz auf 1 kHz ein. Untertauchen Sie die Manschettenschläuche (und Pt:Ir Stimulationskontakte innen zur Manschette) in einem kleinen Becher, der mit Einer Linie gefüllt ist, und achten Sie darauf, die goldenen Bleistifte und Sondenverbinder trocken zu halten. Vergewissern Sie sich, dass die montierte Manschette eine Impedanz von weniger als 2 kHz aufweist, bevor Sie mit der Implantation fortfahren.
2. Kopfkappenkonstruktion
HINWEIS: Die Verfahren für die Kopfkappenmontage ähneln denen, die zuvor veröffentlicht wurden (Childs et al.17), und werden hier aus Gründen der Bequemlichkeit zusammengefasst.
-
Montieren Sie die Kopfkappe17
- Schneiden Sie zwei kleine Stücke von 30 AWG Drahtwickeln, eine 13 mm in der Länge und eine 10 mm in der Länge. Entfernen Sie die Isolierung von 1,5 mm an jedem Ende beider Drähte. Löten Sie die Stiftseite eines Goldstifts an ein Ende jedes Drahtes, so nah wie möglich an der Tasse. Verwenden Sie Drahtschneider, um überschüssige Länge des Stiftes über die Lötstelle zu schneiden.
- Löten Sie die anderen Enden der AWG-Drähte an die beiden zentralen Lötbecher eines 4-poligen Mikrostreifensteckers.
- Biegen Sie die Drahtkopfkappe führt nach oben in Richtung des Steckers und legen Sie die Goldstifte flach gegen den Stecker, parallel zueinander, wie in Abbildung 2Agezeigt. Der Stift, der mit dem kürzeren Draht verbunden ist, sollte unter dem Stift platziert werden, der mit dem längeren Draht verbunden ist. Verwenden Sie Nagelacryl, Dentalzement oder UV-Härtekleber, um die Kopfkappenleitungen an Ort und Stelle zu sichern.
3. Gerätenutzung
- Implantieren Sie die Manschettenelektroden zur chronischen Vagusnervstimulation.
HINWEIS: Alle chirurgischen Eingriffe sollten mit steriler oder aseptischer Technik unter entsprechender Anästhesie gemäß den NIH-Richtlinien für die Pflege und Verwendung von Labortieren und mit lokaler IACUC-Zulassung durchgeführt werden. Die folgenden Verfahren sollen eine repräsentative Verwendung des Geräts veranschaulichen und nicht umfassend sein.- Legen Sie die Ratte in einen stereotaxic Rahmen und machen Sie einen sagittalen Schnitt über die parietalen und okzipitalen Knochen, um die Schädeloberfläche für die Implantation der Kopfkappe/Stecker zu offenbaren. Bohren Sie vorsichtig 4 Löcher in den Schädel und legen Sie Juwelierschrauben. Verwenden Sie Zahnacryl, um die Kopfkappe am Schädel und Schrauben zu befestigen.
- Entfernen Sie die Ratte aus dem stereotaxic Rahmen und legen Sie auf der rechten Seite. Machen Sie einen vertikalen Schnitt in der Haut auf der linken Seite des Halses, und sezieren Sie sorgfältig den linken Vagusnerv von der Halsschlagader, zwischen den Brustkörpern und den Sternohyoidmuskeln und unter dem omohyiden Muskel.
- Tunnel die Manschette führt subkutan in Richtung des Schädels. Verbinden Sie die Leitungen mit den Goldstiften an die Kopfkappe.
- Legen Sie den Vagusnerv in die Manschette und sichern Sie das Gerät geschlossen, indem Sie einen doppelten Knoten in die Manschettennähte binden. Achten Sie darauf, den Nerv während der Implantation nicht zu beschädigen, indem Sie den Nerv mit stumpfen, nichtleitenden Haken manipulieren oder das Bindegewebe, das den Nerv umgibt, greifen.
- Testen Sie das Implantat durch Stimulation des Geräts (10 s Zug von 0,8 mA, 30 Hz, 100 s biphasische Impulse). Die richtige Implantation führt zur Einstellung der Atmung und zu einem Rückgang der SpO2 von 5% oder mehr.
- Bedecken Sie die Goldstifte und freiliegenden Leitungen mit Zahnacryl, schließen Sie Wunden mit Nähten und reinigen Sie die Einschnittstellen mit Saline-, Alkohol- und Povidon-Jodlösung.
- Bereitstellung von Ersatzflüssigkeiten, Analgetika und postoperativer Versorgung gemäß den NIH-Richtlinien und der IACUC-Zulassung.
- Stimulieren Sie den Vagusnerv während des wachen Verhaltens.
HINWEIS: Die Lieferung von VNS, wenn Tiere bestimmte motorische Aufgaben ausführen, hat sich zuvor gezeigt, dass die Motorkartendarstellung der aufgabenrelevanten Muskulatur erweitert wird. Wir verwenden dieses validierte Paradigma, um ein repräsentatives Beispiel für die Gerätenutzung zu liefern, aber viele andere Verhaltensparadigmen und/oder Stimulationsparameter können für alternative Anwendungen relevant sein. Ratten wurden vor der Geräteimplantation auf die hier verwendete Hebelpressaufgabe geschult. Nach der Operation wurde die gute Leistung vor der VNS-Lieferung erneut überprüft: Ratten führten mindestens 100 erfolgreiche Versuche in zwei 30-min-Trainingseinheiten pro Tag durch. VNS wurde während 10 nachfolgenden Trainingseinheiten über 5 Tage mit korrekten Hebelpressen gekoppelt.- Schließen Sie die Ratte über eine implantierte Kopfkappe an einen Stimulusgenerator an und passen Sie sie an die entsprechenden Stimulationseinstellungen an. Für die VNS-induzierte Reorganisation der motorischen kortikalen Karte koppeln Sie jede richtige Hebelpresse mit einem einzigen Zug von 15 biphasischen Impulsen, jeder mit einer Breite von 100 s und einer Amplitude von 800 A, die bei einer Frequenz von 30 Hz geliefert wird.
- Ein Stimulationszug wird unmittelbar nach Erkennung jeder erfolgreichen Hebelpresse während zehn 30 min Trainingseinheiten geliefert. Verwenden Sie während der VNS-Lieferung ein Oszilloskop, um die erfolgreiche Bereitstellung der Stromstimulation zu überwachen.
- Validieren Sie die chronisch implantierte Manschettenfunktion.
- Verwenden Sie innerhalb von 24 h der letzten VNS-gekoppelten Trainingseinheit die intrakranielle Mikrostimulation (ICMS), um die funktionelle somatotopische Karte im Motorkortex19,20,21,22zu quantifizieren.
- Nach Induktion der Anästhesie für die ICMS-Kartierung des Motorkortex, validieren Sie die Manschettenfunktion erneut, indem Sie einen 10 s Zug von 30 Hz, 0,8 mA Stromstimulation (100 s biphasische Impulse) anwenden, was zu einer Einstellung der Atmung und einer Reduzierung der SpO2-Spiegel von mindestens 5% führen sollte, im Einklang mit dem Hering-Breuer-Reflex.
ANMERKUNG: Je nach Anwendung kann die Manschettenfunktion als akzeptabel angesehen werden, wenn ein zuverlässiger SpO2-Tropfen von weniger als 5 % beobachtet wird oder wenn höhere Stromamplituden (bis zu 1,6 mA) zuverlässig mindestens eine Reduzierung der SpO2um mindestens 5 % erzeugen. Die Nichtbeachtung eines Atemstillstands und/oder einer zuverlässigen Abnahme der SpO2 ist ein Hinweis auf ein Implantatversagen.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Vagus Nervenmanschettenelektroden und Kopfkappen wurden chronisch bei Ratten nach zuvor veröffentlichten chirurgischen Verfahren17,19,20,21,22. Vor der Implantation wurde die Impedanz bei 1 kHz über die Manschettenleitungen gemessen, wobei die Manschettenschläuche in der Saline versunken waren (Impedanz = 1,2 x 0,17 k. [Mittelwert sst]; N = 9). Es wurden nur Manschetten mit Impedanzen von weniger als 2 k' in Derinlinie implantiert; alle Manschetten erfüllten dieses Kriterium (0/9 Manschetten ausgeschlossen). Während der Implantationsoperationen wurde die funktionelle Validierung aller Manschetten durch Tests auf eine stimulationsinduzierte kurze Einstellung der Atmung und anschließenden Rückgang der Blutsauerstoffsättigung, die dem Hering-Breuer-Reflex zugeschrieben wird, durchgeführt. Um diese Reaktion zu beschwören, wurde ein 10 s Zug von 30 Hz, 0,8 mA Stromstimulation (100 s biphasische Impulse) über die Manschettenleitungen geliefert. Bei 9/9 implantierten Manschetten beobachteten wir eine VNS-induzierte Unterbrechung der Atmung für die Dauer der 10-Sekunden-Stimulation, die mit einem Rückgang der SpO2 von mindestens 5% einherging (% Veränderung der SpO2 = -10,3 x 3,2%, Mittelwert s std; Bereich = -5,7 bis -14,5%), Bestätigung der Manschettenfunktion und korrekte Implantation. Während der ersten Implantation fanden wir eine signifikante Korrelation zwischen den anfänglichen SpO2-Messungen und der prozentualen Veränderung des SpO2, die durch VNS evoziert wurde (Abbildung 2B; R2 = 0,60, p = 0,0083, Pearsons lineare Korrelation), in Übereinstimmung mit veröffentlichter Literatur, die zeigt, dass die Anästhesietiefe die Größe des Hering-Breuer-Reflexes23,24beeinflusst. Um die Langzeitfunktionalität der chronisch implantierten Manschetten zu testen, wurden Ratten 6 Wochen nach der Geräteimplantation erneut beästhebt und VNS angewendet, um die Hering-Breuer-Reflexreaktion zu evozieren. Bei 7 von 9 Geräten beobachteten wir einen Rückgang der SpO2 um mehr als 5 % bei 10 s Zügen mit 0,8 mA, 30 Hz Stimulation (Abbildung 2C). Bei diesen Geräten unterscheidet sich das Ausmaß der stimulationsevozierten Veränderung in SpO2 nicht von der bei der Erstimplantation beobachteten, was auf eine hervorragende kontinuierliche Leistung der chronisch implantierten Geräte hindeutet (anfängliche % Veränderung der SpO2 = -9,7 x 3,4 %, endgültige % Veränderung der SpO2 = -15,8 x 6,5 %, Mittelwert sd; p = 0,08, gepaart er t-Test). In den verbleibenden 2 Geräten reichte die Erhöhung der Stimulationsamplitude auf 1,6 mA aus, um eine zuverlässige Reduzierung der SpO2 um mindestens 5 % hervorzurufen, was darauf hindeutet, dass diese Geräte weiterhin funktionierten, dass jedoch Veränderungen der Impedanz, Nervenschäden oder Manschettenausrichtung im Laufe der Zeit zu leistungsverminderter Leistung geführt haben könnten.
Um die Langzeitfunktionalität unserer chronisch implantierten stimulierenden Elektroden weiter zu testen, wurde eine zweite Rattengruppe auf einer vereinfachten Version einer von Hays et al. entwickelten geschickten Greifhebel-Pressaufgabe zur quantitativen Beurteilung der Motorleistung der Vorstufe trainiert25. Mehrere Studien haben gezeigt, dass die Kopplung von VNS mit der richtigen motorischen Leistung bei dieser Aufgabe zur Erweiterung der proximalen Vorderglieddarstellung im primären Motorkortex19,20,21,22führt. In unserer vereinfachten Version der Aufgabe mussten Ratten 2 cm vor dem Trainingsstand erreichen, um einen Hebel vollständig zu drücken und ihn dann innerhalb von 2 s freizugeben, um eine Lebensmittelbelohnung zu erhalten (Abbildung 2D). Die Tiere erhielten zwei 30-Minuten-Trainingseinheiten pro Tag, bis sie stabile Fähigkeiten bei der Aufgabe erreichten (>65% korrekt, >100 Versuche/Sitzung, für mindestens 8/10 aufeinander folgende Sitzungen). Ratten wurden dann operiert, um eine stimulierende Manschettenelektrode um ihren linken Vagusnerv zu implantieren. Nach der Genesung nach der Operation, der Akklimatisierung an stimulierende Kabel und der Rückkehr zur kompetenten Verhaltensleistung erhielten die Ratten weitere 10 Trainingseinheiten, in denen VNS (0,5 s Zug von 0,8 mA, 30 Hz Impulse; 100 s biphasische Pulsbreite) oder Scheinstimulation (keine Stimulation) zum Zeitpunkt der korrekten Hebelfreisetzung abgegeben wurde. Innerhalb von 24 h nach der letzten VNS-gepaarten Trainingseinheit wurden Ratten mit Ketamin/Xylazin (80/10 mg/kg, i.p.) beanstandet, die Manschettenelektrodenfunktion getestet und die kortikale Motorkartierung nach den veröffentlichten Verfahren22durchgeführt. In Übereinstimmung mit früheren Studien, die belegen, dass VNS die Ausweitung aufgabenrelevanter Motorkartendarstellungen antreibt, zeigten VNS-behandelte Ratten (N = 3) in unserer Studie signifikant größere proximale Vorderbeine (PFL) darstellungen als scheinbehandelte Ratten (N = 4)(Abbildung 2D; PFL % der gesamten Kartenfläche, Mittelwert + SEM: Schein = 15,6 x 6,7 %, VNS = 38,3 x 1,0 %; p = 0,035, 2-Probe-t-Test, Prüfleistung = 0,8). Bei allen VNS-behandelten Tieren wurde die Manschettenfunktion nach Induktion der Anästhesie zum Zeitpunkt der Kartierung, 5–10 Wochen nach dem Implantat, validiert, indem eine Mehrung von mehr als 5% an SpO2 als Reaktion auf VNS bestätigt wurde (10 s Zug von 0,8 mA, 30 Hz Impulse; 100 s biphasische Pulsbreite).
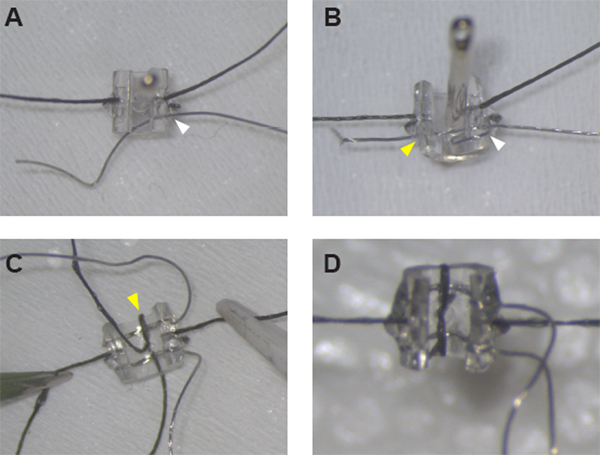
Abbildung 1: Montage der stimulierenden Manschettenelektroden. (A) Nach der Sicherung der Nähte auf beiden Seiten der Manschette kann Pt:Ir Draht durch die Manschettenwand an Loch #1 (weiße Pfeilspitze) mit einer Nähnadel gefädelt werden. (B) Pt:Ir Draht ist richtig gefädelt und bereit für die Entdämmung nach der Erstellung einer Drahtschleife um die Manschettenkante und Gewinde des Drahtes wieder durch Loch #1 (weiße Pfeilspitze) und über die Manschette durch Loch #2 (gelbe Pfeilspitze). (C) Sobald beide Leitungen an Ort und Stelle sind, sichern Sie die erste Leitung durch Einfädeln Der Naht durch das Mittellinienloch und um die Manschettenkante (gelbe Pfeilspitze). (D) Schließen Sie die Schleife um die zweite Leitung mit einem Halben Knoten und Kleber an Ort und Stelle, um Manschettenmontage zu vervollständigen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Gerätenutzung für chronische Vagusnervstimulation bei wach verhaltenden Ratten. (A) Headcap-Baugruppe. (B) Während der Geräteimplantation wurden VNS-evozierte Reduktionen von SpO2 mit anfänglichen SpO2-Werten korreliert (R2 = 0,602, p = 0,008, pearsonline Korrelation). (C) Vergleich von VNS-evozierten SpO2-Tropfen, die bei der Geräteimplantation erhalten wurden, im Vergleich zum Ende von Stimulationsexperimenten 6 Wochen später. Linien zeigen Messpaare für einzelne Ratten an. Die Stimulation in den Paneelen B und C bestand aus einem einzigen 10 s Zug mit 100 s biphasischen Impulsen, die bei 0,8 mA und 30 Hz geliefert wurden. (D) Ratte mit chronisch implantierten VNS-Manschettenelektroden, die die Hebelpresseaufgabe ausführen. (E) VNS (0,5 s Zug von 0,8 mA, 30 Hz, 100 s biphasische Impulse) gepaart mit korrekter Hebelpresseleistung erweiterte die Kartendarstellung der aufgabenrelevanten Muskulatur im Motorkortex. Ratten, die VNS erhielten, gepaart mit korrekter Hebelpresseleistung (N = 3), wiesen einen deutlich größeren Prozentsatz der Motorkartenfläche auf, die der proximalen Vorderbeine (PFL)-Darstellung gewidmet war, verglichen mit Ratten, die Eine Scheinstimulation erhielten (N = 4). Punkte zeigen PFL-Darstellungen für einzelne Themen; Fehlerbalken zeigen SEM an. Die VNS-Behandlung gefolgt von der motorischen kortikalen Kartierung wurde 5–10 Wochen nach der Implantation durchgeführt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Hier beschreiben wir einen einfachen, kostengünstigen Ansatz für die Montage chronisch implantierbarer stimulierender Manschettenelektroden für den Einsatz bei Nagetieren, der präklinische Untersuchungen dieser aufkommenden Therapie erleichtert. Diese vereinfachte Methode erfordert keine spezielle Schulung oder Ausrüstung und verwendet eine kleine Anzahl von Werkzeugen und Zubehör, die für die meisten Forschungslabore leicht zugänglich sind, wodurch sowohl die monetären als auch die Arbeitskosten der Geräteherstellung im Vergleich zu anderen Ansätzen reduziert werden16,26,27,28. Während der gesamten Montage ist Vorsicht geboten, um eine übermäßige Anwendung von UV-Härteklebstoff zu vermeiden und gleichzeitig eine ausreichende mechanische Stabilität der Nähte und Pt:Ir-Leitungen für eine langfristige Manschettenfunktion zu gewährleisten. Übermäßiger Klebstoff erschwert die Implantation des Geräts und kann das umgebende Gewebe nach der Operation reizen, während unzureichender Klebstoff die Wahrscheinlichkeit erhöht, dass die Leitungen im Laufe der Zeit keinen guten Kontakt mit dem Nerv aufrechterhalten, was zu einer verminderten Geräteleistung oder einem Ausfall führt. Eine konsistente Platzierung der entisolierten Pt:Ir-Drähte im Manschettenlumen ist auch entscheidend für die Erreichung niedriger Impedanzen und einer guten Geräteleistung. Es sollte darauf geachtet werden, den entisolationen Draht so auszurichten, dass die maximal mögliche Oberfläche des freiliegenden Drahtes in der Manschette sitzt, während von außen kein freiliegender Draht vorhanden ist.
Wir haben validiert, dass unser Ansatz Manschetten von ähnlicher Größe und Zuverlässigkeit produziert, wie die derzeit in der gemeinsamen Verwendung von mehreren Labors für chronische VNS-Lieferung in Ratten4,5,6,7,8,9,10,11,12,13,,14,15,19,20,21,22. Jüngste Studien deuten darauf hin, dass periphere Nervenfasern in ähnlicher Weise mit einer Vielzahl von Elektrodenkontaktgrößen und -ausrichtungen rekrutiert werden16,29, was darauf hindeutet, dass dieses Protokoll für viele Experimente angepasst werden kann, die eine periphere Nervenstimulation erfordern, und dass kleine Variationen im Bleiabstand oder der Oberfläche, die aus der Montage von Manschetten von Hand entstehen, die meisten experimentellen Ergebnisse nicht entscheidend beeinflussen. Während jeder Stimulationssitzung überwachten wir die Spannung über die Manschettenleitungen mit einem Oszilloskop, um sicherzustellen, dass die Leitungen nicht kurz oder gebrochen wurden, aber wir verfolgten keine Änderungen der Impedanz für bestimmte implantierte Geräte für die Dauer der 5-10 Wochen nach dem Implantat. Eine Studie mit einem ähnlichen implantierten Gerät berichtete, dass die Impedanz in den ersten 4 Wochen nach der chirurgischen Implantation signifikant zunimmt, vermutlich da sich die akute Verletzungstabilisiert 30. In dieser Studie korrelierten jedoch Veränderungen der Geräteimpedanz nicht mit der Geräteleistung über 8 Wochen chronischer Implantation: Die Autoren berichteten keine signifikante Veränderung in der Beziehung zwischen VNS-Intensität und zusammengesetzter Wirkungspotenzial-Amplitude über mehrere Wochen nach der Implantation. Hier konnten wir die Manschettenleistung nach 5–10 Wochen Implantation funktionell validieren, indem (i) überprüft wurden, ob VNS immer noch eine Unterbrechung der Atmung und des Rückgangs der SpO2 im Einklang mit dem Hering-Breuer-Reflex hervorrufen konnte, und (ii) frühere Arbeiten replizieren, die eine VNS-induzierte Motorkartenreorganisation demonstrieren. In unserer eigenen Arbeit haben wir festgestellt, dass die Induktion des Hering-Breuer-Reflexes der zuverlässigste Weg ist, um die langfristige Funktionalität implantierter VNS-Manschetten zu validieren, die aufgrund einer Reihe von Faktoren, die nichts mit der Manschettenmontage zu tun haben, eine geringere Geräteleistung oder einen Ausfall aufweisen können; Dazu gehören chirurgische Komplikationen, Nervenschäden und/oder mechanische Schäden an der Manschette oder Kopfkappe. Hervorragende Operationstechnik und anwendungsspezifische Validierung der Gerätefunktionalität ist entscheidend für den stabilen und erfolgreichen Einsatz chronisch implantierter stimulierender Manschettenelektroden.
Wir haben einen einfachen, kostengünstigen Ansatz für die Montage von peripheren Nervenmanschettenelektroden für die chronische Implantation bei Kleintieren beschrieben und seine Nützlichkeit für die VNS-Bereitstellung bei Verhaltensexperimenten bei Ratten demonstriert. VNS wird zunehmend für eine breite Palette von klinischen Indikationen untersucht, einschließlich entzündlicher Erkrankungen wie rheumatoide Arthritis1,2 und Morbus Crohn,31 sowie neurologische Erkrankungen wie Schlaganfall5,6,,7,8 und PTSD10,11. Diese zugängliche Methode zur Herstellung von stimulierenden Manschettenelektroden sollte die Verwendung präklinischer Nagetiermodelle in einer Vielzahl von translationalen Forschungsstudien über die Mechanismen und die Wirksamkeit von VNS erleichtern. Das Protokoll ist leicht anpassbar und erhöht die Vielseitigkeit des Ansatzes weiter. Beispielsweise können der Durchmesser und/oder die Länge der Polyurethanschläuche modifiziert werden, um chronische Stimulationsexperimente bei anderen Arten oder an anderen peripheren Nervenstellen (z. B. Ischias-, Phrenon- oder Sakralnerven) aufzunehmen. Alternativ könnten Konfigurationen mit zusätzlichen Leitungen die Stimulation an mehreren Stellen entlang des Nervs ermöglichen oder die gleichzeitige Aufzeichnung eines stimulationsbeschworenen zusammengesetzten Wirkungspotenzials aufnehmen.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Die Autoren haben nichts zu verraten.
Acknowledgments
Diese Arbeit wurde von der University of Texas in Dallas und dem UT Board of Regents finanziert. Wir danken Solomon Golding, Bilaal Hassan, Marghi Jani und Ching-Tzu Tseng für die technische Unterstützung.
Materials
| Name | Company | Catalog Number | Comments |
| Biocompatible polyurethane-based polymer tubing, 0.080" OD x 0.040" ID | Braintree Scientific | MRE080 36 FT | |
| Dissecting microscope | AM Scopes | #SM-6T-FRL | |
| Fine Serrated Scissors, straight, 22mm cutting edge | Fine Science Tools | #14058-09 | for cutting Pt/Ir wire and suture thread |
| Forceps, #5 Dumont forceps, straight, 11 cm, 0.1 x 0.06 mm tip | Fine Science Tools | #11626-11 | |
| Forceps, ceramic tipped forceps, 0.3 mm x 30 mm tips | Electron Microscopy Sciences | #78127-71 | |
| Gold Pins, PCB Press Fit Socket | Mill-Max | #1001-0-15-15-30-27-04-0 | or similar small pins for connecting cuff leads to headcap |
| Isobutane lighter | BIC | #LCP21-AST | for de-insulating Pt/Ir wire |
| Micro strip connector with latch, 4-pin | Omnetics | A24002-004 / PS1-04-SS-LT | |
| Pipette tip, 10 uL | VWR | 89079-464 | |
| Platinum-Iridium (90/10%) Wire, 0.001" (diameter) x 9 strands, PTFE insulated | Sigmund Cohn | 10IR9/49T | |
| Razor Blade, Single Edge, Surgical Carbon Steel No.9 | VWR | #55411-050 | for cutting MicroRenathane tubing |
| Sewing needle, ca. 4.0 cm length x 0.7 mm diameter (size 6-7) | Singer | 00276 | Smaller needle for threading Pt/Ir wire |
| Sewing needle, ca. 4.5 cm length x 0.8 mm diameter (size 2-3) | Singer | 00276 | Larger needle for pinning cuff during assembly and for threading suture |
| Small foam board | Juvo+/Amazon | B07C9637SJ | for fabrication platform; our dimensions are ca. 2.5" x 3.5" x 1" (L x W x H) |
| Solder, multicore lead-free, 0.38mm diameter | Loctite/Multicore | #796037 | |
| Soldering station | Weller | WES51 | or similar soldering iron compatible with long conical tips (this part has been discontinued) |
| Soldering tip, long conical, 0.01" / 0.4 mm | Weller | 1UNF8 | |
| Suture, nonabsorbable braided silk ,size 6/0 | Fine Science tools | #18020-60 | |
| UV (405 nm) spot light | Henkel/Loctite | #2182207 | |
| UV Light Cure Adhesive 25 ml | Henkel/Loctite | AA 3106 | or similar biocompatible UV cure adhesive |
| Wire wrapping wire, 30 AWG | Digikey | K396-ND |
References
- Koopman, F. A., et al. Vagus nerve stimulation inhibits cytokine production and attenuates disease severity in rheumatoid arthritis. Proceedings of the National Academy of Sciences of the United States of America. , (2016).
- Levine, Y. A., et al. Neurostimulation of the cholinergic anti-inflammatory pathway ameliorates disease in rat collagen-induced arthritis. PLoS One. , (2014).
- Zhang, Y., et al. Chronic vagus nerve stimulation improves autonomic control and attenuates systemic inflammation and heart failure progression in a canine high-rate pacing model. Circulation: Heart Failure. , (2009).
- Ganzer, P. D., et al. Closed-loop neuromodulation restores network connectivity and motor control after spinal cord injury. Elife. , (2018).
- Hays, S. A., et al. Vagus nerve stimulation during rehabilitative training enhances recovery of forelimb function after ischemic stroke in aged rats. Neurobiology of Aging. , (2016).
- Khodaparast, N., et al. Vagus nerve stimulation delivered during motor rehabilitation improves recovery in a rat model of stroke. Neurorehabilitation and Neural Repair. , (2014).
- Meyers, E. C., et al. Vagus nerve stimulation enhances stable plasticity and generalization of stroke recovery. Stroke. , (2018).
- Hays, S. A., et al. Vagus nerve stimulation during rehabilitative training improves functional recovery after intracerebral hemorrhage. Stroke. , (2014).
- Farrand, A., et al. Vagus nerve stimulation improves locomotion and neuronal populations in a model of Parkinson's disease. Brain Stimulationation. , (2017).
- Souza, R. R., et al. Vagus nerve stimulation reverses the extinction impairments in a model of PTSD with prolonged and repeated trauma. Stress. , (2019).
- Noble, L. J., Souza, R. R., McIntyre, C. K. Vagus nerve stimulation as a tool for enhancing extinction in exposure-based therapies. Psychopharmacology. , (2019).
- Childs, J. E., Kim, S., Driskill, C. M., Hsiu, E., Kroener, S. Vagus nerve stimulation during extinction learning reduces conditioned place preference and context-induced reinstatement of cocaine seeking. Brain Stimulationation. , (2019).
- Peña, D. F., Engineer, N. D., McIntyre, C. K. Rapid remission of conditioned fear expression with extinction training paired with vagus nerve stimulation. Biological Psychiatry. , (2013).
- Childs, J. E., DeLeon, J., Nickel, E., Kroener, S. Vagus nerve stimulation reduces cocaine seeking and alters plasticity in the extinction network. Learning & Memory. , (2017).
- Engineer, C. T., et al. Temporal plasticity in auditory cortex improves neural discrimination of speech sounds. Brain Stimulationation. , (2017).
- Rios, M., et al. Protocol for Construction of Rat Nerve Stimulation Cuff Electrodes. Methods Protoc. , (2019).
- Childs, J. E., et al. Vagus nerve stimulation as a tool to induce plasticity in pathways relevant for extinction learning. Journal of Visualized Experiments. , (2015).
- Paintal, A. S. Vagal sensory receptors and their reflex effects. Physiological reviews. , (1973).
- Porter, B. A., et al. Repeatedly Pairing Vagus Nerve Stimulation with a Movement Reorganizes Primary Motor Cortex. Cerebral Cortex. 22, 2365-2374 (2011).
- Morrison, R. A., et al. Vagus nerve stimulation intensity influences motor cortex plasticity. Brain Stimulationation. , (2018).
- Hulsey, D. R., et al. Norepinephrine and serotonin are required for vagus nerve stimulation directed cortical plasticity. Exp. Neurol. , (2019).
- Hulsey, D. R., et al. Reorganization of Motor Cortex by Vagus Nerve Stimulation Requires Cholinergic Innervation. Brain Stimulation. 9, 174-181 (2016).
- Bouverot, P., Crance, J. P., Dejours, P. Factors influencing the intensity of the breuer-hering inspiration-inhibiting reflex. Respiration Physiology. , (1970).
- Fialova, E., Vizek, M., Palecek, F. Inflation reflex in the rat. Physiologia Bohemoslov. , (1975).
- Hays, S. A., et al. The bradykinesia assessment task: An automated method to measure forelimb speed in rodents. Journal of Neuroscience Methods. , (2013).
- Kim, H., et al. Cuff and sieve electrode (CASE): The combination of neural electrodes for bi-directional peripheral nerve interfacing. Journal of Neuroscience Methods. , (2020).
- González-González, M. A., et al. Thin Film Multi-Electrode Softening Cuffs for Selective Neuromodulation. Scientific Reports. , (2018).
- Thakur, R., Nair, A. R., Jin, A., Fridman, G. Y. Fabrication of a Self-Curling Cuff with a Soft, Ionically Conducting Neural Interface. Proceedings of the Annual International Conference of the IEEE Engineering in Medicine and Biology Society, EMBS. , (2019).
- Bucksot, J., et al. Flat electrode contacts for vagus nerve stimulation. PLoS One. 14, (2019).
- El Tahry, R., et al. Repeated assessment of larynx compound muscle action potentials using a self-sizing cuff electrode around the vagus nerve in experimental rats. Journal of Neuroscience Methods. , (2011).
- Bonaz, B., Sinniger, V., Pellissier, S. Anti-inflammatory properties of the vagus nerve: potential therapeutic implications of vagus nerve stimulation. Journal of Physiology. , (2016).



