Overview
מקור: המעבדה של ד"ר ניל אברמס — מכללת SUNY למדעי הסביבה ויערנות
לכל התגובות הכימיות יש שיעור מסוים המגדיר את ההתקדמות של מגיבים הולכים למוצרים. שיעור זה יכול להיות מושפע טמפרטורה, ריכוז, ואת המאפיינים הפיזיים של המגיבים. התעריף כולל גם את המתווכים ואת מצבי המעבר שנוצרים אך אינם המגיבים ולא המוצר. חוק התעריפים מגדיר את תפקידו של כל מגיב בתגובה וניתן להשתמש בו כדי לעצב מתמטית את הזמן הנדרש לתגובה כדי להמשיך. הצורה הכללית של משוואת קצב מוצגת להלן:
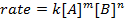
כאשר A ו- B הם ריכוזים של מינים מולקולריים שונים, m ו- n הם סדרי תגובה, ו- k הוא קבוע הקצב. הקצב של כמעט כל תגובה משתנה עם הזמן כאשר המגיבים מתרוקנים, מה שהופך התנגשויות יעילות פחות סביר להתרחש. קבוע הקצב, לעומת זאת, קבוע לכל תגובה בודדת בטמפרטורה נתונה. סדר התגובה ממחיש את מספר המינים המולקולריים המעורבים בתגובה. חשוב מאוד לדעת את חוק התעריפים, כולל קצב קבוע וסדר תגובה, אשר ניתן לקבוע רק באופן ניסיוני. בניסוי זה, נחקור שיטה אחת לקביעת חוק התעריפים ונשתמש בו כדי להבין את התקדמות התגובה הכימית.
Principles
קינטיקה ותרמודינמיקה
כל התגובות הכימיות נשלטות על ידי שני גורמים, קינטיקה ותרמודינמיקה. הגורם התרמודינמי הוא ההבדל באנרגיה חופשית המשתחררת במהלך תגובה כימית. אנרגיה חופשית זו, המכונה ספונטניות, היא ערך מורכב הנובע מהאנטלפיה (חום) והאנטרופיה (הפרעה) בתוך תגובה כימית. קינטיקה מתייחסת לקצב התגובה הכימית וכמה מהר המערכת מגיעה לשיווי משקל. בעוד קינטיקה יכולה להסביר את מהירות התגובה, התרמודינמיקה מניבה מידע על האנרגטיות שלה. במילים פשוטות, התרמודינמיקה מתייחסת ליציבות וקינטיקה מתייחסת לתגובה.
קביעת שיעור
Rate הוא מדידה מבוססת זמן, כלומר הוא משתנה כל הזמן ככל שהתגובה מתקדמת. ניתן לייצג זאת באמצעות חוק שיעור דיפרנציאלי, המבטא את השינוי בריכוז על פני שינוי בזמן. באופן ניסיוני, קשה להשתמש בחוק התעריף הדיפרנציאלי, כך שאנו יכולים להשתמש בחשבון ולייצג את חוק התעריפים כחוק התעריפים המשולב על ידי שילוב חוק התעריף הדיפרנציאלי. חוק התעריף המשולב מייצג את ריכוזי התגובה בתחילת התגובה ובמרווח זמן מוגדר. להלן טבלת סדר, חוק תעריפים וחוק התעריפים המשולבים:

כל סדר מסביר את התלות בריכוז המגיב בשיעור התגובה. לדוגמה, חוק שיעור הזמנה אפסי, rate = k, מציין שהשיעור תלוי רק בקצב הקצב, ולא בריכוז המגיב. זה נפוץ בתגובות קטליטיות שבהן הזרז הוא מוצק ושטח הפנים אינו משתנה במהלך התגובה. חוק שיעור הוראה1 מראה כי השיעור תלוי בריכוז של מגיב אחד, אם כי מגיבים אחרים עשויים להיות נוכחים. חוק שיעור מסדרשני מציין כי השיעור תלוי בריכוז של שני מגיבים בתגובה. מגיבים אלה יכולים להיות זהים, כלומר קצב = k[A]2, או שונה, שיעור = k[A][B]. מכיוון ששני הריכוזים משתנים כל הזמן, קשה למדוד קבועי שיעור מסדר שני במעבדה. ללא קשר לפקודה, שימוש בחוק התעריפים המשולב מפשט את ניתוח הנתונים על-ידי מתן אפשרות להתוויית נתונים והחלת משוואה ליניארית שתתאים לנתונים. מכיוון שרק חוק תעריף משולב אחד יתאים לנתונים, ניתן לזהות באופן מיידי את קצב התגובה ואת סדר התגובה.
ניסוי קינטיקה
קביעת חוק התעריפים מתחילה בהקמת ניסוי קינטיקה לתגובה הכימית. ניסוי קינטיקה נשלט בקפידה כך שהמדידות נעשות במרווחי זמן מתוזמנת על מנת לקבוע את השינוי בריכוז המינים לאורך זמן. מין זה יכול להיות מגיב (הפחתת ריכוז עם הזמן) או מוצר (הגדלת הריכוז עם הזמן). אם מגיבים מרובים מעורבים, חשוב מאוד כי הריכוז של מגיב אחד בלבד משתנה עם הזמן. הגדלת הריכוז של המגיבים האחרים גבוה בהרבה מהמגיב הנחקר גורם לזה להיראות כי הריכוז של מגיב אחד בלבד משתנה במהלך הניסוי.
בניסוי זה, פירוק קטליטי של מי חמצן מעל זרז פלטינה נחקר. מאז הפלטינה היא זרז, רק מין אחד מעורב אשר מתפרק לשני מוצרים על פי התגובה להלן:
2 H2O2(aq) → O2(ז) + 2 H2O(l)
מכיוון שאחד המוצרים, O2, הוא גז, ניתן למדוד את העלייה בלחץ של המערכת לאורך זמן ואת חוק הגז האידיאלי (PV = nRT) המשמש לקשר לחץ מולים. ברגע שזה נעשה עבור כמה ריכוזים שונים של המגיב, ניתן לפתור את סדר התגובה ואת חוק התעריף.
Subscription Required. Please recommend JoVE to your librarian.
Procedure
1. הכנתח' 2ו2 דילולים
- מלאי 3% מי חמצן יש ריכוז של 0.882 M. להכין 5 דילולים הנעים בין 0.882 M ל 0.176 M (טבלה 1). הכן פתרונות אלה באופן נפחי, אבל להכין אותם תוסף מאז solute הוא מאוד לדלל וכמויות מים הם תוסף.
- מניחים את הפתרונות באמבט מים בטמפרטורה קבועה או משאירים אותם על הספסל כדי להתפרק בטמפרטורת החדר. טווח טמפרטורות של 20°C (293-298 K) טוב לתגובה זו.

טבלה 1. נעשה שימוש בפתרונות H2O2.
2. הכנת כלי התגובה
- כדי לקבוע את נפח כלי התגובה, מלא מבחנה גדולה למעלה במים והכנס פקק גומי של חור אחד לתוך המבחנה עד הדוק ומים דוחפים את הצדדים ודרך החלק העליון.
- הסר את פקק ויוצקים את המים לתוך גליל מדורג כדי לקבוע את הנפח המדויק של המים. זהו הנפח הכולל של כלי התגובה (מבחנה).
3. מדידת התפתחות החמצן
- החלף את המים עם 50 מ"ל של פתרון מי חמצן הראשון ולהחזיר אותו לתוך אמבט המים. לאחר שיווי משקל, הוסיפו את דיסק התגובה מצופה הפלטינה וחתמו את המערכת עם פקק המחובר לחיישן לחץ גז. דיסקים אלה משמשים בדרך כלל במערכות ניקוי עדשות מגע.
- לאחר חיישן הלחץ מוגדר כדי להשיג נתונים ב 2 נקודות / s, להפעיל את הניסוי עבור 120 s. חיישן לחץ הגז ורנייה, GPS-BTA, מומלץ לניסוי זה.
- בועות יש לראות כמו מי חמצן הוא נרקב גז חמצן ומים. שחררו את הלחץ, נפטרו מהתמיסה, שטפו והחליפו את הפתרון בתמיסת מי חמצן הבאה. חזור על מדידת לחץ הגז עד לבדיקת כל הפתרונות.
4. ניתוח נתונים
- העבר את כל קבצי הנתונים של לחץ לעומת זמן לתוכנית גיליון אלקטרוני.
- קביעת שיעורים ראשוניים - להניח כי הריכוז של מי חמצן לא השתנה הרבה במהלך מסגרת הזמן הקצרה של הניסוי. הנתונים מייצגים את האזור הליניארי הראשוני של ניסוי הקינטיקה.
- קבע שיפוע על-ידי התוויית לחץ לעומת זמן ושימוש בנוסחת שיפוע או רגרסיה ליניארית. שרטט את הלחץ בכל יחידה משותפת.
- השיפוע הוא הקצב ההתחלתי ביחידות לחץO2/s.
- קביעת סדר תגובה
- מכיוון שלחץ של O2 מפותח הוא פרופורציונלי ישירות לשומות של H 2 O2מפורק, התוויית ה- ln (שיעור התחלתי)לעומת ln[H2O2]0 מניבה שיפוע שווה ערך לסדר התגובה. הריכוז הראשוני של מי חמצן, [H2O2]0, הוא מה שהיה בשימוש בכל אחד הניסויים.
- המשוואה לחוק התעריפים היא
 . לקיחת הלוגריתם הטבעי (ln) של המשוואה מייצרת משוואה ליניארית
. לקיחת הלוגריתם הטבעי (ln) של המשוואה מייצרת משוואה ליניארית  , כאשר m, השיפוע, הוא סדר התגובה.
, כאשר m, השיפוע, הוא סדר התגובה.
- המשוואה לחוק התעריפים היא
- מכיוון שלחץ של O2 מפותח הוא פרופורציונלי ישירות לשומות של H 2 O2מפורק, התוויית ה- ln (שיעור התחלתי)לעומת ln[H2O2]0 מניבה שיפוע שווה ערך לסדר התגובה. הריכוז הראשוני של מי חמצן, [H2O2]0, הוא מה שהיה בשימוש בכל אחד הניסויים.
- קביעת קבוע הקצב, k
- עבור כל גירסת ניסיון, המר את התעריף, PO2/s, ליחידות של atm/s אם התעריף נמצא ביחידה אחרת כגון טור/s.
- מכיוון שבועות התפתחו בתמיסה מימית, הפחיתו את לחץ האדים של המים מלחץ המערכת לכל ניסוי. השיעור החדש משקף רק את הלחץ עקב התפתחות החמצן.
- החל את חוק הגז האידיאלי כדי להמיר את התעריף מ- atm/s לשומות/s בכל ניסוי.
- סידור מחדש של PV = nRT ל- n = PV/RT. יחידתה-אס-1 נותרה ללא שינוי. הנפח שווה לנפח המבחנה פחות נפח הפתרון (50 מ"ל).
- השתמש בתגובה הכימית המאוזנת כדי להמיר מפני מולים של חמצן המיוצר מולים של מי חמצן נרקבים בכל ניסוי.
- חלקו את השומות של H2O2 בנפח התמיסה, 0.050 ליטר, כדי להניב את הטוחנת של H2O2 מפורקת לשניה, [H2O2]/s.
- מכיוון שניסוי זה עוקב אחר קינטיקה מסדר ראשון, חלק את הקצב, [H2O2]/s, לפי ריכוז הפתרון המקורי עבור כל ניסוי, [H2O2]0, כדי להניב קבוע קצב, k. פתרון זה עבור קבוע הקצב ישתנה מעט בהתאם לסדר התגובה שנקבעה בעבר.
- ממוצע קבועי הקצב עבור כל ניסוי יחד מאז הטמפרטורה היא קבועה.
לכל התגובות הכימיות יש קצב מסוים, המגדיר באיזו מהירות המגיבים הופכים למוצרים.
תגובות כימיות נשלטות על ידי שני גורמים: קינטיקה ותרמודינמיקה. גורמים תרמודינמיים מסבירים אם תתרחש תגובה או לא, ואם היא סופגת או פולמת אנרגיה במהלך התהליך.
הקינטיקה מתייחסת לקצב התגובה הכימית, וכמה מהר המערכת מגיעה לשיווי משקל. הקינטיקה של תגובה מתוארת על ידי חוק הקצב הקינטי, המגדיר את הקצב בהתבסס על קבוע קצב תגובה, ריכוז הרכיבים וסדר התגובה.
סרטון זה יציג קינטיקה של תגובה באמצעות משוואת חוק התעריפים, וידגים כיצד לקבוע את חוק התעריף לתגובה מסוימת במעבדה.
עבור תגובה כללית, שיעור התגובה שווה לקצב הקבוע כפול ריכוזי המגיבים, כל אחד מהם הועלה לסדר תגובה. קבוע הקצב, k, קבוע לתגובה בטמפרטורה נתונה.
סדרי התגובה אינם תלויים בקדם הסטויצ'יומטרי. במקום זאת הם תלויים במנגנון התגובה, וממחישים כיצד השיעור קשור לריכוז המגיבים. לדוגמה, אם קצב התגובה אינו משתנה כאשר הריכוז של "A" מכפיל, התגובה אינה תלויה בריכוז, והסדר הוא אפס.
אם השיעור מוכפל כאשר הריכוז של מגיב "A" מכפיל, אז התגובה היא סדר ראשון ביחס "A". אותה התנהגות נכונה לגבי מגיב "B". הסדר הכולל של תגובה הוא סכום הזמנות התגובה הבודדות עבור כל מגיב.
במהלך תגובה, ריכוז המגיבים משתנה עם הזמן. שים לב שמשוואת הקצב הבסיסית אינה כוללת זמן כמשתנה, ויכולה לקשר רק קצב וריכוז בנקודת זמן ספציפית. עם זאת, הקצב משתנה ככל שהתגובה מתקדמת וככל שהמגיבים מתרוקנים. שימוש בחוק שיעור דיפרנציאלי יכול לקשר את השינוי בריכוז לזמן.
חוק התעריפים לתגובה חייב להיקבע באופן ניסיוני, כאשר תגובה כימית נשלטת בקפידה בטמפרטורה קבועה, וריכוז המגיבים או המוצרים הנמדדים במרווחי זמן ספציפיים. מאחר שמדידות ריכוז נעשות בנקודות זמן נפרדות, קשה לתאם את חוק השיעור הדיפרנציאלי לנתונים ניסיוניים.
שילוב חוק התעריפים הדיפרנציאליים מביא למשוואה פשוטה יותר, הנקראת חוק התעריפים המשולבים. חוק התעריפים המשולב משווה את ריכוזי המגיבים בתחילת התגובה ובזמן שצוין.
משוואת חוק התעריף המשולב משתנה בהתאם לסדר התגובה. משוואות אלה יכולות ללבוש את הצורה הליניארית y=mx+b. לפיכך, חלקת ריכוז לעומת זמן מניבה התוויה ליניארית למשוואת סדר אפס, התוויה של יומן הריכוז הטבעי לעומת הזמן מניבה התוויה ליניארית למשוואת סדר ראשון, וכן הלאה. על ידי התאמת נתונים ניסיוניים למשוואות אלה, ניתן לקבוע בקלות את סדר התגובה. לאחר מכן ניתן לקבוע את קבוע הקצב, k, באמצעות השיפוע של הקו. לבסוף, היחידות של k משתנות בהתאם לסדר התגובה. עבור תגובת סדר אפס, היחידות הן מולים לליטר לשנייה, עבור תגובת הזמנה ראשונה, היחידות הן שניות הפוכות ולתגובת סדר שני היחידות הן ליטר למטרה לשנייה.
כעת, לאחר שהוסברו יסודות חוקי התעריפים הקינטיים, בואו נבחן כיצד לקבוע באופן ניסיוני את חוק התעריפים לפירוק מי חמצן למים וחמצן.
בניסוי זה, פירוק קטליטי של מי חמצן מעל זרז פלטינה נחקר.
ראשית, להכין 5 דילול של מי חמצן, כפי שמוצג בטבלה. במקרה זה, הריכוזים נעים בין 0.882 - 0.176 M, באמצעות פתרון מניה 3% או 0.882 M. אפשר לפתרונות להתכווות לטמפרטורת החדר.
לאחר מכן, להכין את כלי התגובה באמצעות מבחנה. ראשית לקבוע את הנפח על ידי מילוי מבחנה גדולה למעלה עם מים. לאחר מכן, הכנס פקק גומי 1 חור עד שהוא הדוק ומים דוחפים מתוך החור דרך החלק העליון.
הסר את פקק, ויוצקים את המים לתוך גליל מדורג כדי למדוד את הנפח המדויק. זהו הנפח של כלי התגובה.
לאחר מכן, לשפוך 50 מ"ל של פתרון מי חמצן הראשון לתוך המבחנה, ולאחר מכן למקם את הצינור באמבט מים 25 °C.C. לאחר השתוות, הוסיפו דיסק תגובה מצופה פלטינה וחתמו את המערכת באמצעות פקק המחובר לחיישן לחץ גז.
מאז אחד המוצרים הוא גז חמצן, הגברת הלחץ במערכת משמשת למדידת הגידול בחמצן. הגדר את חיישן הלחץ כדי להשיג נתונים במהירות של 2 נקודות לשנייה, ולאחר מכן הפעל את הניסוי במשך 120 s. בועות צריך להיות גלוי כמו מי חמצן מתפרק גז חמצן ומים.
כאשר תקופת התגובה נגמרת, לשחרר את הלחץ ולהיפטר פתרון מי חמצן. לשטוף את הצינור, ולאחר מכן למלא את הצינור עם פתרון מי חמצן הבא. חזור על מדידת לחץ הגז עבור כל הפתרונות.
התווה את נתוני הלחץ לעומת הזמן עבור כל פתרון. הלחץ של חמצן מפותח הוא פרופורציונלי ישירות מולים של חמצן שנוצר על פי חוק הגז האידיאלי. בעקבות התגובה הכימית, ניתן להשתמש במולים של חמצן שנוצר כדי לחשב את המולים של מי חמצן מפורק. ראשית, נניח שריכוז מי חמצן לא השתנה באופן משמעותי במהלך התקופה הקצרה של הניסוי. לפיכך, הנתונים המותווים מייצגים רק את האזור הראשוני של ניסוי הקינטיקה.
קבע את השיפוע של כל ערכת נתונים באמצעות רגרסיה ליניארית. השיפוע שווה לקצב התגובה ההתחלתי ביחידות לחץ של חמצן לשנייה.
לאחר מכן, התוויית היומן הטבעי של קצב התגובה הראשוני לעומת הלוג הטבעי של ריכוז מי חמצן ראשוני. השיפוע שווה לסדר התגובה, m, והוא שווה בערך לאחד. לכן, התגובה היא סדר ראשון.
השיעור עבור כל ניסוי הוא ביחידות של לחץ בטור, לשנייה. כדי לקבוע את קבוע הקצב, המר תחילה את התעריף ליחידות של אטמוספרות לשניה. מכיוון שהבועות התפתחו בתמיסה מימית, הפחיתו את לחץ האדים של המים מלחץ המערכת לכל ניסוי. הקצב החדש משקף את הלחץ רק עקב התפתחות החמצן.
החל את חוק הגז האידיאלי כדי להמיר את התעריף מאטמוספירות כשלעצמו לשומות לשנייה עבור כל ניסוי. פי שניים מולים של חמצן המיוצרים שווים מולים של מי חמצן נרקבים, על פי סטויצ'ומטריה התגובה הכימית. לאחר מכן, השתמש באמצעי האחסון של התגובה כדי להמיר את יחידות התעריף לאונח לשנייה.
קבע את קבועי הקצב עבור כל ניסוי על-ידי חלוקת קצב הטחינה לכל s לפי הריכוז הראשוני. בניסוי זה, קבוע הקצב הממוצע, k, הוא כ 1.48 x 10-4 לשנייה. התגובה היא סדר ראשון, הידוע מן היומן הטבעי - עלילת בול עץ טבעי שהוצג קודם לכן. לכן, ניתן לכתוב את חוק התעריף כפי שמוצג.
עכשיו כשבדקתם איך לקבוע את חוק התעריף לתגובה כימית, בואו נסתכל על אזורים מסוימים שבהם המושג הזה מיושם.
תגובות כימיות משמשות בסינתזה של תרכובות וחומרים המשמשים במגוון רחב של יישומים מדעיים. חשוב להבין את קצב התגובה בשלבי סינתזה אלה, על מנת לשלוט בהתקדמות התגובה.
לדוגמה, הסינתזה של ננו-קריסטלים קדמיום סלניד וננורודים ממשיכה דרך סדרה של תגובות כימיות. לכל תגובה יש שיעור תגובה נפרד משלה, ולכן שלב הסינתזה נשלט בקפידה על סמך מהירות הידע של התגובה; חלקם איטיים וחלקם מהירים מאוד.
חוק קצב התגובה יכול לשמש גם לתיאור ריקבון רדיואקטיבי, ולקבוע את מחצית החיים של חומר רדיואקטיבי. מחצית החיים מתייחסת לכמות הזמן הנדרשת לריכוז החומר לרדת למחצית הריכוז הראשוני שלו.
רדיואקטיביות עוקבת אחר קינטיקה מסדר ראשון, כלומר הזמן הנדרש לחומר רדיואקטיבי כדי להתפורר לרמה בטוחה יכול להיות מאופיין היטב, ומאפשר הובלה ואחסון נאותים של חומר רדיואקטיבי ופסולת רדיואקטיבית.
בדומה לחומרים רדיואקטיביים, לסמים יש גם מחצית חיים והם מתפרקים בגוף. לדוגמה, תרופות מסוימות יש קבועים שיעור גבוה, כלומר הם להתפרק במהירות, ויש לקחת לעתים קרובות. ידע על שיעור השפלה זה מאפשר קביעת המינון המתאים, השימוש ושיטת המסירה.
הרגע צפית בהקדמה של ג'וב לשיעורי תגובה. עכשיו אתה צריך להבין את הסדרים השונים של תגובות כימיות, איך הם מתייחסים לשיעורי תגובה כימית, וכיצד לקבוע את חוק התעריף לתגובה כימית נתונה במעבדה.
תודה שצפיתם!
Subscription Required. Please recommend JoVE to your librarian.
Results
נתוני התפתחות חמצן ושיעורים התחלתיים

איור 1. לחץ לעומת נתוני זמן עבור כל ניסוי בטמפרטורה קבועה. השיפוע שווה לקצב המיידי של התגובה.
סדר תגובה
- נתונים עבור חמישה ניסויים וגרף עם שיפוע מפורטים להלן (טבלה 2, איור 2). השיפוע של 0.9353 ≈ 1, הוא ערך שלם של סדר התגובה.

טבלה 2. תוצאות 5 H2O2 ניסויים.

איור 2. חלקת יומן טבעית של ריכוז לעומת שיעור. השיפוע שווה ערך לסדר התגובה.
קצב קבוע, k
- חשב את הקצב מול O2/s באמצעות חוק הגז האידיאלי על ידי תחילה הפחתה של לחץ האדים של מים ב 294 K (הטמפרטורה של ניסוי הקינטיקה), 18.7 טור.
- חשב את קבוע הקצב על-ידי חלוקת הקצב, [H2O2]/s לפי הריכוז ההתחלתי של [H2O2]0.

טבלה 3. חישוב קבוע הקצב, k.
- קבוע הקצב הממוצע, 2.25 x 10-4 s-1 מציין שהתגובה היא הזמנה ראשונה המבוססת על היחידות. ניתן לשכתב את חוק התעריף כ: שיעור = 2.25 x 10-4 s-1[H2O2]0
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
בעוד שקביעת משתני חוק שיעור יכולה להיות מעורבת מתמטית, השיטות הן למעשה די פשוטות. כל עוד ניתן למדוד את היעלמותו של מגיב או מראה של מוצר, ניתן להשתמש בחלקות שיעור כדי לחשב את קבוע הקצב. הרחבה של שיטה זו משמשת לעתים קרובות כדי לקבוע את אנרגיית ההפעלה של תגובה, Ea, על ידי מדידת הקצב וחישוב קבוע הקצב במגוון טמפרטורות. שיטה זו כוללת שימוש במשוואת ארניוס, k = Ae(-Ea/RT). שילוב חוק הקצב, כולל סדר תגובה, עם אנרגיית ההפעלה של תגובה מספק פרופיל קינטי מלא למהירות (או איטית) תגובה מתקדמת ומספק מידע מהעולם האמיתי על האופן שבו גורמים כמו טמפרטורה וריכוז יכולים להשפיע על תגובה זו.
קינטיקה כימית מוצאת יישומים בתעשיות ובתחומים מגוונים כמו תרופות, בטיחות גרעינית, תיקון סביבתי, מסנני קרינה. לדוגמה, תרופה מסוימת עשויה להיות קבועה בקצב גדול מאוד, כלומר היא נרקבת מהר מאוד בגוף. הדבר משפיע על שיטת השימוש, המנונים והמסירה. ביחס למדע הגרעין, רדיואקטיביות עוקבת אחר קינטיקה מסדר ראשון, כלומר הזמן הנדרש לחומר גרעיני כדי להירקב לרמה בטוחה מאופיין היטב. מדידות יהיו דומות מאוד לשיטה המוצגת כאן ויכולות להיות מיושמות גם על ריקבון של מזהמים סביבתיים רבים. באופן דומה, מסנני קרינה גם לדעיכה עם פרופילים קינטיים ידועים המאפשרים ליצרנים ליידע את הצרכנים כמה מהר קרם הגנה צריך להיות מיושם כדי לשמור על רמות בטוחות.
Subscription Required. Please recommend JoVE to your librarian.
References
- Method adapted from Vetter, T. A., Colombo, D. P. Jr. Kinetics of Platinum-Catalyzed Decomposition of Hydrogen Peroxide, J. Chem. Ed. 80 (7), 788-798 (2003).
- David R. Lide, ed. CRC Handbook of Chemistry and Physics. Boca Raton, Florida: CRC Press (2005).





 . לקיחת הלוגריתם הטבעי (ln) של המשוואה מייצרת משוואה ליניארית
. לקיחת הלוגריתם הטבעי (ln) של המשוואה מייצרת משוואה ליניארית  , כאשר m, השיפוע, הוא סדר התגובה.
, כאשר m, השיפוע, הוא סדר התגובה.