FIM Imaging and FIMtrack: Two New Tools Allowing High-throughput and Cost Effective Locomotion Analysis
Summary
FIM is a novel, cost effective imaging system designed to track small moving objects such as C. elegans, planaria or Drosophila larvae. The accompanying FIMTrack program is designed to deliver fast and efficient data analysis. Together, these tools allow high-throughput analysis of behavioral traits.
Abstract
The analysis of neuronal network function requires a reliable measurement of behavioral traits. Since the behavior of freely moving animals is variable to a certain degree, many animals have to be analyzed, to obtain statistically significant data. This in turn requires a computer assisted automated quantification of locomotion patterns. To obtain high contrast images of almost translucent and small moving objects, a novel imaging technique based on frustrated total internal reflection called FIM was developed. In this setup, animals are only illuminated with infrared light at the very specific position of contact with the underlying crawling surface. This methodology results in very high contrast images. Subsequently, these high contrast images are processed using established contour tracking algorithms. Based on this, we developed the FIMTrack software, which serves to extract a number of features needed to quantitatively describe a large variety of locomotion characteristics. During the development of this software package, we focused our efforts on an open source architecture allowing the easy addition of further modules. The program operates platform independent and is accompanied by an intuitive GUI guiding the user through data analysis. All locomotion parameter values are given in form of csv files allowing further data analyses. In addition, a Results Viewer integrated into the tracking software provides the opportunity to interactively review and adjust the output, as might be needed during stimulus integration. The power of FIM and FIMTrack is demonstrated by studying the locomotion of Drosophila larvae.
Introduction
Most animals have the ability to move in a highly sophisticated and controlled manner. To decipher the genetic basis underlying locomotion control it is mandatory to quantitatively assess different behavioral patterns. In this respect, Drosophila can serve as an ideal model. Tracking of freely flying Drosophila is tantalizing 1-4 but crawling of Drosophila larvae occurs in two dimensions at relatively low speed and can thus be monitored easily. Camera-based setups combined with appropriate illumination are used to acquire images 5. Both incident or transmitted light is employed in behavioral experiments 6,7. However, due to the semi-translucent body of the larvae and possible light reflections of the crawling surface faithful recording of larval movements can be challenging. To overcome such problems, some complex methods have been devised. Recently, dark field illumination was introduced to enhance the foreground/background contrast 8. As an alternative to camera-based recording, lens-less optical imaging and image-sensor-less on-chip acquisition techniques have been introduced 9-11.
Several tracking programs have been introduced recently, including commercially available software 12 and custom solutions. Examples for high-throughput tracking programs are the Multi Worm Tracker (MWT) 13 and Multianimal Gait And Track (MAGAT) 8. Both have in common, that multiple animals can be tracked in a single open-field arena so that colliding animals lead to multiple new animal identities. To overcome this limitation, a multi-well setup was introduced separating 12 animals into individual wells 14. Precise quantification of locomotion of single individuals can be achieved by using a movable tracking stage in combination with a microscope 15. However, all these approaches are either cost inefficient, lack sufficient resolution or too time consuming for high throughput phenotyping.
To overcome the above mentioned limitations, we have developed FIM (FTIR-based Imaging Method) based on Frustrated Total Internal Reflection (FTIR) 16 (Figure 1). This new imaging approach provides an unprecedented high contrast and even allows multi-color recording of crawling animals 16. The underlying principle of this handy and effective method is easy. An acrylic glass plate is flooded with light (e.g., 875 nm infrared). Due to different refractive indices of acrylic glass and air, the light is totally reflected at the glass/air boundary. No heating of the acrylic glass is noted 16. Only if objects with a higher refractive index touch the light-flooded table, can light enter these objects. If the animals touch the surface, light is reflected and can be captured from below (Figure 1). In consequence, only the contact area of the animals appears as a bright spot, which allows detailed imaging with an overall black background. Thus, FIM-imaging allows to record perfect movies for computer vision algorithms. The simple and robust use of FIM now brings detailed high throughput analysis of complex animal behavior into reach and can be used for studying information processing: e.g., olfaction 8, 16; vision 17 or thermosensation 18.
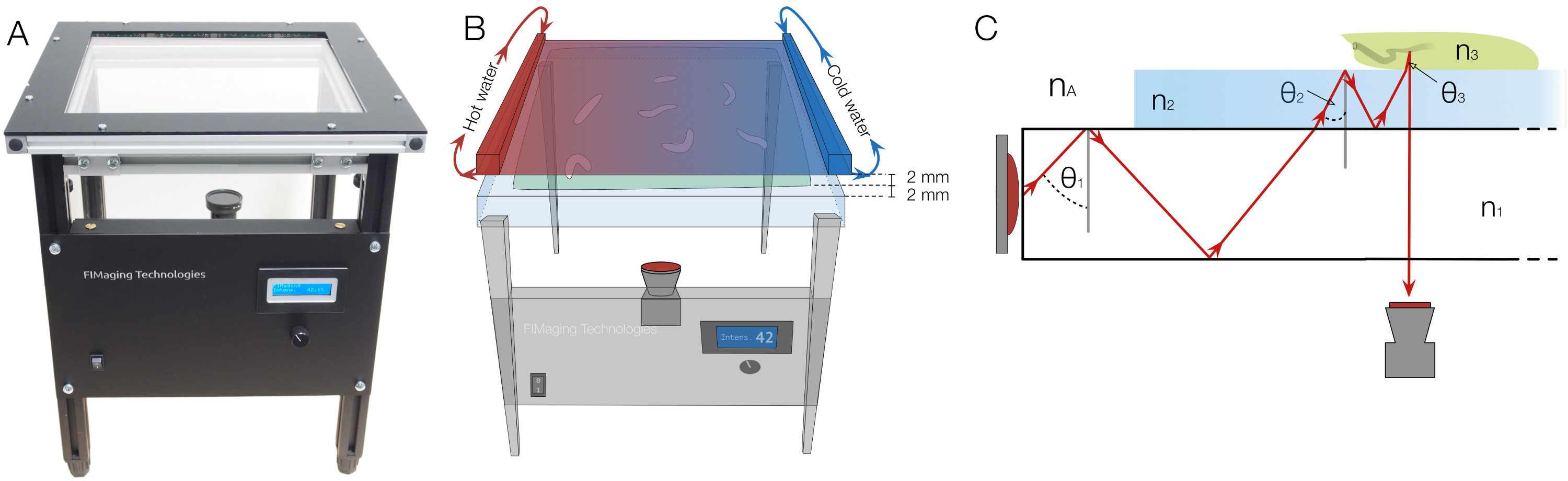
Figure 1. FIM setup with heat-stimulus integration and underlying physical principles. (A) The FIM setup. Illumination intensity can be regulated at front panel. (B) To deliver a heat stimulus, a black painted aluminum plate, perfused with hot and cold water at both sides, is placed 2 mm above the agar surface which itself is 2 mm thick. The gradient is established on the heat radiator plate and the agar by the temperature differences. (C) The physical principle of frustrated total internal reflection: An acrylic glass plate is illuminated by infrared light. θ1, θ2, and θ3 indicate the light reflection angles. nA, n1, n2 and n3 denote the refractive indices of air, acrylic glass, agar and the larva respectively and fulfill the inequality nA <n1 <n2 <n3. Due to refraction, the reflection angle changes during transition. If the angle is below the critical angle, light is not reflected anymore, can pass through the layers and can be captured from below. Please click here to view a larger version of this figure.
The spectrum of processes that can be analyzed by FIM is broad. Without any further adjustments, FIM imaging can be used to monitor all larval stages of Drosophila (Figure 5B) or can be used to follow the foot-prints of adult Drosophila 19. Likewise, the trajectories of C. elegans or the movement of planarian flatworms can be easily recorded (Figure 5C). Even the analysis of fungal hypha or root hair growth appears feasible 19. In our current FIM setup, 4 x 16 infrared light emitting diodes (IR- LEDs) are integrated into a 32 x 32 cm2 acrylic glass plate, called the tracking table (Figure 1). The intensity of the IR-LEDs is adjusted depending on the weight of the objects on the tracking table, which can be easily done by a micro controller connected to the circuit via pulse-width modulation (PWM). FIM yields very high contrast images over a broad range of illumination intensities. Importantly, it generates excellent results at already low overall infrared irridation.
A camera with an infrared filter is placed below the tracking table, which allows integration of additional stimuli into the setup. Heat stimuli can be easily applied by a heat radiator plate and light stimuli are applied by an LCD projector. Also odorants can be contained in gradients by simple lids 8. For heat gradient experiments, the heat radiator plate is perfused with hot and cold water on both sides respectively and placed 2 mm above the larvae (Figure 1B).
The generation of high contrast, high quality movies opens the possibility for sophisticated computer based image analysis, thus we implemented the FIMTrack software to extract a large set of features from images (Figure 2). First six primary features were defined from the contour of the animal (Figure 3A). These features provide the baseline for further calculation of six secondary features which describe the animals shape and its position at certain stimuli at a given time point (Figure 3B). Currently, nine tertiary features are calculated that are integrating temporal aspects and thus characterize the locomotion of the animal together with the primary and secondary features (Figure 3C).
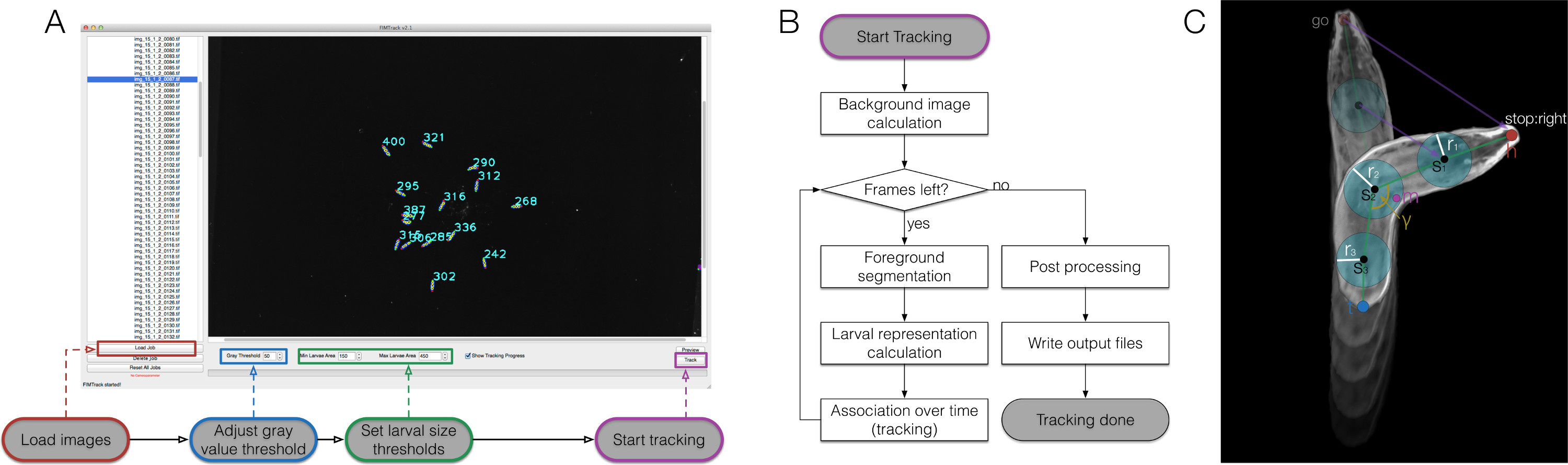
Figure 2. FIMTrack overview, algorithmic workflow and larval representation. (A) How to use FIMTrack. The images are loaded. Gray value threshold and larval size thresholds defining single larvae must be set. The larval area must be in [min-size, max-size]. Tracking is started by the highlighted button. (B) Tracking workflow. After the start button is clicked, the background image is calculated (minimal intensities over time). As long as there are frames left, the larvae are segmented based on the gray threshold and the min- and max-size threshold. For all segmentations the larval representations are calculated (compare to (C)). Each new model is associated to a given trajectory if a valid track is available. If the last frame is reached, finalizing post processing is done followed by the output generation. (C) Larval representation. The animal consists of a head and a tail point (h and t). Between these points an arbitrary odd number of spine points si can be set with a radius ri. In addition, the center of mass m and the main body bending angle γ are calculated. Several motion related parameters are sketched by purple lines. Please click here to view a larger version of this figure.

Figure 3. Features calculated by FIMTrack. (A) Primary features based on the contour of the animals. (B) Secondary features, based on primary features. (C) Tertiary features, based on primary features in consecutive frames and additional inputs Please click here to view a larger version of this figure.
Protocol
Representative Results
Discussion
In behavioral neuroscience it is mandatory to quantitatively decipher complex behavioral traits. Thus, large numbers of individuals must be observed at high resolution and automated procedures are needed for statistical analysis. Here, FIM imaging is described, a novel, simple and robust imaging setup, which provides the means to monitor locomotion of a wide range of animals. The efficacy of the FIM imaging setup was tested using Drosophila larvae, planarian flatworms and C. elegans worms. The FIM technology provides intrinsically high contrast to detect even internal structures of the animals, such as the brain, trachea, the gut or the proventriculus. Importantly, these internal structures are robustly identified so that they can serve to automatically identify the orientation of the animal19.
The quality of the movies can be influenced by excessive amount of water on the crawling surface. Thus, it is critical to control the moisture of the agar. Too old agar or too much water on the surface can cause artifacts. Likewise, ensure that no air bubbles are included in the crawling surface. In general, a well-prepared agar surface allows recording movies for 4 hr.
Due to the underlying physical principles FIM imaging generates almost noise free image recordings, resulting in a superb image quality. This in turn facilitates subsequent computer-based image analysis and enables high throughput. However, the methodology is restricted to analyzing animals that directly contact the agar surface. The tracking software is challenged by animals forming a donut shape. Although a binary indicator recognizes the donut shape, a wrong spine might be calculated.
Due to the modular construction of the tracking table dual and triple color imaging is in reach. Moreover, additional stimuli (light, odorants, electrical or mechanical stimuli) can easily be delivered from above. The FIMTrack program designed to match the power of FIM imaging can be easily adopted to track Drosophila larvae, C. elegans or planarians. Thus and due to its straightforward and cheap construction (see http://FIM.uni-muenster.de), FIM imaging is feasible for a wide range of biomedical applications and in particular allows urgently needed high throughput studies.
Offenlegungen
The authors have nothing to disclose.
Acknowledgements
We are thankful to S. Thomas who has initiated this project, J. Hermann and U. Burgbacher for help in the construction of the FIM setup. This work was funded by the DFG (SFB 629 B6).
Materials
| Name of the Material/Equipment | Source | Catalog Number | Comments |
| FIM setup | Custom | details for construction or purchase of setups is available upon request | |
| Acrylic glass plate | Custom | Additional for agar pouring | |
| Heat radiator plate | Custom | Aluminum plate (paintet in matt black) perfusable on opposing sites with adjustable mounting | |
| Water calorifier/cooling pumps and hoses | Custom | based on GE healthcare MultiTempIII (No.: 18-1102-78) and Dr Bruno Lange GmBH (Typ: LTG013) | |
| Standard Camera (4 MP) | Basler | acA2040-25gm | Camera defaultly used for the FIM setup |
| Test Camera (1.4 MP) | QImaging | 1394 firewire (01- QIC-F-M-12 MONO) | Camera used for comparison |
| Test Camera (0.8 MP) | Point Grey | Dragonfly 2 (DR2-13S2M/C-CS) | Camera used for comparison |
| Test Camera (0.3 MP) | Sony | PS Eye USB2.0 camera | Camera used for comparison |
| Computer | Custom | equipped with at least i5 Intel processor or better, 16 GB RAM and sufficient HDD storage space [>1TB] | |
| Standard Fly food | Custom | ||
| Standard Fly vials 135 ml | Sarstedt AG&Co, Nümbrecht, Germany | 78,895 | |
| Petri dishes 9cm | Sarstedt AG&Co, Nümbrecht, Germany | 821,473 | |
| Ultrapure deionized water | Merck Millipore, Darmstadt, Germany | Synergy | |
| NaCl | Carl Roth GmbH, Karlsruhe, Germany | 3957.2 | |
| Food grade agar | AppliChem GmbH, Darmstadt, Germany | A0917,5000 | |
| Paintbrush (small and large) | Milan | Aquarell 310 Size 0 and 2 | |
| Pyrometer | Trotec | BP20 |
Referenzen
- Maimon, G., Straw, A. D., Dickinson, M. H. A Simple Vision-Based Algorithm for Decision Making in Flying Drosophila. Current Biology. 18 (6), 464-470 (2008).
- Frye, M. A., Dickinson, M. H. Closing the loop between neurobiology and flight behavior in Drosophila. Current opinion in neurobiology. 14 (6), 729-736 (2004).
- Fry, S. N. The Aerodynamics of Free-Flight Maneuvers in Drosophila. Science. 300 (5618), 495-498 (2003).
- Risse, B., Berh, D., Tao, J., Jiang, X., Klette, R., Klämbt, C. Comparison of two 3D tracking paradigms for freely flying insects. EURASIP Journal on Image and Video Processing. 2013 (1), 57 (2013).
- Yilmaz, A., Javed, O., Shah, M. Object tracking: A Survey. ACM Computing Surveys. 38 (4), (2006).
- Pistori, H., et al. Mice and larvae tracking using a particle filter with an auto-adjustable observation model. Pattern Recognition Letters. 31 (4), 337-346 (2010).
- Ramot, D., Johnson, B. E., Berry, T. L., Carnell, L., Goodman, M. B. The Parallel Worm Tracker: a platform for measuring average speed and drug-induced paralysis in nematodes. PloS one. 3 (5), e2208 (2008).
- Gershow, M., et al. Controlling airborne cues to study small animal navigation. Nature Methods. 9 (3), 290-296 (2012).
- Cui, X., et al. Lensless high-resolution on-chip optofluidic microscopes for Caenorhabditis elegans and cell imaging. Proceedings of the National Academy of Sciences of the United States of America. 105 (31), 10670-10675 (2008).
- Heng, X., et al. Optofluidic Microscopy – a Method for Implementing a High Resolution Optical Microscope on a Chip. Lab on a chip. 6 (10), 1274-1276 (2006).
- Liu, P., Martin, R. J., Dong, L. Micro-electro-fluidic grids for nematodes: a lens-less, image-sensor-less approach for on-chip tracking of nematode locomotion. Lab on a chip. 13 (4), 650-661 (2013).
- Spink, A. J., Tegelenbosch, R. A., Buma, M. O., Noldus, L. P. The EthoVision video tracking system–a tool for behavioral phenotyping of transgenic mice. Physiology. 73 (5), 731-744 (2001).
- Swierczek, N. A., Giles, A. C., Rankin, C. H., Kerr, R. A. High-throughput behavioral analysis in C. elegans. Nature methods. 8 (7), 592-598 (2011).
- Yu, C. -. C. J., Raizen, D. M., Fang-Yen, C. Multi-well imaging of development and behavior in Caenorhabditis elegans. Journal of neuroscience methods. 223, 35-39 (2014).
- Wang, S. J., Wang, Z. -. W. Track-A-Worm, An Open-Source System for Quantitative Assessment of C. elegans Locomotory and Bending Behavior. PloS one. 8 (7), e69653 (2013).
- Gomez-Marin, A., Stephens, G. J., Louis, M. Active sampling and decision making in Drosophila chemotaxis. Nature communications. 2, 441 (2011).
- Kane, E. A., et al. Sensorimotor structure of Drosophila larva phototaxis. Proc. Natl. Acad. Sci. U.S.A. 110 (40), E3868-E3877 (2013).
- Luo, L., et al. Navigational decision making in Drosophila thermotaxis. Journal of Neuroscience. 30 (12), 4261-4272 (2010).
- Risse, B., Thomas, S., Otto, N., Löpmeier, T., Valkov, D., Jiang, X., Klämbt, C. FIM, a Novel FTIR-Based Imaging Method for High Throughput Locomotion Analysis. PLoS one. 8 (1), e53963 (2013).
- Risse, B., Otto, N., Jiang, X., Klämbt, C. Quantifying subtle locomotion phenotypes of Drosophila larvae using internal structures based on FIM images. Comput Biol Med. 14, (2014).

