Introduction
فسفاتيديل إيثانولامين ناقلة الميثيل (PEMT) إنزيمات تحفز مرفق التساهمية من واحد أو أكثر من مجموعات الميثيل باستخدام S -adenosylmethionine (SAM) بوصفه المانح مجموعة الميثيل على PE، monomethyl-PE أو ثنائي ميثيل-PE لإعطاء monomethyl-PE، ثنائي ميثيل-PE و / أو فسفاتيديل (PC). هذه الأنزيمات هي في كل مكان تقريبا في الخلايا الحيوانية والفطريات. كما يمكن العثور عليها في بعض النباتات (1) وحوالي 10٪ من البكتيريا، لا سيما تلك التي تتفاعل مع حقيقيات النوى 2.
PEMTs ذات الصلة بيولوجيا الخلية ليس فقط عن طريق المساهمة في إنتاج أجهزة الكمبيوتر الشخصية، التي هي الطبقة الدهنية الأساسية في الخلايا الحيوانية، ولكن أيضا عن طريق الوفاء الوظائف الخلوية الهامة الأخرى. في الثدييات، ويتم التعبير عن PEMTs أساسا في الكبد حيث كانت مطلوبة من أجل إفراز طبيعي من البروتين الدهني منخفض الكثافة جدا، وأنها تسهم أيضا في النظام الغذائي الناجم عن السمنة 3، 4 تصلب الشرايين، والأنسولين مقاومة5 تعصب. بالإضافة إلى ذلك، أعرب PEMT الثدييات أيضا في الخلايا الشحمية، على الرغم من أن مستويات أدنى، والمشاركة في ترسب الدهون 6 و 7. كما تم أظهرت دور PEMT في تطور مرض السرطان 8، 9 موت الخلايا المبرمج، ونمو الخلايا 10. في البكتيريا، وقد تبين أن الأنزيمات PEMT إلى أن تكون مهمة للنمو الطبيعي الخلية 2، 2 الفوعة، والتعايش مع النبات المضيف (11).
الهدف والأساس المنطقي لهذا البروتوكول هو قياس النشاط PEMT من مقتطفات خلية كاملة دون الحاجة لتنقية الانزيم. وقد وضعت بروتوكولين متميزة لقياس النشاط PEMT. واحد الأول والأكثر شيوعا يقيس نقل مجموعة الميثيل معالج بالتريتيوم من SAM المشع على PE، الذي هو موضوع هذا المقال. وقد تم هذا البروتوكول وضعت أصلا لقياس النشاط PEMT من الخميرة 12 وخلايا الثدييات (الكبد) 13 لاكتساب understاندينج من الحيوي PC في هذه الخلايا وكذلك لتحديد خصوصية هذه الإنزيمات. وفي وقت لاحق، وقد تم تطبيق هذه التقنية لأنواع الخلايا الأخرى مثل البكتيريا 2 (باستخدام قيمة الرقم الهيدروجيني الأساسية للمقايسة على الرغم 15) والطفيليات 14. هذه التقنية يمكن استخدامها مع مقتطفات خلية كاملة وكذلك انزيم المنقى، ويحتمل أن يكون تطبيقها على أي نظام استخراج الخلايا. كما تم تصميم مقايسة غير المشع الذي يعتمد على القياس الكمي الأنزيمي S -adenosylhomocysteine، والمنتج نقل الميثيل من SAM 16. قد يكون الفحص الأخير أكثر ملاءمة لأنها لا تنطوي على النشاط الإشعاعي لكنه لا يصلح إلا للأنزيمات تنقيته.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. خلية التحضير استخراج
- تنمو الخلايا الليشمانيا في زجاجة بلاستيكية معقمة مختومة مع الهواء غطاء محكم على 26 درجة مئوية في المتوسط مصنوعة من 1X M199 تستكمل مع 20 ملي HEPES pH7.4، 100 U / البنسلين مل، 100 ميكروغرام / مل الستربتومايسين، 5 ميكروغرام / مل الهيم ، 0.35 غرام / L ناكو 2 H، 0.1 ملي الأدنين، و 2 ميكروغرام / مل بيوبتيرين دون أن تهتز. حصاد الخلايا بواسطة الطرد المركزي في 1500 ز لمدة 5 دقائق عند 4 درجة مئوية عندما تصل كثافة خلية من 1-2 × 10 7 / مل.
- تجاهل طاف مع ماصة وغسل الخلايا عن طريق إعادة التعليق على بيليه الخلية مع الماصة المصلية في نصف حجم الثقافة والمالحة الفوسفات الباردة مخزنة (137 ملي كلوريد الصوديوم، و 2.7 ملي بوكل، 10 ملي نا 2 هبو 4، 1.8 مم KH 2 PO 4، pH7.4). التخلص supernatants الخلية وفقا لإرشادات السلامة BL2.
- خلايا الطرد المركزي مرة أخرى في 1500 ز لمدة 5 دقائق عند 4 درجة مئوية. تجاهل طاف مع ماصة. المضي قدما رس الخطوة التالية أو المفاجئة تجميد بيليه خلية في النيتروجين السائل لتخزين على المدى الطويل عند -80 درجة مئوية (تصل إلى ثلاثة أشهر).
- إعداد 2X العازلة تحلل (0.5 M السكروز، 0.1 M TrisHCl، pH7.5، 2 مم EDTA، و2X مثبط البروتياز كوكتيل) والاحتفاظ بها في 4 درجات مئوية على الجليد.
- resuspend الكرية الخلية (الطازجة أو المجمدة) في حجم مساو من 2X العازلة تحلل. إضافة حجم 1X من الخرز الزجاجي. دوامة بقوة في 4 درجة مئوية لمدة 10 دقيقة.
- إضافة 2 مجلدات من 1X العازلة تحلل والمزيج. مقتطفات خلية الطرد المركزي في 1500 x ج في 4 درجة مئوية لمدة 10 دقيقة لتكوير الخلايا غير منقطعة ونوى.
- نقل طاف مع الماصة في أنبوب الطرد المركزي باردة جديدة والحفاظ على مقتطفات الخلية على الجليد حتى الانتهاء من التجربة.
2. تحديد تركيز البروتين من استخراج الخلية باستخدام تقدير البروتين عدة مثل حمض Bicinchoninic الفحص
- تحضير حامض bicinchoninic (BCA) حل (1 مل / أنبوب) عن طريق خلط BCA والنحاس (II) قulfate في نسبة 49: 1 (ت / ت).
- إعداد معايير البروتين من 0، 10، 20، 30، 40، 50، و 60 ميكروغرام / مل عن طريق تمييع 10 ملغ / مل ألبومين المصل البقري (BSA) حل الأسهم في 1 مل aliquots من الحل BCA.
- إضافة 2 ميكرولتر من الخلايا مقتطفات في 1 مل من محلول BCA في التكرارات. احتضان المعايير وعينات البروتين لمدة 10 دقيقة في 60 درجة حمام قبل تحسنت C المياه.
- بنقل العينات إلى الجليد لمدة 3 دقائق. قياس الامتصاصية للمعايير وعينات البروتين مع طيفي في الطول الموجي من 562 نانومتر.
- حساب تركيز البروتين من مقتطفات خلية باستخدام معيار BSA كمرجع كما هو موضح في بروتوكول الشركة المصنعة. تمييع مقتطفات خلية إلى تركيز البروتين من 10 ملغ / مل مع العازلة تحلل 1X.
3. الأنزيمية الفحص في 200 ميكرولتر في أنبوب
ملاحظة: حمل الخطوات التالية في غطاء الكيميائية.
- اختبار كل عينة في مكررة في 15 ملأنبوب مخروطي الشكل. إعداد 20 ميكرولتر 1 M TrisHCl 7.5 درجة الحموضة في أنبوب ويبقيه على الجليد. إعداد 2 مل من الكلوروفورم / الميثانول (1: 1 (ت / ت)؛ وقف الحل) في RT لكل أنبوب.
- الماصة 20 ميكرولتر من 1 M TrisHCl 7.5 درجة الحموضة في كل 15 مل أنبوب مخروطي على الجليد.
- اتبع إرشادات السلامة من الإشعاع من هنا. إضافة ما يعادل 0.06 ميكرومتر (0.2 μCi) S - [ميثيل 3 H] adenosyl-L-ميثيونين و 50 ميكرومتر SAM الباردة في أنبوب للما مجموعه 50.06 ميكرومتر من SAM. إضافة X ميكرولتر من الماء البارد حيث x = 200- (20 (لعازلة) + 20 (للمقتطفات الخلية) + حجم البارد والإشعاعي SAM) في أنبوب.
- نقل كل أنبوب مخروطي إلى 30 درجة مئوية حمام قبل حرارة المياه. إضافة إلى كل أنبوب 20 ميكرولتر من مقتطفات الخلية (أي ما يعادل 200 ميكروغرام من البروتين) لبدء التفاعل. احتضان لمدة الوقت المطلوب (0-45 دقيقة).
- وقف رد الفعل بإضافة 2 مل من الكلوروفورم / الميثانول (1: 1؛ ت / ت، حل وقف) إلى كل أنبوب. نقل أنبوب مخروطي لRT (20-256؛ C).
4. استخراج الدهن
ملاحظة: حمل الخطوات التالية في غطاء الكيميائية.
- إضافة 700 ميكرولتر من المياه إلى كل أنبوب يحتوي على عينة رد فعل الأنزيمية. دوامة بقوة لمدة 30 ثانية. الطرد المركزي في 1500 x ج لمدة 5 دقائق على RT لفصل العضوية من المرحلة المياه.
- نقل المرحلة العضوية أقل إلى 15 مل جديد أنبوب مخروطي مع ماصة. إضافة 1 مل من الماء إلى كل "المرحلة الدنيا" التي تحتوي على أنبوب ودوامة بقوة لمدة 30 ثانية. الطرد المركزي مرة أخرى في 1500 x ج لمدة 5 دقائق لفصل العضوية من المرحلة المياه.
- نقل المرحلة العضوية أقل في أنبوب التلألؤ مع ماصة. العينات الجافة تحت تيار من N 2. التخلص المراحل الماء الذي يحتوي على SAM غير أدرجت المشعة وأنابيب مخروطية المشعة وفقا لتوجيهات الإشعاع.
- إضافة 2 مل / أنبوب التلألؤ السائل. قياس النشاط الإشعاعي تدمج مع فصول التوجيه الجامعي التلألؤnter وفقا لبروتوكول الصانعين واستخدام الصك.
- حساب النشاط الأنزيمي في نانومول / ملغم بروتين باستخدام المعادلة العامة التالية:
قيمة التكلفة لكل ألف ظهور × 10 × 3 [المجموع (المشعة والبرد) تركيز SAM (ملم)] × 5 نشاط معين من SAM المشع (CI / ملمول) س [تركيز SAM المشع (ملم)]
ملاحظة: يمكن تغيير البروتوكول أعلاه لتركيز SAM معال أو البروتين تعتمد PEMT الفحص. لتركيز SAM تعتمد فحص الأنزيمية، يتم الاحتفاظ وقت ثابت (15 دقيقة، والتي هي في حدود الخطية) وكميات متنوعة من SAM البارد تضاف إلى فحص حين لبروتين تعتمد فحص PEMT، وتركيز SAM (اخترنا 0.05 ملم) والوقت يتم الاحتفاظ ثابت (15 دقيقة). أيضا الرقم الهيدروجيني للالعازلة يمكن تغيير حسب الحاجة إذا كان بعض الانزيمات PEMT لها قيمة الرقم الهيدروجيني الأمثل مختلفة.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
ويبين الشكل 1 وقت الفحص PEMT المعالين، التي أجريت مع الليشمانيا استخراج خلية كاملة كمصدر للإنزيم باستخدام PE الذاتية باعتبارها الركيزة. وكان كميا مقدار النشاط الإشعاعي في المرحلة العضوية من قبل التلألؤ العد. واستخدمت الأرقام الناتجة لحساب كمية مجموعات الميثيل معالج بالتريتيوم نقل على PE. كان النشاط PEMT الخطية لحوالي 20 دقيقة. ثم وصلت إلى الهضبة في حوالي 30 دقيقة، وبعد ذلك بقيت ثابتة لمدة 15 دقيقة أخرى. كما هو متوقع، لم يتم الكشف عن النشاط PEMT عندما تم إضافة أي مقتطفات الخلية إلى فحص (الشكل 2). وعلاوة على ذلك، تم إلغاء هذا النشاط بحضور octadecyltrimethylammonium بروميد 100 ميكرومتر، وهو مثبط لL. ميثيل PE كبير LMJ PEM1 وLMJ PEM2 14. كان النشاط PEMT أيضا البروتين تركيز dependenوتي، وهذا النشاط النسبي خطيا إلى كمية البروتين بطلب للحصول على فحص الأنزيمية (الشكل 3). وأخيرا، جرى التركيز SAM PEMT تعتمد فحص خارج، والتي تم اختبارها زيادة تركيزات SAM (الشكل 4). بلغ النشاط PEMT هضبة في تركيز SAM ما يقرب من 0.5 ملي. كل ذلك معا، وتظهر هذه المقايسات الأربعة التي النشاط PEMT غير محددة ويمكن قياسها من مقتطفات خلية كاملة دون الحاجة لتنقية إنزيم (ق).
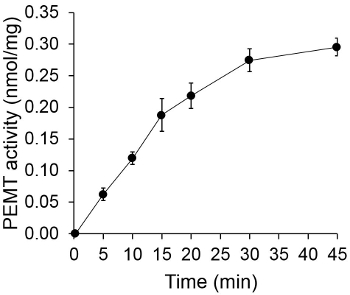
الشكل 1. الوقت يعتمد PEMT الفحص. تم إجراء الفحص الانزيمي مرتين في مكررة مع 0.2 ملغ من مقتطفات خلية كاملة الليشمانيا بوصفها وظيفة من الزمن. ويمثل النشاط PEMT كمجموعات نانومول الميثيل نقل على PE في ملغ من البروتين وصساعة إيه. للمرة "O"، كانت مختلطة مقتطفات الخلية الأولى مع 2 مل من وقف الحل مصنوعة من كلوروفورم / الميثانول (1: 1، من حيث الحجم) قبل إضافتها إلى حل فحص تحتوي على SAM. وتظهر الانحرافات المعيارية.
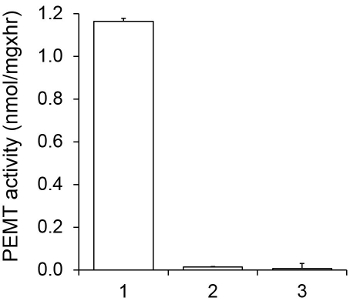
الشكل 2. خصوصية PEMT النشاط. وأجري PEMT فحص مرتين في مكررة لمدة 15 دقيقة في وجود 0.05 ملي SAM. 1، 0،2 ملغ استخراج البروتين. 2، أي استخراج الخلايا. 3، 0،2 ملغم بروتين و 0.1 ملي بروميد octadecyltrimethylammonium. وتظهر الانحرافات المعيارية.
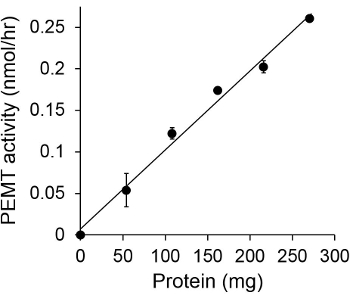
الشكل 3. البروتين PEMT يعتمد الفحص. تم إجراء الفحص الأنزيمية مرتين فيتكرار في غياب (نقطة 'O') أو وجود كميات مختلفة من البروتينات الليشمانيا مع 0.05 ملي SAM لمدة 15 دقيقة. وتظهر الانحرافات المعيارية.
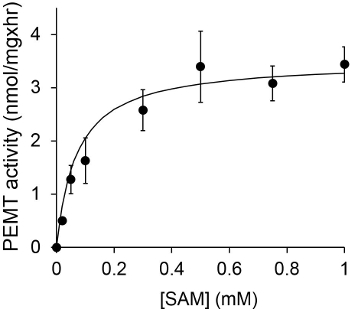
الرقم 4. وأجري فحص PEMT مرتين في مكررة مع 0.2 ملغ من مقتطفات خلية كاملة الليشمانيا في وجود تركيزات مختلفة من SAM لمدة 15 دقيقة. وتظهر الانحرافات المعيارية.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
هذا بسيط، PEMT سريع الفحص يسمح الكمي من أشكال مثيلة من PE التي تنتج من نقل مجموعات الميثيل المشعة من SAM على PE باستخدام استخراج خلية كاملة كمصدر للبروتين. فهي سريعة وحساسة، قابلة للتكرار، ومناسبة أيضا لأنزيمات النقاء 17. Monomethyl- أو ثنائي ميثيل-PE يمكن أن تضاف إلى فحص إذا كانت ناقلة ميثيل الفائدة هو محدد لهذه ركائز بدلا من PE 12،13،18،19. إذا تم استخدام تنقية إنزيم PEMT، PE يمكن أن تضاف إلى الفحص. وجود قيود على هذا البروتوكول هو أن الفحص لا تحدد المنتجات ردود الفعل (monomethyl-PE، ثنائي ميثيل-PE، أو PC). ومع ذلك، فإن هوية منتجات التفاعل (monomethyl-PE، ثنائي ميثيل-PE، PC) يمكن زيادة تحليلها من قبل الأبعاد طبقة رقيقة اللوني واحد كما هو موضح في 20،21. وعلاوة على ذلك، فإن بعض SAM منتجات التحلل مثل S -adenosylhomocysteine و5'-methylthioadenosine قد تمنع PEMT النشاط بذ ردود الفعل كبت. ومع ذلك، الليشمانيا تمتلك هيدرولاز S -adenosylhomocysteine 22، الذي يشق S -adenosylhomocysteine إلى الأدينين وS -ribosylhomocysteine، وفسفوريلاز methylthioadenosine، التي تنتج الأدينين وmethylthioribose 1-فوسفات 23. ومع ذلك، فإنه ليس من المعروف ما إذا كان هيدرولاز S -adenosylhomocysteine والأنشطة فسفوريلاز methylthioadenosine مرتفعة بما يكفي لاستقلاب بكفاءة S -adenosylhomocysteine وmethylthioadenosine، على التوالي، حتى لا يحدث تثبيط النشاط PEMT. في المقام S هيدرولاز -adenosylhomocysteine و / أو 5'-methylthioadenosine انزيم الأيض غائبة في الخلية من الفائدة، إضافة النقاء، والانزيمات المؤتلف منها يمكن أن تضاف إلى مقايسة للتخفيف من ردود الفعل عن طريق تثبيط SAM المنتجات تدهور 24،25، 26.
هناك أربع خطوات حاسمة في هذا البروتوكول: ط)مسحوق مثبط البروتياز كوكتيل لديه لتضاف إلى المخزن المؤقت تحلل فقط قبل الاستخدام (الخطوة 1.1)؛ ثانيا) خلية كاملة المقتطفات هي لاستخدامها خلال الساعات التالية بعد إعداد (بعد الخطوة 1.4)؛ ج) خلال خطوات استخراج الدهن (الخطوات 4.2 و 4.4)، يحتاج الحذر ليتم تطبيقها على عدم نقل أي من مرحلة البيني أو الماء، الذي يحتوي على معالج بالتريتيوم SAM الزائد، والرابع) إلى قسامة S المشع - [ميثيل 3 H] adenosyl-L-ميثيونين وكاشف البارد على إيصال كما دورات متكررة من تجميد وذوبان الجليد تحط عليه في 5'-methylthioadenosine واكتون homoserine تليها المائي لالأدينين وS -pentosylmethionine 26،27،28، التي قد تكون مسؤولة عن عدم وجود النشاط PEMT للقياس. قد تكون سيئة مقتطفات خلية كاملة مسؤولة أيضا عن أي نشاط الأنزيمي. في هذه الحالة، وجودة استخراج الخلايا يمكن تقييمها من خلال قياس النشاط الأنزيمي أخرى معروفة. الماضي، وقلة النشاط PEMT قد تعتمد على PEMT ENإنزيم كونها محددة لmonomethyl-PE أو ثنائي ميثيل-PE بدلا من PE. إضافة monomethyl-PE و / أو ركائز ثنائي ميثيل-PE للفحص قد يعيد النشاط PEMT.
كبديل لذلك، وقد وضعت SAM غير المشعة ناقلة ميثيل يعتمد الفحص، الذي يعتمد على القياس الكمي الأنزيمية من الحمض الاميني، والمنتجات نقل الميثيل من SAM 29. وقد تم تطبيق هذا البروتوكول بنجاح لقياس PE النشاط ناقلة ميثيل محددة 16. للأسف، هذا الاختبار لا يصلح إلا للانزيم المنقى وليس من أجل استخراج الخلايا كله، ولا تكشف عن هوية منتجات التفاعل سواء.
ربما يمكن أن يطبق هذا البروتوكول إلى أي نوع من الخلايا. بالإضافة إلى ذلك، هذا الاختبار يمكن استخدامها لاختبار المخدرات المحتملة محددة لPEMT من الاهتمام في سياق اختبار المركبات المضادة للميكروبات جديدة لمكافحة الالتهابات البكتيرية أو علاجات جديدة ضد النظام الغذائي الناجم عن تصلب الشرايين، والسمنة، ومقاومة الأنسولين.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
أعلن أي تضارب في المصالح
Materials
| Name | Company | Catalog Number | Comments |
| S-[Methyl-3H]adenosyl-L-methionine (specific activity of 5-15 Ci/mMole) | Perkin Elmer | NET155050UC | Aliquot the reagent and freeze at -20 °C; follow radiation safety guidelines while using this reagent |
| Protease inhibitor cocktail | Roche Life Sciences | 11836170001 | dilute it fresh |
| Glass beads, acid washed, 425-600 mm | Sigma Aldrich | G8772 | |
| Bicinchoninic acid solution | Sigma Aldrich | B9643 | |
| Copper (II) sulfate | Sigma Aldrich | C2284 | |
| Scintillation counter MicroBeta2 with 1-detector | Perkin Elmer | 2450-0010 | |
| Spectrophotometer Biomate 3 | Thermo Scientific | 840208300 | |
| BSA stock solution (10 mg/ml) | New England Biolabs | B9001S | |
| Scintillation liquid | Research Product International Corp | 111198 | |
| S-(5'-Adenosyl)-L-methionine chloride (hydrochloride) | Cayman Chemicals | 13956 | dilute the reagent in 20 mM HCl and freeze aliquots at -80 °C |
References
- Keogh, M. R., Courtney, P. D., Kinney, A. J., Dewey, R. E. Functional characterization of phospholipid N-.methyltransferases from Arabidopsis and soybean. J Biol Chem. 284 (23), 15439-15447 (2009).
- Geiger, O., Lopez-Lara, I. M., Sohlenkamp, C. Phosphatidylcholine biosynthesis and function in bacteria. Biochim Biophys Acta. 1831 (3), 503-513 (2013).
- Gao, X., et al. Decreased lipogenesis in white adipose tissue contributes to the resistance to high fat diet-induced obesity in phosphatidylethanolamine N-.methyltransferase-deficient mice. Biochim Biophys Acta. 1851 (2), 152-162 (2015).
- Zhao, Y., et al. Lack of phosphatidylethanolamine N-.methyltransferase alters plasma VLDL phospholipids and attenuates atherosclerosis in mice. Arterioscler Thromb Vasc Biol. 29 (9), 1349-1355 (2009).
- Vance, D. E. Phospholipid methylation in mammals: from biochemistry to physiological function. Biochim Biophys Acta. 1838 (6), 1477-1487 (2014).
- Nishimaki-Mogami, T., Suzuki, K., Takahashi, A. The role of phosphatidylethanolamine methylation in the secretion of very low density lipoproteins by cultured rat hepatocytes: rapid inhibition of phosphatidylethanolamine methylation by bezafibrate increases the density of apolipoprotein B48-containing lipoproteins. Biochim Biophys Acta. 1304 (1), 21-31 (1996).
- Noga, A. A., Zhao, Y., Vance, D. E. An unexpected requirement for phosphatidylethanolamine N-.methyltransferase in the secretion of very low density lipoproteins. J Biol Chem. 277 (44), 42358-42365 (2002).
- Li, D., et al. Epigenetic repression of phosphatidylethanolamine N-.methyltransferase (PEMT) in BRCA1-mutated breast cancer. Oncotarget. 5 (5), 1315-1325 (2014).
- Cui, Z., Houweling, M., Vance, D. E. Suppression of rat hepatoma cell growth by expression of phosphatidylethanolamine N-.methyltransferase-2. J Biol Chem. 269 (40), 24531-24533 (1994).
- Cui, Z., Shen, Y. J., Vance, D. E. Inverse correlation between expression of phosphatidylethanolamine.N-.methyltransferase-2 and growth rate of perinatal rat livers. Biochim Biophys Acta. 1346 (1), 10-16 (1997).
- Minder, A. C., de Rudder, K. E., Narberhaus, F., Fischer, H. M., Hennecke, H., Geiger, O. Phosphatidylcholine levels in.Bradyrhizobium japonicum. membranes are critical for an efficient symbiosis with the soybean host plant. Mol Microbiol. 39 (5), 1186-1198 (2001).
- Kodaki, T., Yamashita, S. Yeast phosphatidylethanolamine methylation pathway. Cloning and characterization of two distinct methyltransferase genes. J Biol Chem. 262 (32), 15428-15435 (1987).
- Tanaka, Y., Amano, F., Maeda, M., Nishijima, M., Akamatsu, Y. Purification and properties of phosphatidyl-N-.monomethylethanolamine N-.methyltransferase, the enzyme catalyzing the second and the third steps in the phosphatidylethanolamine N-.methyltransferase system, from mouse liver microsomes. Jpn J Med Sci Biol. 43 (3), 59-73 (1990).
- Bibis, S. S., Dahlstrom, K., Zhu, T., Zufferey, R. Characterization of Leishmania major phosphatidylethanolamine methyltransferases LmjPEM1 and LmjPEM2 and their inhibition by choline analogs. Mol Biochem Parasitol. 196 (2), 90-99 (2014).
- deRudder, K. E., Thomas-Oates, J. E., Geiger, O. Rhizobium meliloti. mutants deficient in phospholipid N-.methyltransferase still contain phosphatidylcholine. J Bacteriol. 179 (22), 6921-6928 (1997).
- Aktas, M., Narberhaus, F. In vitro characterization of the enzyme properties of the phospholipid N-.methyltransferase PmtA from Agrobacterium tumefaciens. J Bacteriol. 191 (7), 2033-2041 (2009).
- Ridgway, N. D., Vance, D. E. Phosphatidylethanolamine N-.methyltransferase from rat liver. Methods Enzymol. 209, 366-374 (1992).
- Gaynor, P. M., Carman, G. M. Phosphatidylethanolamine methyltransferase and phospholipid methyltransferase activities from Saccharomyces cerevisiae. Enzymological and kinetic properties. Biochim Biophys Acta. 1045 (2), 156-163 (1990).
- Arondel, V., Benning, C., Somerville, C. R. Isolation and functional expression in Escherichia coli. of a gene encoding phosphatidylethanolamine methyltransferase (EC 2.1.1.17) from Rhodobacter sphaeroides. J Biol Chem. 268 (21), 16002-16008 (1993).
- Wessel, M., Klusener, S., Godeke, J., Fritz, C., Hacker, S., Narberhaus, F. Virulence of Agrobacterium tumefaciens. requires phosphatidylcholine in the bacterial membrane. Mol Microbiol. 62 (3), 906-915 (2006).
- Klusener, S., Aktas, M., Thormann, K. M., Wessel, M., Narberhaus, F. Expression and physiological relevance of Agrobacterium tumefaciens. phosphatidylcholine biosynthesis genes. J Bacteriol. 191 (1), 365-374 (2009).
- Henderson, D. M., et al. Cloning of the gene encoding Leishmania donovani.S.-adenosylhomocysteine hydrolase, a potential target for antiparasitic chemotherapy. Mol Biochem Parasitol. 53 (1-2), 169-183 (1992).
- Koszalka, G. W., Krenitsky, T. A. 5'-Methylthioadenosine (MTA) phosphorylase from promastigote of Leishmania donovani. Purine and Pyrimidine Metabolism in Man V, Adv Exp Med Biol. Nyhan, W. L., Thompson, L. F., Watts, R. W. E. 131, Springer US. 559-563 (1986).
- Biastoff, S., Teuber, M., Zhou, Z. S., Dräger, B. Colorimetric activity measurement of a recombinant putrescine N.-methyltransferase from Datura stramonium. Planta Med. 72 (12), 1136-1141 (2006).
- Hendricks, C. L., Ross, J. R., Pichersky, E., Noel, J. P., Zhou, Z. S. An enzyme-coupled colorimetric assay for S.-adenosylmethionine-dependent methyltransferases. Anal Biochem. 326 (1), 100-105 (2004).
- Cannon, L. M., Butler, F. N., Wan, W., Zhou, Z. S. A stereospecific colorimetric assay for (S.,S.)-adenosylmethionine quantification based on thiopurine methyltransferase-catalyzed thiol methylation. Anal Biochem. 308 (2), 358-363 (2002).
- Hoffman, J. L. Chromatographic analysis of the chiral and covalent instability of S.-adenosyl-L-methionine. Biochemistry. 25 (15), 4444-4449 (1986).
- Wu, S. E., Huskey, W. P., Borchardt, R. T., Schowen, R. L. Chiral instability at sulfur of S.-adenosylmethionine. Biochemistry. 22 (12), 2828-2832 (1983).
- Dorgan, K. M., et al. An enzyme-coupled continuous spectrophotometric assay for S.-adenosylmethionine-dependent methyltransferases. Anal Biochem. 350 (2), 249-255 (2006).



