Introduction
Phosphatidylethanolamin methyltransferase (PEMT) enzymer katalyserer den kovalente binding af en eller flere methylgrupper med S -adenosylmethionine (SAM) som methylgruppen donor på PE, monomethyl-PE eller dimethyl-PE til opnåelse af monomethyl-PE, dimethyl-PE og / eller phosphatidylcholin (PC). Disse enzymer er næsten allestedsnærværende i dyreceller og svampe. De kan også findes i visse planter 1 og ca. 10% af bakterier, især dem, der interagerer med eukaryoter 2.
PEMTs er relevante for biologi cellen ikke blot ved at bidrage til produktionen af PC, som er den vigtigste lipid klasse i dyreceller, men også ved at opfylde andre vigtige cellefunktioner. I pattedyr er PEMTs primært udtrykkes i leveren, hvor de er nødvendige for normal sekretion af meget lav-densitet lipoprotein og de bidrager også til kost-induceret fedme 3, aterosklerose 4, og insulin modståstemmelse 5. Derudover er pattedyr PEMT også til udtryk i adipocytter, men til lavere niveauer, og deltage i fedtaflejring 6, 7. PEMT rolle i udviklingen af kræft 8, 9 apoptose og cellevækst 10 er også blevet påvist. I bakterier, har PEMT enzymer vist sig at være vigtig for normal cellevækst 2, virulens 2 og symbiose med værtsplanten 11.
Målet og begrundelsen for denne protokol er at måle PEMT aktivitet fra helcelleekstrakter uden behov for at rense enzymet. Der er blevet udviklet to forskellige protokoller til at måle PEMT aktivitet. Den første og mest almindelige måler overførslen af tritieret methylgruppe fra radioaktiv SAM på PE, som er emnet for denne artikel. Denne protokol er oprindeligt udviklet til måling PEMT aktivitet fra gær 12 og pattedyrceller (lever) 13 til at opnå en understanding af PC-biosyntese i disse celler samt for at bestemme specificiteten af disse enzymer. Senere er denne teknik blevet anvendt på andre celletyper, såsom bakterier 2 (ved hjælp af en basisk pH-værdi for assayet selvom 15) og protozoparasitter 14. Denne teknik kan anvendes med helcelleekstrakter samt oprensede enzym, og kan potentielt anvendes på enhver celleekstrakt system. En ikke radioaktive assay er også blevet designet, der bygger på den enzymatiske kvantificering af S -adenosylhomocysteine, at transmethylering produkt af SAM 16. Sidstnævnte analyse kan være mere praktisk, da det ikke indebærer radioaktivitet, men det er kun egnet til oprensede enzymer.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. celleekstrakt Fremstilling
- Grow Leishmania-celler i en steril plastflaske forseglet med lufttætte hætte ved 26 ºC i et medium fremstillet af 1x M199 suppleret med 20 mM HEPES pH 7,4, 100 U / ml penicillin, 100 ug / ml streptomycin, 5 ug / ml hæm , 0,35 g / L Naco 2 H, 0,1 mM adenin og 2 ug / ml biopterin uden omrystning. Cellerne høstes ved centrifugering ved 1.500 g i 5 minutter ved 4 ° C, når de når en celletæthed på 1-2 x 10 7 / ml.
- Supernatanten med en pipette og vaskes cellerne ved at resuspendere cellepelleten med en serologisk pipette i halvdelen af kulturens volumen koldt phosphatbufret saltvand (137 mM NaCl, 2,7 mM KCI, 10 mM Na 2 HPO 4, 1,8 mM KH 2 PO 4, pH 7,4). Bortskaf cellesupernatanter henhold til BL2 sikkerhedsretningslinjer.
- Centrifuger cellerne igen ved 1.500 g i 5 minutter ved 4 ° C. Supernatanten med en pipette. Fortsæt to det næste trin eller snap fryse cellepelleten i flydende nitrogen til langtidsopbevaring ved -80 ºC (op til tre måneder).
- Forbered 2x lysisbuffer (0,5 M saccharose, 0,1 M TrisHCl, pH 7,5, 2 mM EDTA og 2x proteaseinhibitorcocktail) og holde det ved 4 ºC på is.
- Resuspender cellepelleten (friske eller frosne) i lige stort volumen af 2X lysis buffer. Tilføj 1x volumen glasperler. Vortex kraftigt ved 4 ºC i 10 min.
- Tilsæt 2 volumener 1 x lysisbuffer og blandes. Centrifugér celleekstrakter ved 1.500 xg ved 4 ºC i 10 minutter til pelletering ubrudte celler og kerner.
- Overfør supernatanten med en pipette i en frisk kølig centrifugerør og holde celleekstrakter på is indtil afslutning af forsøget.
2. Bestem Proteinkoncentrationen af celleekstrakt anvendelse af protein Estimation Kit Såsom bicinchoninsyre Assay
- Forbered bicinchoninsyre (BCA) opløsning (1 ml / rør) ved at blande BCA og kobber (II) sulfate i et forhold på 49: 1 (v / v).
- Forbered protein standarder for 0, 10, 20, 30, 40, 50 og 60 ug / ml ved fortynding af et 10 mg / ml bovint serumalbumin (BSA) stamopløsning i 1 ml portioner af BCA-opløsning.
- Tilsæt 2 pi celleekstrakter i 1 ml BCA opløsning i dubletter. Inkuber standarder og proteinprøver i 10 minutter i en forvarmet 60 ° C vandbad.
- Overfør prøver at is i 3 min. Absorbansen af standarder og protein prøver med et spektrofotometer ved en bølgelængde på 562 nm.
- Beregn proteinkoncentrationen af celleekstrakter under anvendelse af BSA standard som reference, som beskrevet i producentens protokol. Fortynd celleekstrakter til en proteinkoncentration på 10 mg / ml med 1x lysisbuffer.
3. enzymatisk assay i 200 pi pr Tube
BEMÆRK: Udfør følgende trin i en kemisk hætte.
- Test hver prøve i to eksemplarer på en 15 mlkonisk rør. Forbered 20 pi 1 M TrisHCI pH 7,5 pr rør og holde det på is. Forbered 2 ml chloroform / methanol (1: 1 (v / v); stopopløsning) ved stuetemperatur i hvert rør.
- Pipetter 20 pi 1 M Tris-HCI pH 7,5 i hvert 15 ml konisk rør på is.
- Følg retningslinjer for strålingssikkerhed herfra på. Tilføj svarer til 0,06 uM (0,2 uCi) S - [methyl-3H] adenosyl-L-methionin og 50 pM kold SAM pr rør til i alt 50,06 uM SAM. Tilføj x pi koldt vand, hvor x = 200 (20 (for buffer) + 20 (for celleekstrakter) + volumen koldt og radioaktivt SAM) pr rør.
- Overfør hver konisk rør med en på forhånd opvarmet 30 ° C vandbad. Tilføj til hvert rør 20 pi celleekstrakter (svarende til 200 ug protein) for at starte reaktionen. Der inkuberes for den ønskede (0-45 min).
- Reaktionen standses ved tilsætning af 2 ml chloroform / methanol (1: 1 v / v; stopopløsning) til hvert rør. Overfør konisk rør til stuetemperatur (20-256 C).
4. lipidekstraktion
BEMÆRK: Udfør følgende trin i en kemisk hætte.
- Tilføj 700 pi vand til hvert rør indeholdende den enzymatiske reaktion prøven. Vortex kraftigt i 30 sek. Der centrifugeres ved 1.500 x g i 5 minutter ved stuetemperatur for at adskille den organiske fra vandfasen.
- Den nedre organiske fase overføres til et nyt 15 ml konisk rør med en pipette. Der tilsættes 1 ml vand til hver "nedre fase", der indeholder glasset og vortex kraftigt i 30 sek. Der centrifugeres igen ved 1.500 x g i 5 minutter for at adskille den organiske fra vandfasen.
- Den nedre organiske fase overføres til en scintillationstæller rør med en pipette. Tørre prøver under en strøm af N2. Bortskaf de vandfaser, der indeholder ikke-inkorporeret radioaktive SAM og de radioaktive koniske rør som pr stråling retningslinjer.
- Tilsæt 2 ml / rør af scintillationsvæske. Mål den inkorporerede radioaktivitet med en scintillationstæller couPil ifølge producenternes protokol og instrumentets brug.
- Beregn den enzymatiske aktivitet i nmol / mg protein ved anvendelse af følgende generelle ligning:
CPM-værdi x 10 3 x [total (radioaktivt og kold) koncentration af SAM (mM)] x 5 specifikke aktivitet af radioaktive SAM (Ci / mmol) x [koncentration af radioaktivt SAM (mM)]
Bemærk: Ovenstående protokol kan ændres for en SAM koncentrationsafhængig eller et protein afhængig PEMT assay. For SAM koncentrationsafhængig enzymatisk assay tid holdes konstant (15 min, som er i det lineære område) og forskellige mængder af koldt SAM tilsættes til assayet, mens for protein afhængige PEMT assay SAM koncentration (vi valgte 0,05 mM) og tid holdes konstant (15 min). Også pH i bufferen kan ændres efter behov, hvis nogle PEMT enzymer har en anden optimal pH-værdi.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Figur 1 viser en tidsafhængig PEMT assay, der blev udført med Leishmania helcelleekstrakt som et enzym kilden med endogen PE som substrat. Mængden af radioaktivitet i den organiske fase blev kvantificeret ved scintillationstælling. De resulterende tal blev anvendt til at beregne mængden af tritieret methylgrupper overført til PE. Den PEMT aktivitet var lineær i ca. 20 min. Det nåede derefter et plateau på omkring 30 minutter, hvorefter den forblev konstant i yderligere 15 minutter. Som forventet blev PEMT aktiviteten ikke detekteres, når ingen celleekstrakter blev tilsat til assayet (figur 2). Endvidere blev denne aktivitet ophæves i nærvær af 100 uM octadecyltrimethylammonium bromid, som er en inhibitor af L. store PE methyltransferaser LMJ PEM1 og LMJ PEM2 14. PEMT aktivitet var også proteinkoncentration dependent, og denne aktivitet var lineært proportional med mængden af protein anvendes til enzymatisk analyse (figur 3). Endelig blev en SAM koncentrationsafhængig PEMT assay udført, hvor stigende koncentrationer af SAM blev testet (Figur 4). PEMT aktivitet nåede et plateau ved SAM koncentration på ca. 0,5 mM. Alle sammen, disse fire assays viser, at PEMT aktivitet er specifik og kan måles ud fra hele celleekstrakter uden behov for at oprense enzymet (s).
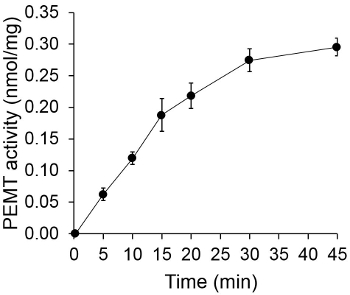
Figur 1. Tidsafhængig PEMT assay. Den enzymatiske assay blev udført to gange i to eksemplarer med 0,2 mg af hele Leishmania celleekstrakter som en funktion af tiden. PEMT aktiviteten er angivet som nmol methylgrupper overført til PE per mg protein og pER time. For tiden "O", blev celleekstrakter først blandet med 2 ml stopopløsning fremstillet af chloroform / methanol (1: 1, efter volumen), før det sættes til assay indeholdende SAM. Standardafvigelser er vist.
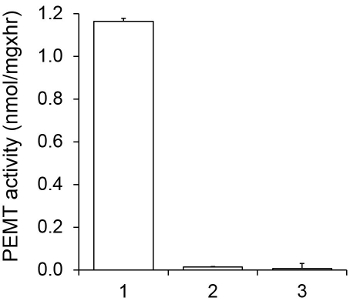
Figur 2. Specificitet af PEMT aktivitet. PEMT assay blev udført to gange i to eksemplarer i 15 minutter i nærvær af 0,05 mM SAM. 1, 0,2 mg proteinekstrakt; 2, ingen celle ekstrakt; 3, 0,2 mg protein og 0,1 mM octadecyltrimethylammonium bromid. Standardafvigelser er vist.
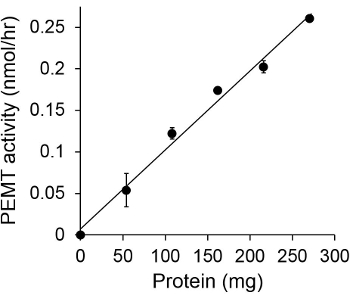
Figur 3. Protein afhængige PEMT assay. Den enzymatiske assay blev udført to gange iduplicate i fravær (punkt "O") eller nærvær af forskellige mængder af Leishmania proteiner med 0,05 mM SAM i 15 minutter. Standardafvigelser er vist.
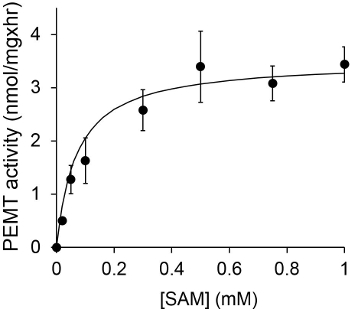
Figur 4. PEMT assay blev udført to gange i to eksemplarer med 0,2 mg af hele Leishmania celleekstrakter i nærvær af forskellige koncentrationer af SAM i 15 minutter. Standardafvigelserne er vist.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Denne enkle, praktiske PEMT assay tillader kvantificering af methylerede former for PE, som hidrører fra overførsel af radioaktive methylgrupper fra SAM på PE hjælp helcelleekstrakt som proteinkilde. Det er hurtigt, følsomt, reproducerbart og også egnet til oprensede enzymer 17. Monomethyl- eller dimethyl-PE kan tilsættes til assayet, hvis methyltransferase af interesse er specifikt for disse substrater i stedet for PE 12,13,18,19. Hvis der anvendes oprenset PEMT enzym kan PE sættes til assayet. En begrænsning af denne protokol er, at analysen ikke identificere de reaktioner produkter (monomethyl--PE, dimethyl-PE eller PC). Imidlertid kan identiteten af reaktionsprodukterne (monomethyl-PE, dimethyl-PE, PC) yderligere analyseres ved endimensional tyndtlagskromatografi som beskrevet i 20,21. Endvidere kan nogle af SAM nedbrydningsprodukter såsom S -adenosylhomocysteine og 5'-methylthioadenosin inhibere PEMT aktivitet by feedback-inhibering. Men Leishmania besidder en S -adenosylhomocysteine hydrolase 22, som spalter S -adenosylhomocysteine i adenin og S -ribosylhomocysteine, og en methylthioadenosin phosphorylase, der producerer adenin og methylthioribose-1-phosphat 23. Det er imidlertid ikke kendt, om S -adenosylhomocysteine hydrolase og methylthioadenosin phosphorylase aktiviteter er høje nok til effektivt metabolisere S -adenosylhomocysteine og methylthioadenosin henholdsvis således at ingen hæmning af PEMT aktivitet forekommer. I det tilfælde, S -adenosylhomocysteine hydrolase og / eller 5'-methylthioadenosin metaboliske enzym er fraværende i cellen af interesse, tilsætning af de respektive oprensede, rekombinante enzymer kan tilsættes til assayet til at lindre feedback inhibering ved SAM nedbrydningsprodukter 24,25, 26.
Der er fire vigtige skridt i denne protokol: i)proteaseinhibitoren cocktail pulver skal føjes til lysisbuffer lige før brug (trin 1.1); ii) hele cellen ekstrakter er at blive udnyttet inden for de følgende timer efter fremstilling (efter trin 1.4); iii) i de lipid ekstraktionstrin (trin 4.2 og 4.4), brug forsigtighed, der skal anvendes til at overfører ikke nogen af mellemfasen eller vandfasen, som indeholder overskydende tritieret SAM, og iv) at udportionerer det radioaktive S - [methyl- 3 H] adenosyl-L-methionin og koldt reagens ved modtagelse som gentagne cykler af frysning og optøning nedbrydes det i 5'-methylthioadenosin og homoserinlacton efterfulgt af hydrolyse til adenin og S -pentosylmethionine 26,27,28, hvilket kan forklare manglen på målbar PEMT aktivitet. Bad helcelleekstrakter kan også være ansvarlig for nogen enzymatisk aktivitet. I dette tilfælde kan kvaliteten af celleekstrakt vurderes ved at måle en anden kendt enzymaktivitet. Sidste, manglende PEMT aktivitet kan stole på PEMT enZyme er specifik for monomethyl-PE eller dimethyl-PE snarere end PE. Tilsætning af monomethyl-PE og / eller dimethyl-PE substrater til assayet kan gendanne PEMT aktivitet.
Et alternativ er ikke-radioaktiv SAM afhængig methyltransferase assay blevet udviklet, der bygger på den enzymatiske kvantificering af homocystein, de transmethyleringsreaktioner produkter af SAM 29. Denne protokol er blevet anvendt med succes til at måle PE specifik methyltransferaseaktivitet 16. Desværre er dette assay er kun egnet til oprenset enzym og ikke for helcelleekstrakt og ikke afsløre identiteten af reaktionsprodukterne enten.
Denne protokol kan eventuelt anvendes på enhver celletype. Derudover kan dette assay anvendes til at teste potentielle lægemidler er specifikke for en PEMT af interesse i forbindelse med afprøvning af nye antimikrobielle forbindelser til bekæmpelse af bakterielle infektioner eller hidtil ukendte terapeutiske midler mod kost-induceret atherosklerose, fedmeOg insulinresistens.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Nogen interessekonflikt erklæret
Materials
| Name | Company | Catalog Number | Comments |
| S-[Methyl-3H]adenosyl-L-methionine (specific activity of 5-15 Ci/mMole) | Perkin Elmer | NET155050UC | Aliquot the reagent and freeze at -20 °C; follow radiation safety guidelines while using this reagent |
| Protease inhibitor cocktail | Roche Life Sciences | 11836170001 | dilute it fresh |
| Glass beads, acid washed, 425-600 mm | Sigma Aldrich | G8772 | |
| Bicinchoninic acid solution | Sigma Aldrich | B9643 | |
| Copper (II) sulfate | Sigma Aldrich | C2284 | |
| Scintillation counter MicroBeta2 with 1-detector | Perkin Elmer | 2450-0010 | |
| Spectrophotometer Biomate 3 | Thermo Scientific | 840208300 | |
| BSA stock solution (10 mg/ml) | New England Biolabs | B9001S | |
| Scintillation liquid | Research Product International Corp | 111198 | |
| S-(5'-Adenosyl)-L-methionine chloride (hydrochloride) | Cayman Chemicals | 13956 | dilute the reagent in 20 mM HCl and freeze aliquots at -80 °C |
References
- Keogh, M. R., Courtney, P. D., Kinney, A. J., Dewey, R. E. Functional characterization of phospholipid N-.methyltransferases from Arabidopsis and soybean. J Biol Chem. 284 (23), 15439-15447 (2009).
- Geiger, O., Lopez-Lara, I. M., Sohlenkamp, C. Phosphatidylcholine biosynthesis and function in bacteria. Biochim Biophys Acta. 1831 (3), 503-513 (2013).
- Gao, X., et al. Decreased lipogenesis in white adipose tissue contributes to the resistance to high fat diet-induced obesity in phosphatidylethanolamine N-.methyltransferase-deficient mice. Biochim Biophys Acta. 1851 (2), 152-162 (2015).
- Zhao, Y., et al. Lack of phosphatidylethanolamine N-.methyltransferase alters plasma VLDL phospholipids and attenuates atherosclerosis in mice. Arterioscler Thromb Vasc Biol. 29 (9), 1349-1355 (2009).
- Vance, D. E. Phospholipid methylation in mammals: from biochemistry to physiological function. Biochim Biophys Acta. 1838 (6), 1477-1487 (2014).
- Nishimaki-Mogami, T., Suzuki, K., Takahashi, A. The role of phosphatidylethanolamine methylation in the secretion of very low density lipoproteins by cultured rat hepatocytes: rapid inhibition of phosphatidylethanolamine methylation by bezafibrate increases the density of apolipoprotein B48-containing lipoproteins. Biochim Biophys Acta. 1304 (1), 21-31 (1996).
- Noga, A. A., Zhao, Y., Vance, D. E. An unexpected requirement for phosphatidylethanolamine N-.methyltransferase in the secretion of very low density lipoproteins. J Biol Chem. 277 (44), 42358-42365 (2002).
- Li, D., et al. Epigenetic repression of phosphatidylethanolamine N-.methyltransferase (PEMT) in BRCA1-mutated breast cancer. Oncotarget. 5 (5), 1315-1325 (2014).
- Cui, Z., Houweling, M., Vance, D. E. Suppression of rat hepatoma cell growth by expression of phosphatidylethanolamine N-.methyltransferase-2. J Biol Chem. 269 (40), 24531-24533 (1994).
- Cui, Z., Shen, Y. J., Vance, D. E. Inverse correlation between expression of phosphatidylethanolamine.N-.methyltransferase-2 and growth rate of perinatal rat livers. Biochim Biophys Acta. 1346 (1), 10-16 (1997).
- Minder, A. C., de Rudder, K. E., Narberhaus, F., Fischer, H. M., Hennecke, H., Geiger, O. Phosphatidylcholine levels in.Bradyrhizobium japonicum. membranes are critical for an efficient symbiosis with the soybean host plant. Mol Microbiol. 39 (5), 1186-1198 (2001).
- Kodaki, T., Yamashita, S. Yeast phosphatidylethanolamine methylation pathway. Cloning and characterization of two distinct methyltransferase genes. J Biol Chem. 262 (32), 15428-15435 (1987).
- Tanaka, Y., Amano, F., Maeda, M., Nishijima, M., Akamatsu, Y. Purification and properties of phosphatidyl-N-.monomethylethanolamine N-.methyltransferase, the enzyme catalyzing the second and the third steps in the phosphatidylethanolamine N-.methyltransferase system, from mouse liver microsomes. Jpn J Med Sci Biol. 43 (3), 59-73 (1990).
- Bibis, S. S., Dahlstrom, K., Zhu, T., Zufferey, R. Characterization of Leishmania major phosphatidylethanolamine methyltransferases LmjPEM1 and LmjPEM2 and their inhibition by choline analogs. Mol Biochem Parasitol. 196 (2), 90-99 (2014).
- deRudder, K. E., Thomas-Oates, J. E., Geiger, O. Rhizobium meliloti. mutants deficient in phospholipid N-.methyltransferase still contain phosphatidylcholine. J Bacteriol. 179 (22), 6921-6928 (1997).
- Aktas, M., Narberhaus, F. In vitro characterization of the enzyme properties of the phospholipid N-.methyltransferase PmtA from Agrobacterium tumefaciens. J Bacteriol. 191 (7), 2033-2041 (2009).
- Ridgway, N. D., Vance, D. E. Phosphatidylethanolamine N-.methyltransferase from rat liver. Methods Enzymol. 209, 366-374 (1992).
- Gaynor, P. M., Carman, G. M. Phosphatidylethanolamine methyltransferase and phospholipid methyltransferase activities from Saccharomyces cerevisiae. Enzymological and kinetic properties. Biochim Biophys Acta. 1045 (2), 156-163 (1990).
- Arondel, V., Benning, C., Somerville, C. R. Isolation and functional expression in Escherichia coli. of a gene encoding phosphatidylethanolamine methyltransferase (EC 2.1.1.17) from Rhodobacter sphaeroides. J Biol Chem. 268 (21), 16002-16008 (1993).
- Wessel, M., Klusener, S., Godeke, J., Fritz, C., Hacker, S., Narberhaus, F. Virulence of Agrobacterium tumefaciens. requires phosphatidylcholine in the bacterial membrane. Mol Microbiol. 62 (3), 906-915 (2006).
- Klusener, S., Aktas, M., Thormann, K. M., Wessel, M., Narberhaus, F. Expression and physiological relevance of Agrobacterium tumefaciens. phosphatidylcholine biosynthesis genes. J Bacteriol. 191 (1), 365-374 (2009).
- Henderson, D. M., et al. Cloning of the gene encoding Leishmania donovani.S.-adenosylhomocysteine hydrolase, a potential target for antiparasitic chemotherapy. Mol Biochem Parasitol. 53 (1-2), 169-183 (1992).
- Koszalka, G. W., Krenitsky, T. A. 5'-Methylthioadenosine (MTA) phosphorylase from promastigote of Leishmania donovani. Purine and Pyrimidine Metabolism in Man V, Adv Exp Med Biol. Nyhan, W. L., Thompson, L. F., Watts, R. W. E. 131, Springer US. 559-563 (1986).
- Biastoff, S., Teuber, M., Zhou, Z. S., Dräger, B. Colorimetric activity measurement of a recombinant putrescine N.-methyltransferase from Datura stramonium. Planta Med. 72 (12), 1136-1141 (2006).
- Hendricks, C. L., Ross, J. R., Pichersky, E., Noel, J. P., Zhou, Z. S. An enzyme-coupled colorimetric assay for S.-adenosylmethionine-dependent methyltransferases. Anal Biochem. 326 (1), 100-105 (2004).
- Cannon, L. M., Butler, F. N., Wan, W., Zhou, Z. S. A stereospecific colorimetric assay for (S.,S.)-adenosylmethionine quantification based on thiopurine methyltransferase-catalyzed thiol methylation. Anal Biochem. 308 (2), 358-363 (2002).
- Hoffman, J. L. Chromatographic analysis of the chiral and covalent instability of S.-adenosyl-L-methionine. Biochemistry. 25 (15), 4444-4449 (1986).
- Wu, S. E., Huskey, W. P., Borchardt, R. T., Schowen, R. L. Chiral instability at sulfur of S.-adenosylmethionine. Biochemistry. 22 (12), 2828-2832 (1983).
- Dorgan, K. M., et al. An enzyme-coupled continuous spectrophotometric assay for S.-adenosylmethionine-dependent methyltransferases. Anal Biochem. 350 (2), 249-255 (2006).



