ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
تشير هذه الدراسة إلى بروتوكول لفحص الكروموسومات للأجنة البشرية يستخدم وسط مزرعة مستهلك ، والذي يتجنب خزعة الجنين ويتيح تحديد الصيغة الصبغية للكروموسوم باستخدام NGS. تقدم هذه المقالة الإجراء التفصيلي ، بما في ذلك إعداد وسط الثقافة ، وتضخيم الجينوم الكامل (WGA) ، وإعداد مكتبة تسلسل الجيل التالي (NGS) ، وتحليل البيانات.
Abstract
في الإخصاب السريري في المختبر (IVF) ، تتطلب الطريقة السائدة ل PGT-A خزعة من عدد قليل من الخلايا من الأديم الظاهر (TE). هذه هي السلالة التي تشكل المشيمة. ومع ذلك ، تتطلب هذه الطريقة مهارات متخصصة ، وهي غازية ، وتعاني من إيجابيات وسلبيات كاذبة لأن أعداد الكروموسومات في TE وكتلة الخلية الداخلية (ICM) ، التي تتطور إلى الجنين ، ليست هي نفسها دائما. وقد توفر تقنية NICS، وهي تقنية تتطلب تسلسل الحمض النووي الذي يتم إطلاقه في وسط الاستزراع من كل من TE و ICM، مخرجا لهذه المشاكل ولكن ثبت سابقا أن فعاليتها محدودة. وتبلغ هذه الدراسة عن البروتوكول الكامل لنظام NICS، الذي يتضمن أساليب أخذ العينات بوسط الاستزراع، وتضخيم الجينوم الكامل وإعداد المكتبة، وتحليل بيانات NGS بواسطة برامجيات التحليل. بالنظر إلى أوقات الحفظ بالتبريد المختلفة في مختبرات الأجنة المختلفة ، لدى علماء الأجنة طريقتان لجمع وسط زراعة الأجنة الذي يمكن اختياره وفقا للظروف الفعلية لمختبر التلقيح الاصطناعي.
Introduction
تم استخدام تقنيات الإنجاب المساعدة (ARTs) بشكل متزايد لعلاج العقم. ومع ذلك، فإن معدل نجاح العلاج المضاد للفيروسات القهقرية، مثل التلقيح الاصطناعي، كان محدودا، ومعدل فقدان الحمل أعلى بكثير من معدل فقدان الحمل لدى السكانالعاديين 1. السبب الرئيسي لهذه المشاكل هو تشوهات الكروموسومات ، والتي توجد عادة في الأجنة البشرية قبل الزرع2. PGT-A هي طريقة فعالة لفحص الأجنة لتوازن الكروموسومات قبل الزرع 3,4. أثبتت بعض الدراسات أن PGT-A يمكن أن يقلل من معدل الإجهاض ويحسن معدل الحمل5،6،7،8. ومع ذلك ، يتطلب PGT-A خبرة فنية معقدة تتطلب تدريبا وخبرة محددة. يمكن أن يتسبب إجراء خزعة الجنين الغازية أيضا في تلف الأجنة9. أظهرت الدراسات أن خزعة البلاستومير يمكن أن تعيق التطور اللاحق ، وقد يؤثر عدد TEs المأخوذة على معدلات الزرع10. على الرغم من أن قضية السلامة الأحيائية طويلة الأجل لخزعة الجنين لم يتم تقييمها بدقة في البشر ، فقد أظهرت الدراسات التي أجريت على الحيوانات آثارها السلبية على تطور الجنين11،12،13.
أشارت التقارير السابقة إلى أنه تم إفراز كميات ضئيلة من مواد الحمض النووي في وسط المزرعة أثناء نمو الجنين ، وقد بذلت جهود لإجراء فحص شامل للكروموسومات (CCS) باستخدام وسط زراعة الأجنة المستهلك14،15،16،17،18. ومع ذلك ، فإن معدلات الكشف ودقة الاختبارات لم تستوف متطلبات الاستخدام السريري المكثف. وأبلغت هذه الدراسة عن تحسن في اختبار النظام الوطني للإحصاء من أجل زيادة معدلات الكشف فضلا عن دقة اختبار النظام الوطنيللإحصاء 19. في السنوات الأخيرة ، تمت دراسة سائل القيلة الأريمية (BF) كعينة تحليلية من PGT-A طفيف التوغل. ومع ذلك ، فإن نسبة التضخيم الناجح على مستوى الجينوم والحمض النووي القابل للكشف في عينات سائل الكيسة الأريمية تتراوح من 34.8٪ إلى 82٪ 20،21،22. يتراوح حجم BF المبلغ عنه في دراسات مختلفة من 0.3 nL إلى 1 μL. نظرا لانخفاض كمية الحمض النووي في BF ، من الممكن زيادة كمية الحمض النووي الخالي من الخلايا عن طريق خلط سائل الكيسة الأريمية ووسط الثقافة لتحسين معدل نجاح واتساق الكشف. كوزنيتسوف وآخرون.23 و Li et al.24 عالجوا المنطقة الشفافة بالليزر وألقوا سائل الكيسة الأريمية في وسط الاستزراع لتحسين الكمية الإجمالية للحمض النووي الجنيني ، وكان معدل تضخيم عينات الوسط / BF مجتمعة بعد WGA 100٪ و 97.5٪ على التوالي. حصل Jiao et al.25 أيضا على معدل نجاح تضخيم بنسبة 100٪ باستخدام نفس الطريقة.
تقدم هذه الدراسة بروتوكولا مفصلا يتضمن إعداد عينات الوسائط المستهلكة وإعداد NGS وتحليل البيانات. عن طريق إزالة الخلايا الركامية بعناية من البويضات ، أجرت الدراسة الحالية حقن الحيوانات المنوية المفردة داخل الهيولى (ICSI) ومزرعة الكيسة الأريمية. تم جمع الوسيط المستغرق في اليوم 4 أيام 5 / يوم 6 لإعداد مكتبة WGA و NGS. وباستخدام تكنولوجيا NICS، بسطت الدراسة الحالية خطوات إعداد مكتبة WGA و NGS في حوالي 3 ساعات وحصلت على نتائج CCS بشكل غير جراحي في حوالي 9 ساعات.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
تم الحصول على إذن أخلاقي من لجنة الأخلاقيات في مستشفى جامعة بكين الثالث.
1. التحضير
ملاحظة: يتم سرد المواد والمعدات المطلوبة في جدول المواد.
- الكواشف
- التسخين المسبق والتوازن (المتوازن) 20-30 ميكرولتر من وسط الأمشاج / وسط الإخصاب ووسط ثقافة مرحلة الانقسام / الكيسة الأريمية (مغطى بالزيت المعدني) والهيالورونيداز (في أنبوب مغطى بإحكام) عند 37 درجة مئوية ، 5٪ CO 2 و 5٪ O2 في حاضنة ثلاثية الغازات طوال الليل قبل الاستخدام.
- سخن الهيالورونيداز إلى 37 درجة مئوية على سطح العمل في غطاء الدخان.
- قم بإعداد المخزن المؤقت للتزجيج وكواشف جمع العينات وفقا لتعليمات الشركة المصنعة.
- ادوات
- قم بإعداد ماصات جمع العينات ونقلها (القطر الداخلي من ~ 200 إلى 250 ميكرومتر) ، وماصات التعري / المتجرد (القطر الداخلي ≥150 ميكرومتر ، ~ 130-140 ميكرومتر ، و ~ 120 ميكرومتر) ، والماصات للغسيل (القطر الداخلي ~ 150 ميكرومتر) عن طريق سحب ماصات باستور الزجاجية لتوليد أطراف دقيقة مفتوحة مصقولة بالنار.
ملاحظة: يمكن شراء الماصات المستخدمة في جمع / نقل العينات والتعرية والغسيل مباشرة. يمكن أيضا شراء إبر التثبيت وإبر الحقن مباشرة.
- قم بإعداد ماصات جمع العينات ونقلها (القطر الداخلي من ~ 200 إلى 250 ميكرومتر) ، وماصات التعري / المتجرد (القطر الداخلي ≥150 ميكرومتر ، ~ 130-140 ميكرومتر ، و ~ 120 ميكرومتر) ، والماصات للغسيل (القطر الداخلي ~ 150 ميكرومتر) عن طريق سحب ماصات باستور الزجاجية لتوليد أطراف دقيقة مفتوحة مصقولة بالنار.
2. البروتوكول 1: جمع العينات
- المعالجة المسبقة لمركب البويضة - كورونا - الركام (OCCCs) قبل الهضم مع الهيالورونيداز
- تحقيق تحفيز المبيض مع كل من هرمون تحفيز الجريب (FSH) وموجهة الغدد التناسلية البشرية بعد انقطاع الطمث (hMG). عندما يكون جريب الرصاص >18 مم ، استخدم 10000 وحدة دولية من موجهة الغدد التناسلية المشيمية (hCG) لنضوج البويضة النهائي.
- إجراء استرجاع البويضات بعد 36 ساعة من إطلاق الزناد. التقط البويضات وانقلها إلى أطباق زراعة الأنسجة مع 2.5 مل من m-HTF المسخن مسبقا المغطى بالزيوت المعدنية.
- نقل OCCCs بسرعة إلى البئر المركزي لطبق زراعة الأعضاء الذي يحتوي على 1 مل من وسط الإخصاب باستخدام ماصة نقل ثم احتضانها مع البويضات عند 37 درجة مئوية في حاضنة CO2 5٪ و 5٪ O 2 لمدة2-4 ساعات.
- هضم OCCCs مع الهيالورونيداز عن طريق إضافة 1 مل من 37 درجة مئوية هيالورونيداز مسخن مسبقا (80 وحدة دولية / مل) إلى البئر المركزي لطبق زراعة الأعضاء الذي يحتوي على OCCCs (الخطوة 2.1.3). حافظ على التركيز النهائي للهيالورونيداز عند 40 وحدة دولية / مل واخلطه جيدا.
- احتضان OCCCs على منصة حرارية 37 درجة مئوية لمدة 2 دقيقة. راقب التغييرات تحت المجهر كل 30 ثانية حتى بقيت 1-2 طبقات فقط من الخلايا الحبيبية.
- تعرية الخلايا الحبيبية
- انقل OCCCs المهضومة بسرعة في طبق الاستزراع للتعامل مع البويضات وقم بتغطيتها بالزيت المعدني في كل بئر.
- مراقبة الخلايا الحبيبية المنفصلة تحت المجهر. استنشاق بلطف وإطلاق البويضات 5 مرات لإزالة الخلايا الحبيبية المتبقية حول البويضات.
- كرر الخطوة السابقة في الآبار ال 3 المتبقية لإزالة الخلايا الحبيبية تماما.
ملاحظة: يمكن تنفيذ الخطوات المذكورة أعلاه (2.1-2.3) وفقا للتشغيل الروتيني لكل مختبر.
- تقييم البويضة
- تقييم اكتمال إزالة الخلايا الحبيبية باستخدام المجهر. إذا تعذر إزالة الخلايا بالكامل ، فإن الاحتفاظ ب 5 خلايا حبيبية أو أقل يكون مقبولا في هذا الوقت.
ملاحظة: إذا كانت الخلايا الركامية لا تزال مرتبطة بالبويضة ، فيمكن إزالة البقايا في وقت لاحق من اليوم 3 قبل نقل الجنين من وسط زراعة مرحلة الانقسام إلى وسط ثقافة مرحلة الكيسة الأريمية.
- تقييم اكتمال إزالة الخلايا الحبيبية باستخدام المجهر. إذا تعذر إزالة الخلايا بالكامل ، فإن الاحتفاظ ب 5 خلايا حبيبية أو أقل يكون مقبولا في هذا الوقت.
- بعد إجراء حقن الحيوانات المنوية داخل الهيولى (ICSI)26 ، قم بنقل البويضات إلى قطرات دقيقة متوسطة لزراعة الجنين 20-30 ميكرولتر (خلية بويضة واحدة تتوافق مع قطرة دقيقة واحدة) باستخدام ماصات نقل واحتضانها في حاضنة 37 درجة مئوية و 5٪ CO 2 و 5٪ O2.
- سجل يوم الحقن المجهري كيوم 0. تحقق من الأجنة وسجل وفقا لورشة عمل إجماع اسطنبول حول تقييم الأجنة في اليوم 1 للتخصيب (حوالي 18 ساعة) واليوم 2 (حوالي 45 ساعة) واليوم 3 (حوالي 68 ساعة) لانقسام الجنين27.
- غسل الأجنة
- تحضير 20-30 ميكرولتر من قطرات ميكرويرات متوسطة لزراعة الكيسة الأريمية لكل جنين مغطى بالزيت المعدني في أطباق زراعة الأنسجة في اليوم الثاني في حاضنة 37 درجة مئوية و 5٪ CO 2 و 5٪ O2.
- قم بإعداد ثلاث قطرات صغيرة أخرى مغطاة بالزيت المعدني ، وقم بتسمية أطباق زراعة الأنسجة الجديدة للغسيل رقم 1-3.
- نقل الأجنة اليوم 3 في قطرات الغسيل الدقيقة. نضح بلطف وحرر الأجنة 3 مرات في كل قطرة باستخدام ماصات التعرية.
ملاحظة: يمكن أن يساعد هذا الإجراء أيضا في إزالة الخلايا الحبيبية المتبقية المرتبطة بالجنين. - مراقبة وتقييم الأجنة تحت المجهر في اليوم 3 قبل تغيير الوسط من وسط ثقافة مرحلة الانقسام إلى وسط زراعة الكيسة الأريمية للتسجيل المورفولوجي. إذا كانت الخلايا الركامية لا تزال ملتصقة بالجنين ، فقم بماصة مناسبة لأعلى ولأسفل في قطرة متوسطة أخرى لثقافة الكيسة الأريمية مسخنة مسبقا ومتوازنة مغطاة بالزيت المعدني مع ماصة متجرد حتى تتم إزالة الخلايا الركامية تماما.
ملاحظة: كان لا بد من إزالة جميع الخلايا الركامية المرفقة بالكامل في اليوم 3 قبل نقل الجنين من الصفيحة المتوسطة لمرحلة الانقسام إلى الصفيحة المتوسطة لثقافة الكيسة الأريمية. أي خلايا ركامية متبقية سوف تتداخل في التحليل النهائي وتعطي نتائج سلبية خاطئة.
- خياران لجمع الثقافة المتوسطة
ملاحظة: يمكن لمركز التلقيح الاصطناعي الاختيار من بين طريقتين لجمع وسط الثقافة بناء على موارد المركز ومطالبه وتفضيلاته.- الخيار 1: غسل الأجنة وزراعتها
ملاحظة: هذا الخيار مخصص لمختبرات التلقيح الاصطناعي التي تقوم بالتزجيج في صباح اليوم 5.- انقلي الجنين إلى قطرات دقيقة مسخنة مسبقا (37 درجة مئوية) من وسط الاستزراع، واغسلي كل جنين برفق بشكل متسلسل في 3 قطرات دقيقة عن طريق السحب في اليوم 4 بعد الظهر.
- نقل كل جنين إلى قطرة صغيرة فريدة من نوعها (37 درجة مئوية) من وسط الاستزراع لجمع العينات. لا يمكن أن يتجاوز حجم قطرة واحدة من وسط الاستزراع 25 ميكرولتر.
- إجراء زراعة أجنة الكيسة الأريمية في اليوم 5/اليوم 6 عند 37 درجة مئوية، 5٪ CO 2، 5٪ O2.
- الخيار 2: غسل الأجنة وزراعتها
ملاحظة: هذا الخيار مخصص لمختبرات التلقيح الاصطناعي التي تقوم بالتزجيج في اليوم 5 بعد الظهر أو اليوم 6.- انقل الجنين إلى قطرات دقيقة مسخنة مسبقا (37 درجة مئوية) من وسط زراعة 10-15 ميكرولتر ، واغسل كل جنين برفق بشكل متسلسل في 3 قطرات صغيرة عن طريق السحب في اليوم الخامس.
- نقل كل جنين إلى قطرة صغيرة فريدة من نوعها (37 درجة مئوية) من وسط الاستزراع لجمع العينات. لا يمكن أن يتجاوز حجم قطرة واحدة من وسط الاستزراع 15 ميكرولتر.
- إجراء زراعة أجنة الكيسة الأريمية في اليوم 5 / اليوم 6 عند 37 درجة مئوية و 5٪ CO2.
- الخيار 1: غسل الأجنة وزراعتها
- جمع العينات
- اضبط ICM برفق على مسافة كبيرة من النقطة المستهدفة لشعاع الليزر ، والتي تركز على تقاطع الخلايا في الأديم الظاهر الغاذ لتوليد ثقب صغير في الأديم الظاهر الغاذ لإطلاق السائل من تجويف الأريم. ثم يتم نقل الأجنة إلى محلول التجميد للحفظ بالتبريد وفقا للعملية التقليدية.
- نقل وسط الاستزراع من كل جنين مزروع إلى أنبوب تفاعل البوليميراز المتسلسل الخالي من RNase / DNase الذي يحتوي على 5 ميكرولتر من محلول تحلل الخلية.
- اجمع نفس الكمية من وسط الاستزراع دون استخدامه لزراعة الأجنة كعنصر تحكم سلبي. تجميد جميع العينات المجمعة فورا في النيتروجين السائل ثم تخزينها في درجة حرارة -80 درجة مئوية بعد جمعها حتى تخضع لفحص النظام الوطني للإحصاء (NICS).
- قم بإجراء التزجيج كما هو موضح في البروتوكول.
3. البروتوكول 2: بناء المكتبة
- ثقافة تحلل المتوسطة
- تمييع 1 ميكرولتر من التحكم الإيجابي (10 نانوغرام من الحمض النووي البشري) مع 199 ميكرولتر من وسط الاستزراع الطازج. تخلط جيدا وأجهزة الطرد المركزي الأنبوب لفترة وجيزة (200 × غرام لمدة 5 ثوان).
- انقل 10 ميكرولتر من وسط زراعة الكيسة الأريمية لمدة 5 أيام 6 ، والتحكم الإيجابي المخفف ، ووسط الاستزراع الطازج إلى أنابيب PCR جديدة سعة 0.2 مل.
- أضف 1 ميكرولتر من MT Enzyme Mix إلى كل أنبوب PCR واخلطه جيدا عن طريق السحب والطرد المركزي على الفور لمدة 2-3 ثوان عند 200 × جم.
- ضع أنبوب (أنابيب) تفاعل البوليميراز المتسلسل من الخطوة 3.1.3 في محطة تحضير العينات NICS المسخنة مسبقا وقم بتشغيل برنامج التحلل على النحو التالي: 10 دقائق عند 75 درجة مئوية ؛ 4 دقائق عند 95 درجة مئوية ؛ يمسك عند 22 درجة مئوية.
ملاحظة: محطة تحضير العينة قابلة للمقارنة مع آلة PCR القياسية.- انقر فوق أيقونة Lysis للدخول إلى شاشة الإعداد.
- حدد أنبوب لوضع التحكم ؛ إدخال 10 ميكرولتر لحجم العينة ؛ حدد تشغيل للتحكم في Hotlid وأدخل 105 درجة مئوية لدرجة الحرارة. حدد لا للإيقاف المؤقت عند أول seg. انقر OK المضي قدما.
- انتظر حتى يظهر وقت البقاء --:- -:--، مما يشير إلى نهاية البرنامج، ثم انقر فوق إيقاف لإنهاء البرنامج.
- أوقف البرنامج بعد اكتمال العملية. انتقل إلى الخطوة التالية على الفور.
- التحضير قبل المكتبة
- قم بإذابة المخزن المؤقت Pre-Lib إلى RT. امزج جيدا عن طريق السحب والطرد المركزي على الفور لمدة 2-3 ثوان عند 200 × جم.
- قم بإعداد مزيج رئيسي لتفاعل ما قبل المكتبة على النحو التالي: أضف 2 ميكرولتر من مزيج إنزيم Pre-Lib إلى 60 ميكرولتر من Pre-Lib Buffer ، وامزج التفاعل جيدا وأجهزة الطرد المركزي لفترة وجيزة.
- أضف 60 ميكرولتر من مزيج تفاعل ما قبل المكتبة إلى كل عينة وسط معالج مسبقا من الخطوة السابقة. تخلط جيدا عن طريق السحب والطرد المركزي على الفور لمدة 2-3 ثوان عند 200 × جم.
- ضع أنبوب (أنابيب) تفاعل البوليميراز المتسلسل من الخطوة 3.2.3 في محطة إعداد العينات وقم بتشغيل برنامج ما قبل المكتبة على النحو التالي: 95 درجة مئوية لمدة دقيقتين ؛ 12 دورة من 15 درجة مئوية لمدة 40 ثانية ، 22 درجة مئوية لمدة 40 ثانية ، 33 درجة مئوية لمدة 30 ثانية ، 65 درجة مئوية لمدة 30 ثانية ، 72 درجة مئوية لمدة 40 ثانية ، 95 درجة مئوية لمدة 10 ثوان و 63 درجة مئوية لمدة 10 ثوان ؛ وعقد عند 4 درجات مئوية.
- انقر فوق رمز Pre_Lib للدخول إلى شاشة الإعداد.
- حدد أنبوب لوضع التحكم ؛ إدخال 70 ميكرولتر لحجم العينة ؛ حدد تشغيل للتحكم في الغطاء الساخن وأدخل 105 درجة مئوية لدرجة الحرارة. حدد لا للإيقاف المؤقت عند أول seg. انقر OK المضي قدما.
- انتظر حتى يظهر وقت البقاء --:- -:--، مما يشير إلى نهاية البرنامج، وانقر فوق إيقاف لإنهاء البرنامج.
- أوقف البرنامج عند اكتمال العملية. انتقل إلى الخطوة التالية على الفور.
- إعداد المكتبة
- قم بإذابة المخزن المؤقت للمكتبة إلى RT. امزج جيدا عن طريق السحب والطرد المركزي على الفور لمدة 2-3 ثوان عند 200 × جم.
- قم بإعداد مزيج رئيسي لتفاعل المكتبة على النحو التالي: أضف 1.6 ميكرولتر من مزيج إنزيم المكتبة إلى 60 ميكرولتر من Library Buffer ، وامزج التفاعل جيدا وأجهزة الطرد المركزي لفترة وجيزة.
- أضف 60 ميكرولتر من مزيج تفاعل المكتبة و 2 ميكرولتر من كتاب الباركود التمهيدي إلى كل منتج ما قبل المكتبة من الخطوة 3.2.3. خلط رد الفعل جيدا وأجهزة الطرد المركزي لفترة وجيزة.
- ضع أنبوب (أنابيب) PCR من الخطوة 3.2.3 في برنامج إعداد الدورة الحرارية وقم بتشغيل برنامج إعداد المكتبة على النحو التالي: 94 درجة مئوية لمدة 30 ثانية ؛ 17 دورة من 94 درجة مئوية لمدة 25 ثانية ، و 62 درجة مئوية لمدة 30 ثانية ، و 72 درجة مئوية لمدة 45 ثانية) ؛ ثم امسك عند 4 درجات مئوية.
- انقر فوق رمز Lib_Prep للدخول إلى شاشة الإعداد.
- حدد أنبوب لوضع التحكم ؛ إدخال 130 ميكرولتر لحجم العينة ؛ حدد تشغيل للتحكم في Hotlid وأدخل 105 درجة مئوية لدرجة الحرارة المقابلة. حدد لا للإيقاف المؤقت عند أول seg. انقر OK المضي قدما.
- انتظر حتى يظهر وقت البقاء --:- -:--، مما يشير إلى نهاية البرنامج، وانقر فوق إيقاف لإنهاء البرنامج.
- تنقية المكتبة
- قم بإزالة Magbeads من التخزين على حرارة 2-8 درجة مئوية لمدة 20 دقيقة على الأقل قبل خطوة التنقية. دوامة وخلط Magbeads لمدة 20 ثانية. قم بتوزيع حبات كافية لخطوة التنقية في أنبوب طرد مركزي دقيق جديد سعة 1.5 مل وخرز دافئ إلى RT.
- أضف 1x Magbeads إلى كل مكتبة. امزج عن طريق سحب السحب لأعلى ولأسفل ≥10 مرات واحتضانه في RT لمدة 5 دقائق.
ملاحظة: على سبيل المثال، إضافة 100 ميكرولتر من Magbeads إلى 100 ميكرولتر من عينة المكتبة. - بعد الحضانة ، قم بطرد الأنبوب لفترة وجيزة ووضعه على حامل مغناطيسي.
- انتظر لمدة 5 دقائق تقريبا حتى يصبح الحل واضحا. مع إبقاء الأنبوب على الحامل المغناطيسي ، قم بشفط المحلول بعناية وتجاهله.
- أضف 200 ميكرولتر من الإيثانول الطازج بنسبة 80٪ إلى الأنبوب. احتضان في RT لمدة 30 ثانية وإزالة بعناية طف. كرر مرة أخرى.
- إزالة الإيثانول تماما قدر الإمكان. جفف الخرزات في الهواء على الحامل المغناطيسي لمدة 5-10 دقائق تقريبا في RT.
- قم بإزالة الأنبوب من الحامل المغناطيسي ، وأضف 17.5 ميكرولتر من محلول الشطف ، ودوامة الأنبوب لإعادة تعليق الخرزات. أجهزة الطرد المركزي الأنبوب لفترة وجيزة واحتضانها في RT لمدة 5 دقائق.
- ضع الأنبوب على الحامل المغناطيسي وانتظر حتى يصبح المحلول واضحا. نقل بعناية 15 ميكرولتر طاف إلى أنبوب جديد.
- القياس الكمي للمكتبة
- قم بقياس المكتبات المنقاة باستخدام مقياس الفلور وفقا لدليل المستخدم الخاص بمجموعات فحص الكيوبت dsDNAHS 28. يتراوح عائد المكتبات من ~ 15 إلى 300 نانوغرام.
- تجميع المكتبة
- استخدم 10 نانوجرام من كل عينة مكتبة للتجميع.
- التسلسل
- راجع دليل مستخدم التسلسل (15027617 v01)29.
- أسفرت تسلسلات المكتبة المنقاة البالغة 50 نقطة أساس في نهاية واحدة على المنصة عن ما يقرب من 2 مليون قراءة لكل عينة ، ويوصى بعمق تسلسل 0.03 ×.
- تحليل البيانات
- أدخل اسم المستخدمين وكلمة المرور في صفحة تسجيل الدخول
- بعد تسجيل الدخول إلى النظام ، انقر فوق تحليل وستظهر صفحة جديدة. انقر فوق إنشاء إرسال ضمن علامة التبويب NICS-A. بعد ذلك ، اختر NGS للنظام الأساسي ، وحدد الشركة ، واختر NICSInst للكاشف ، وأدخل معلومات المشروع في المربع الموجود أسفل معرف المشروع ، وقم بتعيين تفضيلات التحليل وتحميل الملفات. بمجرد تحميل جميع ملفات التسلسل بنجاح ، انقر فوق إرسال لبدء التحليل (الشكل 3 أ).
- انقر فوق عرض الواجبات المرسلة لإظهار قائمة المشاريع المرسلة. بمجرد اكتمال التحليل، ستصبح حالة المشروع مكتمل وسيظهر الزر إظهار في حقل التقرير. انقر فوق الزر " إظهار" لعرض الجدول الموجز لتحليل NICS (الشكل 3B).
- انقر فوق الزر تصدير التقرير لحفظ التقارير (الشكل 3C).
ملاحظة: سيتم تصدير ثلاثة أنواع من الملفات لكل تحليل. ملف رسومي يتضمن جميع مخططات تباين عدد النسخ (CNV) لكل كروموسوم وجينوم كامل ، والتي سيتم تخزينها تحت مجلد "الرسم البياني" ؛ جدول بيانات يحتوي على عينة من تفاصيل مراقبة الجودة لتشغيل التحليل هذا ؛ ملف وثيقة يحتوي على تقارير النظام الوطني للإحصاء التي خصصها المستخدم؛ وجدول بيانات يحتوي على معلومات ملخص نموذجية لتشغيل هذا التحليل.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
طبقت الدراسة الحالية الطريقة المقترحة على المريض. وتم الحصول على موافقة مجلس المراجعة المؤسسية والموافقة المستنيرة قبل تطبيق تحليل النظام الوطني للإحصاء الوطني. حصلت الدراسة الحالية على 6 أكياس أريمية من المرضى وأجرت NICS على جميع الأجنة الستة في اليوم 4 إلى اليوم 5 المتوسط. تم الكشف عن تشوهات الكروموسومات الناجمة عن النقل المتوازن للوالدين في خمسة من الكروموسومات مع اختبار NICS. لذلك ، لا يمكن استخدامها للنقل (الشكل 4A-E). أظهرت نتائج NICS للجنينين نفس النمط النووي 45 ، وكان XN و -18 (×1) كلاهما حذف الكروموسوم 18 (الشكل 4 أ ، ب). النمط النووي 46 ، XN ، -1p (pter→p21.1 ، ×1) هو فقط الذراع القصير لحذف منطقة الكروموسوم 1 pter →p21.1 (الشكل 4D).
أظهرت نتائج NICS النمط النووي 46 و XN و + 1p (pter→p21.2 و ×3) و -18 (q21.32→qter، ×1) ، مما يشير إلى أن كلا من الذراع الطويل للكروموسوم 18 q21.32→qter حذف المنطقة والذراع القصير لمنطقة الكروموسوم 1 pter→p21.2 قد تكررت (الشكل 4E). على الرغم من أن الأنماط النووية 46 و XN و +5q (×4) و -8 (×1 ، mos) هي نسخ مكررة للكروموسوم 5 وتظهر 8 اختلافات في الفسيفساء ، يمكن لفحص NICS فحص جميع الكروموسومات ال 24 بحثا عن اختلال الصيغة الصبغية. توفر هذه العملية طريقة جديدة لنقل الكيسات الأريمية ذات النمط النووي الطبيعي الواحد.

الشكل 1. اكتمال إزالة الخلايا الركامية. أ: البويضات التي تحتوي على خلايا ركامية. ب: البويضات التي لا ترتبط بها خلايا ركامية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2. تتم إزالة الخلايا الركامية من الجنين في D3 قبل نقلها إلى BM. يجب إزالة جميع الخلايا الركامية المرفقة قبل التغيير المتوسط من الصفيحة المتوسطة لزراعة الجنين في الانقسام الأولي إلى الصفيحة المتوسطة لزراعة الكيسة الأريمية ، والتي تكون في اليوم 3 بعد وصول الأجنة إلى مرحلة 8 خلايا. أي خلايا ركامية لم تتم إزالتها سوف تتداخل في التحليل النهائي مما يعطي نتائج سلبية خاطئة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3. تحليل البيانات. (أ) هناك خيارات مختلفة لتطبيق المستخدم. بالنسبة لشركة منصة التسلسل ، يمكن للمستخدمين اختيار Illumina أو Ion Torrent أو MGI. يمكن للمستخدمين اختيار ما إذا كان يتم الإبلاغ عن معلومات الجنس. عند الانتهاء من إعداد المعلمة أعلاه ، انقر فوق المربع الموجود أسفل تحميل الملف واختر ملفات التسلسل المناسبة لتحميلها. بالنسبة إلى Illumina ، اختر الملفات ذات الامتداد fastq.gz. انقر فوق إرسال لبدء التحليل بعد التحميل بنجاح. (ب) عرض الجدول الموجز. ويتألف الجدول الموجز من المعلومات التالية: اسم العينة: يتم سرد اسم كل عينة من عينات نظام NICS؛ مراقبة البيانات (QC): تشير إلى ما إذا كان ملف التسلسل يجتاز مراقبة الجودة لتحليل نظام NICS؛ الذكاء الاصطناعي التقدير: التقدير (ألف أو باء أو جيم) لكل عينة من عينات النظام الوطني للإحصاء الوطني؛ الذكاء الاصطناعي_تفسير التقييم: تقييم إمكانية زرع الجنين. الذكاء الاصطناعي الدرجات: درجة كل عينة من عينات النظام الوطني للإحصاء الوطني؛ مؤامرة CNV (الجينوم الكامل): عرض ملامح CNV لجميع الكروموسومات. (ج) صفحة حفظ التقرير. انقر فوق الزر تصدير التقرير بجوار ملخص النتائج. حدد المعلومات التي تريد عرضها في التقرير النهائي وانقر فوق تصدير. سيتم حفظ التقارير في مجلد التنزيل بجهاز الكمبيوتر الخاص بك. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4. فحص الأجنة واختيارها باستخدام NICS من المريض. وقد تطور ما مجموعه ستة أجنة بنجاح إلى مرحلة الكيسة الأريمية، وجمع وسط استزراع Day4-Day5 من كل جنين لفحص نظام NICS. (أ) و (ب) هي نتائج NICS لجنين الكيسة الأريمية أظهرا نفس النمط النووي 45 ، XN ، -18 (×1) كلاهما حذف الكروموسوم 18. (C) أظهر النمط النووي 46 ، XN ، +5q (×4) ، -8 (×1 ، mos) هو تكرار الكروموسوم 5 و 8 فسيفساء. أظهر (D) النمط النووي 46 ، XN ، -1p (pter→p21.1 ، ×1) هو الذراع القصير فقط لحذف منطقة الكروموسوم 1 pter→p21.1 ، بينما أظهر (E) النمط النووي 46 ، XN ، +1p (pter→p21.2 ، ×3) ، -18 (q21.32→qter ، ×1) هو ذراع قصير من الكروموسوم 1 pter→p21.2 ازدواج المنطقة والذراع الطويل للكروموسوم 18 Q21.32 → أظهرت منطقة Qter (F) تركيبا كروموسوميا متوازنا. المحور x يعني 22 كروموسوما جسميا باللونين الأحمر والأزرق ، ويشير المحور y إلى رقم نسخة كل كروموسوم جسمي. النقاط الرمادية هي مقياس المسطرة لاستجابة رقم النسخ في كل نافذة سلة المهملات ويجب أن يكون النمط النووي العادي لرقم النسخ 2. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول S1. معدلات نجاح الكشف عن الحمض النووي الخيار 1 والخيار 2. الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول S2. التوافق بين نظام NICS و PGT-A في خيارات مختلفة. الرجاء الضغط هنا لتنزيل هذا الجدول.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
التعديلات واستكشاف الأخطاء وإصلاحها
إذا كانت نتائج NICS ملوثة بالمواد الوراثية الأبوية ، فتأكد من إزالة جميع خلايا الركام - كورونا الشعاعي وتأكد من إجراء الحقن المجهري للتخصيب. يتم تجنب التخزين المتوسط غير السليم أو عمليات إعداد القالب ، مما قد يؤدي إلى تدهور الحمض النووي. تم تنقية مساحة العمل تماما باستخدام كواشف إزالة التلوث DNase و RNase. لتجنب التلوث من الأجنة الأخرى ، تم دائما استزراع جنين واحد في قطرة واحدة من الوسط لتجنب التلوث المتبادل بدءا من اليوم 4. يتم تقليل ظاهرة التلوث عند تأخير وضع الأجنة في قطرة الثقافة النهائية30،31،32،33. لتقليل تلوث الأمهات ، قام Kuznyetsov34 بتعديل إجراءات زراعة الأجنة من اليوم 0 إلى اليوم 4 ، بما في ذلك الإزالة الدقيقة لخلايا الهالة المتبقية عن طريق السحب والتنظيف.
يوضح Lane et al.30 أنه عند أخذ وسط زراعة الجنين من اليوم 4 إلى اليوم 5 ، يتم تحسين دقة اكتشاف euploidy ، واتساق الصيغة الصبغية الجنينية أكثر من 95٪ ، واتساق الكروموسوم الجنسي يصل إلى 100٪. وجد Lledo et al.33 أن معدل المصادفة بين وسط الاستزراع لمدة 3 أيام 5 وعينات TE كان 74.6٪ و 92.0٪ عندما تم استزراع الأجنة من اليوم 4 إلى اليوم 6.
تدعم بياناتنا الداخلية أيضا هذا الاستنتاج ، كما هو موضح في الجدول S1. بالمقارنة مع طريقة الاستزراع التقليدية لليوم 3 أيام 5 ، تمت إزالة الخلايا الحبيبية بشكل أكبر بسبب تغيير آخر في وسط الاستزراع في اليوم 4 أو اليوم 5. نحن نقدم بيانات داخلية (الجدول S1) توضح أن طريقتينا (الخيار 1 والخيار 2) تتمتعان باتساق جيد مقارنة ب PGT-A ، وهو أفضل من طريقة أخذ العينات دون إزالة CC بدقة.
ظهرت منتجات IF-amplified في عنصر التحكم السلبي ، وقد تكون مواد الحمض النووي الخارجية قد لوثت الكاشف أو مساحة العمل. يجب تنظيف مساحة العمل بواسطة كواشف إزالة الحمض النووي / الحمض النووي الريبي ، ويجب استخدام مواد خالية من النيوكلياز ، ويجب أن يتم اقتباس الكواشف بعد الاستخدام الأول.
وتناقش الاختلافات في معدلات النجاح بين الخيارين 1 والخيار 2 في الجدول S1 والجدول S2.
حدود مقايسة النظام الوطني للإحصاء
هناك نوعان من القيود الرئيسية لنظام NICS. 1) قبل الحقن المجهري ، يجب إزالة جميع الخلايا الركامية (عادة أصل الأم ، وعادة ما يكون تكوين الكروموسوم الطبيعي). إذا كانت الإزالة غير مكتملة ، فقد تطلق الخلايا الركامية الحمض النووي أثناء نمو الجنين ويتم تضخيم الحمض النووي الخارجي ، والذي قد يكون سبب الكشف السلبي الكاذب. 2) من الصعب إزالة الحيوانات المنوية المرتبطة بالمنطقة الشفافة ، ويوصى بشدة بإجراء NICS باستخدام الحقن المجهري. على الرغم من أن الاستبدال المنتظم لوسائط الانقسام في اليوم 3 قد يقلل من احتمال التلوث بسبب الخلايا الركامية والحيوانات المنوية الزائدة عن الحاجة ، يجب تقليل هذا التلوث إذا تم استخدام NICS في التلقيح الاصطناعي السريري. ومع ذلك، تم تطوير طريقة للكشف عن NICS في أجنة التلقيح الاصطناعي، بما في ذلك وظيفة التعرف على الحمض النووي الخارجي، والتي سيتم إثباتها في المستقبل القريب.
لم تقارن هذه الدراسة الاختلافات بين الوسائط المختلفة لأن التجارب السريرية واسعة النطاق قارنت وسائط الثقافة. استخدمت ثمانية مراكز 4 وسائط استزراع مختلفة ، متسلسلة ومستمرة ، و 2 نسب مختلفة من مكملات الألبومين (5٪ و 10٪) ، ولم يكن لهذه الاختلافات تأثيرات كبيرة على دقة نتائج cfDNA الجنينية31. تدعم هذه النتائج إمكانية تطبيق تحليل cfDNA الجنيني على كل مختبر IVF عند العمل بموجب البروتوكول المحدد.
الأهمية فيما يتعلق بالأساليب الحالية
تتجنب طريقة NICS خزعة الجنين وبالتالي تحسن بشكل كبير من سلامة الاستخدام. بالمقارنة مع الكيسات الأريمية ، فإن NICS هي تقنية فحص بسيطة وموفرة للوقت وحساسة وقابلة للتكرار قبل الزرع ومناسبة للمجموعات التناسلية المساعدة مع احتمال كبير لاختلال الصيغة الصبغية. وخلافا للخزعة الغازية، التي تتطلب معرفة كبيرة ومهنية لإجراء خزعة الكيسة الأريمية، يمكن تطبيق نظام NICS على نطاق واسع لأن مجموعته البسيطة من الوسط المستهلك لا تتبع سوى التشغيل المنتظم ل IVF19 ولا تتطلب تأهيل PGS / PGD في بعض البلدان.
التطبيقات المستقبلية
NICS لديه القدرة على التطبيق على نطاق واسع لفحص الكروموسومات في التلقيح الاصطناعي السريري ، ليس فقط للحقن المجهري ولكن أيضا لأجنة التلقيح الاصطناعي. على الرغم من أن الحقن المجهري يوصى به بشدة ، إلا أن طرق إزالة الحيوانات المنوية المرتبطة بالمنطقة الشفافة مطلوبة لمنع تأثير الحيوانات المنوية.
التقييم المورفولوجي هو طريقة تقليدية لتقييم الأجنة ، ولكن في معظم الحالات ، يمكن أن تظهر الأجنة غير الطبيعية كروموسوميا مشابهة شكليا للأجنة الطبيعية الكروموسومية (euploid). قد يؤدي الجمع بين التقييم المورفولوجي واختبار NICS عند نقل الأجنة الصبغية ذات التشكل الجيد إلى الرحم إلى تحسين معدلات الحمل المستمرة ومعدل المواليد الأحياء. وستجرى تجربة سريرية معشاة لتقييم الفعالية السريرية لنقل جنين واحد باستخدام تكنولوجيا النظام الوطني للإحصاء (NICS).
الخطوات الحاسمة في البروتوكول
يجب إزالة جميع خلايا الركام الهالة الشعاعية من البويضات قبل الإخصاب. تم تخصيب البويضات عن طريق حقن الحيوانات المنوية داخل الهيولى (الحقن المجهري). تم تجنب إضافة البروتينات / المكملات المشتقة من الإنسان إلى وسط الاستزراع. تم تغيير وسط الاستزراع في اليوم 4 وتم جمعه في اليوم 5-اليوم 6 عندما توسعت الكيسات الأريمية بالكامل. تم استزراع الأجنة في قطرات فردية من وسط الثقافة بدءا من اليوم 4. عند جمع وسط الاستزراع ، تم تغيير ماصات النقل بين العينات لتجنب التلوث.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Yaxin Yao و Jieliang Ma و Jing Wang و Sijia Lu هم موظفون في Yikon Genomics Co.، Ltd.
Acknowledgments
يود المؤلفون أن يشكروا Shiping Bo و Shujie Ma على مساعدتهم في تحليل بيانات NGS. التمويل: تم دعم هذا العمل من قبل البرنامج الوطني للبحث والتطوير الرئيسي (رقم المنحة 2018YFC1003100).
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL EP tube, 0.2 mL PCR tube | Axygen | MCT-150-C, PCR-02-C | DNase/RNase free, Low Binding PCR tubes and 1.5 mL micro-centrifuge tubes are recommended. |
| 10 µL, 200 µL, 1000 µL DNase /RNase Free Tips | Axygen | T-300-R-S, T-200-Y-R-S, T-1000-B-R-S | This can be replaced by other brand/For sample transfer |
| 100 % ethanol | Sinopharm Chemical | 10009218 | This can be replaced by other brand/For DNA library purification |
| Barcode Primer1-48 | Yikon Genomics | Reagent in NICSInst library preparation kit | For library amplificaton |
| BD Falcon Organ Culture Dish, Sterile | BD Bioscience | 363037 | This can be replaced by other brand/For embryo culture |
| BD Falcon Tissue culture Dishes (Easy Grip) , Sterile | BD Bioscience | 353001 | This can be replaced by other brand/For embryo culture |
| BD Falcon Tissue culture Dishes, Sterile | BD Bioscience | 353002 | This can be replaced by other brand/For embryo culture |
| Cell Lysis Buffer | Yikon Genomics | Reagent in NICSInst library preparation kit | For culture medium pre-treatment |
| Cell Lysis Enzyme | Yikon Genomics | Reagent in NICSInst library preparation kit | For culture medium pre-treatment |
| ChromGo software | Yikon Genomics | Data analysis | |
| CMPure Magbeads | Yikon Genomics | Reagent in NICSInst library preparation kit | For library purification |
| Cryotop open systerm | KITAZATO BioPharma | 81110 | This can be replaced by other brand/For embryo vitrification |
| Distill water | Yikon Genomics | Reagent in NICSInst library preparation kit | To dissolve DNA |
| ES (Vitrification kit) | KITAZATO BioPharma | Reagent inVitrification kit | This can be replaced by other brand/For embryo vitrification |
| HOLDNIG | ORIGIO | MPH-MED-35 | This can be replaced by other brand/For ICSI |
| Hyaluronidase solution, 80 U/mL | SAGE | ART4007-A | This can be replaced by other brand/Digest oocyte-corona-cumulus complex |
| ICSI | ORIGIO | MPH-35-35 | This can be replaced by other brand/For ICSI |
| Illumina MiSeq® System | Illumina | SY-410-1001 | For library sequencing |
| Incubator | Labotect | Inkubator C16 | This can be replaced by other brand/For embryo culture |
| Library buffer | Yikon Genomics | Reagent in NICSInst library preparation kit | For library amplificaton |
| Library Enzyme Mix | Yikon Genomics | Reagent in NICSInst library preparation kit | For library amplificaton |
| Magnetic Stand | DynaMagTM-2 | 12321D | For library purification |
| Microscope | OLYMPUS | 1X71 | This can be replaced by other brand/For embryo observation |
| Mini-centrifuge | ESSENSCIEN | ELF6 | For separation |
| MT Enzyme Mix | Yikon Genomics | Reagent in NICSInst library preparation kit | For culture medium pre-treatment |
| NICSInst library preparation kit | Yikon Genomics | KT1000800324 | Whole genome amplification and library construction |
| NICSInst Sample Prep Station | Yikon Genomics | ME1001003 | Amplificate DNA |
| Nunc IVF 4-Well Dish | Thermo Scientific | 144444 | This can be replaced by other brand/For embryo washing and blastocyst culture |
| Pasteur Pipette | Oirgio | MXL3-IND-135 | This can be replaced by other brand/For embryo tansfer |
| Pasteur pipettes | ORIGIO | PP-9-1000 | This can be replaced by other brand/For IVF laboratory |
| Pre-Lib Buffer | Yikon Genomics | Reagent in NICSInst library preparation kit | Pre-library preparation |
| Pre-Lib Enzyme | Yikon Genomics | Reagent in NICSInst library preparation kit | Pre-library preparation |
| Qubit® 3.0 Fluorometer | Thermo Scientific | Q33216 | For library quantification |
| Quinn's Advantage Blastocyst Medium | SAGE | ART-1029 | For embryo blastocyst stage culture |
| Quinn's Advantage Cleavage Medium | SAGE | ART-1026 | This can be replaced by other brand/For embryo cleavage stage culture |
| Quinn's Advantage Fertilization Medium | SAGE | ART-1020 | This can be replaced by other brand/For oocyte and sperm fertilization |
| Quinn's Advantage m-HTF Medium with HEPES | SAGE | ART-1023 | This can be replaced by other brand/For embryo clutrure |
| Quinn's Advantage SPS Serum protein Substitute Kit | SAGE | ART-3010 | This can be replaced by other brand/To denude the oocyte |
| Quinn's Advantage Tissue culture mineral oil | SAGE | ART-4008P | This can be replaced by other brand/To cover the culture medium |
| STRIPPER TIPS | ORIGIO | MXL3-IND-135 | This can be replaced by other brand/For denudating granulosa cells |
| Vitrification Cryotop Open systerm | KIZTAZATO | 81111 | This can be replaced by other brand/For embryo vitrification |
| Vitrification kit | KITAZATO BioPharma | VT101 | This can be replaced by other brand/For embryo vitrification |
| Vortexer | Qilinbeier | DNYS8 | Sample mix |
| VS (Vitrification kit) | KITAZATO BioPharma | Reagent inVitrification kit | This can be replaced by other brand/For embryo vitrification |
| ZILOS-tk Laser System | Hamilton Thorne | CLASS 1 laser | This can be replaced by other brand/For artificial blastocoele collapse |
References
- Barlow, P. Early pregnancy loss and obstetrical risk after in-vitro fertilization and embryo replacement. Human Reproduction. 3 (5), 671-675 (1988).
- Munne, S. Chromosome abnormalities and their relationship to morphology and development of human embryos. Reproductive BioMedicine Online. 12 (2), 234-253 (2006).
- Harton, G. L. Diminished effect of maternal age on implantation after preimplantation genetic diagnosis with array comparative genomic hybridization. Fertility and Sterility. 100 (6), 1695-1703 (2013).
- Hodes-Wertz, B. Idiopathic recurrent miscarriage is caused mostly by aneuploid embryos. Fertility and Sterility. 98 (3), 675-680 (2012).
- Keltz, M. D. Preimplantation genetic screening (PGS) with Comparative genomic hybridization (CGH) following day 3 single cell blastomere biopsy markedly improves IVF outcomes while lowering multiple pregnancies and miscarriages. Journal of Assisted Reproduction and Genetics. 30 (10), 1333-1339 (2013).
- Scott, R. T. Jr Blastocyst biopsy with comprehensive chromosome screening and fresh embryo transfer significantly increases in vitro fertilization implantation and delivery rates: a randomized controlled trial. Fertility and Sterility. 100 (3), 697-703 (2013).
- Forman, E. J. In vitro fertilization with single euploid blastocyst transfer: a randomized controlled trial. Fertility and Sterility. 100 (1), 100-107 (2013).
- Yang, Z. Selection of single blastocysts for fresh transfer via standard morphology assessment alone and with array CGH for good prognosis IVF patients: results from a randomized pilot study. Molecular Cytogenetics. 5 (1), 24 (2012).
- Cimadomo, D. The Impact of Biopsy on Human Embryo Developmental Potential during Preimplantation Genetic Diagnosis. BioMed Research International. 2016, 7193075 (2016).
- Scott, R. T. Jr, Upham, K. M., Forman, E. J., Zhao, T., Treff, N. R. Cleavage-stage biopsy significantly impairs human embryonic implantation potential while blastocyst biopsy does not: a randomized and paired clinical trial. Fertility and Sterility. 100 (3), 624-630 (2013).
- Wu, Y. Blastomere biopsy influences epigenetic reprogramming during early embryo development, which impacts neural development and function in resulting mice. Cellular and Molecular Life Sciences. 71 (9), 1761-1774 (2014).
- Zhao, H. C. Aberrant epigenetic modification in murine brain tissues of offspring from preimplantation genetic diagnosis blastomere biopsies. Biology of Reproduction. 89 (5), 117 (2013).
- Zeng, Y. Preimplantation genetic diagnosis (PGD) influences adrenal development and response to cold stress in resulting mice. Cell and Tissue Research. 354 (3), 729-741 (2013).
- Palini, S. Genomic DNA in human blastocoele fluid. Reproductive BioMedicine Online. 26 (6), 603-610 (2013).
- Gianaroli, L. Blastocentesis: a source of DNA for preimplantation genetic testing. Results from a pilot study. Fertility and Sterility. 102 (6), 1692-1699 (2014).
- Stigliani, S., Anserini, P., Venturini, P. L., Scaruffi, P. Mitochondrial DNA content in embryo culture medium is significantly associated with human embryo fragmentation. Human Reproduction. 28 (10), 2652-2660 (2013).
- Stigliani, S. Mitochondrial DNA in Day 3 embryo culture medium is a novel, non-invasive biomarker of blastocyst potential and implantation outcome. Molecular Human Reproduction. 20 (12), 1238-1246 (2014).
- Wu, H. Medium-Based Noninvasive Preimplantation Genetic Diagnosis for Human α-Thalassemias-SEA. Medicine. 94 (12), e669 (2015).
- Xu, J. Noninvasive chromosome screening of human embryos by genome sequencing of embryo culture medium for in vitro fertilization. Proceedings of the National Academy of Sciences. 113 (42), 11907-11912 (2016).
- Capalbo, A. Diagnostic efficacy of blastocoel fluid and spent media as sources of DNA for preimplantation genetic testing in standard clinical conditions. Fertility and Sterility. 110 (5), 870-879 (2018).
- Tobler, K. J. Blastocoel fluid from differentiated blastocysts harbors embryonic genomic material capable of a whole-genome deoxyribonucleic acid amplification and comprehensive chromosome microarray analysis. Fertility and Sterility. 104 (2), 418-425 (2015).
- Magli, M. C. Preimplantation genetic testing: polar bodies, blastomeres, trophectoderm cells, or blastocoelic fluid? Fertility and Sterility. 105 (3), 676-683 (2016).
- Kuznyetsov, V. Evaluation of a novel non-invasive preimplantation genetic screening approach. PLoS One. 13 (5), e0197262 (2018).
- Li, P. Preimplantation Genetic Screening with Spent Culture Medium/Blastocoel Fluid for in Vitro Fertilization. Scientific Reports. 8 (1), 9275 (2018).
- Jiao, J. Minimally invasive preimplantation genetic testing using blastocyst culture medium. Human Reproduction. 34 (7), 1369-1379 (2019).
- Palermo, G. D. Births after intracytoplasmic injection of sperm obtained by testicular extraction from men with nonmosaic Klinefelter's syndrome. New England Journal of Medicine. 338 (9), 588-590 (1998).
- Alpha Scientists in Reproductive, M., & Embryology, E. S. I. G. o. The Istanbul consensus workshop on embryo assessment: proceedings of an expert meeting. Human Reproduction. 26 (6), 1270-1283 (2011).
- Thermo Fisher Scientific. Qubit dsDNA HS Assay Kit. , Available from: https://www.thermofisher.com/order/catalog/product/Q32851?ICID=search-product (2015).
- Miseq system use guide. , Available from: https://support.illumina.com/downloads/miseq_system user _ guide 15027617.html (2016).
- Lane, M. Ability to detect aneuploidy from cell free DNA collected from media is dependent on the stage of development of the embryo. Fertility and Sterility. 108 (3), (2017).
- Rubio, C. Multicenter prospective study of concordance between embryonic cell-free DNA and trophectoderm biopsies from 1301 human blastocysts. American Journal of Obstetrics and Gynecology. 223 (5), 751-751 (2020).
- Rubio, C. Embryonic cell-free DNA versus trophectoderm biopsy for aneuploidy testing: concordance rate and clinical implications. Fertility and Sterility. 112 (3), 510-519 (2019).
- Lledo, B. Consistent results of non-invasive PGT-A of human embryos using two different techniques for chromosomal analysis. Reproductive BioMedicine Online. 42 (3), 555-563 (2021).
- Kuznyetsov, V. Minimally Invasive Cell-Free Human Embryo Aneuploidy Testing (miPGT-A) Utilizing Combined Spent Embryo Culture Medium and Blastocoel Fluid -Towards Development of a Clinical Assay. Scientific Reports. 10 (1), 7244 (2020).
Tags
فحص الكروموسومات ، أجنة الإنسان قبل الزرع ، وسط الثقافة المستهلكة ، جمع العينات ، تحليل الصيغة الصبغية للكروموسومات ، الإخصاب في المختبر (IVF) ، الاختبار الجيني قبل الزرع لاختلال الصيغة الصبغية (PGT-A) ، الأديم الظاهر (TE) ، كتلة الخلية الداخلية (ICM) ، الإيجابيات والسلبيات الكاذبة ، تقنية NICS ، تسلسل الحمض النووي ، أخذ عينات وسط الثقافة ، تضخيم الجينوم الكامل (WGA) ، إعداد المكتبة ، تحليل بيانات NGS ، الحفظ بالتبريد ، مختبر التلقيح الاصطناعيErratum
Formal Correction: Erratum: Chromosome Screening of Human Preimplantation Embryos by Using Spent Culture Medium: Sample Collection and Chromosomal Ploidy Analysis
Posted by JoVE Editors on 10/01/2021.
Citeable Link.
An erratum was issued for: Chromosome Screening of Human Preimplantation Embryos by Using Spent Culture Medium: Sample Collection and Chromosomal Ploidy Analysis. The Protocol and Representaive Results sections were updated.
In the Protocol, step 3.8.2 was updated from:
After logging into the system, click Create Submission under the NICS tab. Then, select the sequencing platform, choose ChromInst for the reagent, enter the project information in the box under Project ID, set the analysis preferences and upload the files. Once all sequencing files are successfully uploaded, click Submit to start the analysis (Figure 3A).
to:
After logging into the system, click Create Submission under the NICS-A tab. Then, choose NGS for the platform, select corporation, choose ChromInst for the reagent, enter the project information in the box under Project ID, set the analysis preferences and upload the files. Once all sequencing files are successfully uploaded, click Submit to start the analysis (Figure 3A).
In the Representative Results, Figure 3 was updated from:
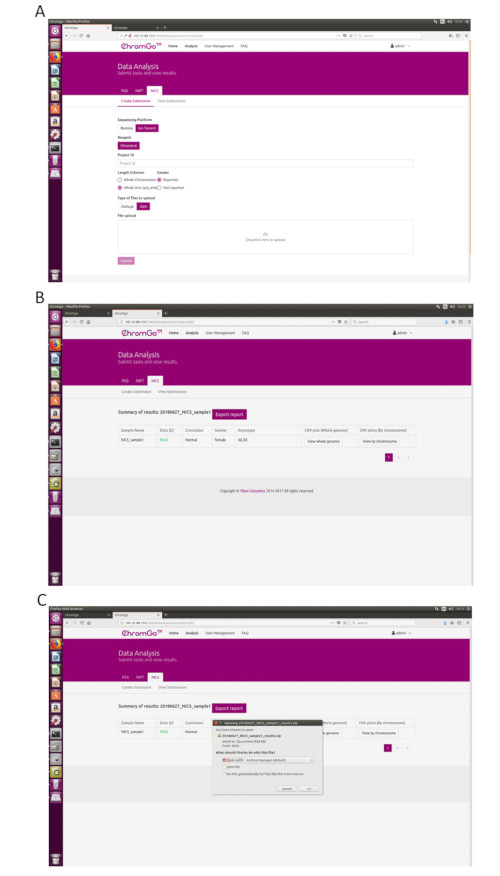
Figure 3. Data Analysis. (A) The page of Create Submission. There are different options for the user application. For sequencing platform, users can choose Illumina or Ion Torrent. For analysis criterion, there are two length detection resolution for selection, the whole chromosome and whole arm level. The users also can choose whether the mosaicism or gender information is reported. Finished the above parameter setting,click on the box under File upload and choose the appropriate sequencing files to upload. For Illumina, choose the files with an extension of fastq.gz. For Ion Torrent platform, choose files with an extension of bam. Click Submit to start the analysis after successfully upload. (B) The view of summary table. The summary table consists of following information: Sample Name: The name of each NICS sample is listed; Data QC: Indicates whether the sequencing file passes the QC for NICS analysis; Conclusion: Indicates whether the NICS analysis is normal or abnormal, "N/A" indicates no conclusive result is available; Gender: If the user chooses to report the sex information, this column will appear in the summary table; Karyotype: Shows the analysis results; CNV plot (Whole Genome): View the CNV profiles of all chromosomes; CNV plot (By Chromosome): View the CNV profiles of each chromosome. (C) The Save Report Page. Click Export report button next to the Summary of Results. Select the information you want to show on the final report and click Export. Select Save File in the appearing dialog window and then click OK. The reports will be saved to the Download folder of the computer. Please click here to view a larger version of this figure.
to:
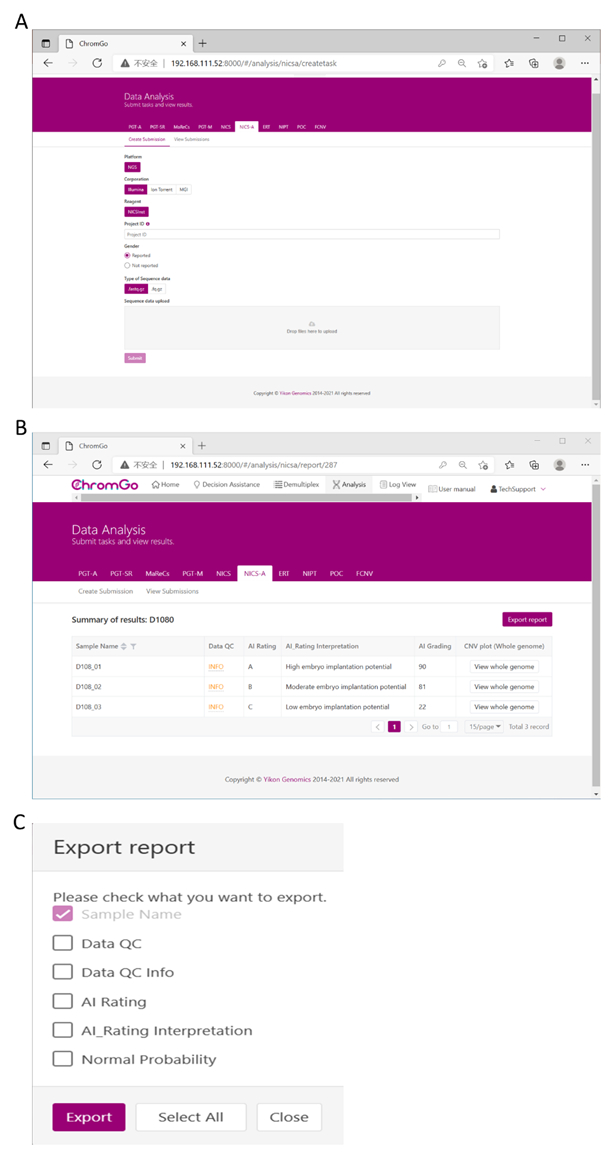
Figure 3. Data Analysis. (A) There are different options for the user application. For sequencing platform corporation, users can choose Illumina, Ion Torrent or MGI. The users can choose whether the gender information is reported. Finished the above parameter setting, click on the box under File upload and choose the appropriate sequencing files to upload. For Illumina, choose the files with an extension of fastq.gz. Click Submit to start the analysis after successfully upload. (B) The view of summary table. The summary table consists of following information: Sample Name: The name of each NICS sample is listed; Data QC: Indicates whether the sequencing file passes the QC for NICS analysis; AI Rating: The rating (A, B or C) for each NICS sample; AI_Rating Interpretation: Evaluation of embryo implantation potential; AI Grading: The score for each NICS sample; CNV plot (Whole Genome): View the CNV profiles of all chromosomes; (C) The Save Report Page. Click Export report button next to the Summary of Results. Select the information you want to show on the final report and click Export. The reports will be saved to the Download folder of your computer. Please click here to view a larger version of this figure.



