ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
여기에서 우리는 출생 후 뇌 발달 과정에서 마우스 소뇌에서 과립 뉴런의 시냅스 형성을 시각화하는 방법을 설명합니다.이 세포는 시냅스 구조를 개선하고 시냅스를 형성하여 전체 뇌 회로에 통합됩니다.
Abstract
뉴런은 뇌 발달 과정에서 구조와 기능에 역동적인 변화를 일으켜 다른 세포와 적절한 연결을 형성합니다. 설치류 소뇌는 시간이 지남에 따라 단일 세포 유형인 소뇌 과립 뉴런(CGN)의 발달과 형태 형성을 추적하는 이상적인 시스템입니다. 여기에서, 발달 중인 마우스 소뇌에서 과립 뉴런 전구체의 생체 내 전기천공을 사용하여 후속 형태학적 분석을 위해 세포를 드물게 라벨링했습니다. 이 기술의 효능은 CGN 성숙의 주요 발달 단계를 보여주는 능력에서 입증되며, 특히 이러한 세포가 시냅스 입력의 대부분을 받는 특수 구조인 수지상 발톱의 형성에 중점을 둡니다. 소뇌 발달 전반에 걸쳐 CGN 시냅스 구조의 스냅샷을 제공하는 것 외에도, 이 기술은 관심 유전자의 역할과 CGN 형태, 발톱 발달 및 시냅스 생성에 미치는 영향을 연구하기 위해 세포 자율적 방식으로 과립 뉴런을 유전적으로 조작하는 데 적용할 수 있습니다.
Introduction
뇌 발달은 배아 발생에서 출생 후의 삶으로 확장되는 장기간의 과정입니다. 이 기간 동안 뇌는 수상 돌기와 축삭 사이의 시냅스 배선을 조각하여 궁극적으로 행동을 유도하는 내적 자극과 외적 자극의 조합을 통합합니다. 설치류 소뇌는 단일 뉴런 유형인 소뇌 과립 뉴런(CGN)의 발달이 전구 세포에서 성숙한 뉴런으로 전환될 때 추적할 수 있기 때문에 시냅스가 어떻게 발달하는지 연구하는 이상적인 모델 시스템입니다. 이는 부분적으로는 소뇌 피질의 대부분이 출생 후 발달하여 출생 후 유전자 조작과 세포 표지가 용이하기 때문입니다1.
포유류에서 CGN 분화는 후뇌의 증식 세포 하위 집합이 마름모꼴 입술 위로 이동하여 소뇌 표면에 2차 발아 영역을 형성할 때 배아 발달이 끝날 때 시작됩니다 2,3,4. 과립 뉴런 전구체(GNP) 정체성에 완전히 전념하지만, 이 세포는 출생 후 14일(P14)까지 외부 과립층(EGL)의 바깥쪽 부분 내에서 계속 증식합니다. 이 층의 증식은 소뇌의 대규모 확장을 초래하는데, 이 세포들은 독점적으로 CGN을 생성하기 때문이다5. 신생아 CGN이 EGL에서 세포주기를 종료하면 내부 과립 층 (IGL)을 향해 안쪽으로 이동하여 소뇌의 분자 층에서 분기되고 이동하는 축삭을 남기고 Purkinje 세포에 시냅스하는 평행 섬유를 형성합니다6. 분자층 내에서 이러한 섬유의 위치는 세포주기 종료 타이밍에 따라 달라집니다.
먼저 분화하는 CGN은 분자층의 바닥을 향해 평행 섬유를 남기는 반면, 나중에 분화하는 CGN의 축삭은 상단 7,8에 클러스터링됩니다. CGN 세포체가 IGL에 도달하면 수상돌기를 정교하게 만들고 근처의 억제성 및 흥분성 뉴런과 시냅스를 형성하기 시작합니다. CGN의 성숙한 수지상 나무는 네 가지 주요 프로세스를 가진 고정 관념의 아키텍처를 보여줍니다. CGN 성숙 과정에서 이 수상돌기 끝에 있는 구조는 시냅스후 단백질 9,10이 풍부해지는 발톱을 형성합니다. 수지상 발톱이라고 하는 이러한 특수 구조는 과립 뉴런에 대한 대부분의 시냅스를 포함하며 뇌교에서 유래한 이끼 낀 섬유 신경 분포의 흥분성 입력과 국소 골지 세포의 억제 입력을 모두 수신하는 데 중요합니다. 일단 완전히 구성되면 CGN의 시냅스 연결을 통해 이러한 세포는 소뇌 전 핵에서 Purkinje 세포로 입력을 전달할 수 있으며, 이는 소뇌 피질에서 깊은 소뇌 핵으로 돌출됩니다.
GNP의 생체 내 출생 후 전기천공법은 원하는 구성물의 발현이 빠른 타임라인에서 달성될 수 있고 이 방법이 작은 세포 집단을 표적으로 하기 때문에 바이러스 감염 및 형질전환 마우스 라인의 생성과 같은 다른 표지 기반 방법보다 유리하며, 세포 자율 효과를 연구하는 데 유용합니다. 이 방법은 CGN의 형태학적 발달을 연구하기 위해 이전 연구에서 사용되었습니다. 그러나 이러한 연구는 단일 시점 또는 짧은 시간창 9,10,11,12,13에 초점을 맞췄습니다. 이 라벨링 방법은 출생 후 첫 3주 동안 CGN 분화의 전체 시간 과정에서 발생하는 CGN 형태의 변화를 문서화하기 위해 이미지 분석과 짝을 이루었습니다. 이 데이터는 소뇌 회로의 구성의 기초가 되는 CGN 수상돌기 발달의 역학을 보여줍니다.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
참고: 모든 절차는 Duke University IACUC(Institutional Animal Care and Use Committee)에서 승인한 프로토콜에 따라 수행되었습니다.
1. 생체 내 전기천공법(in vivo electroporation) 또는 IVE를 위한 DNA 준비(수술 1일 전)
- 정제된 DNA(동물당 0.5-25μg), 3M 아세트산나트륨, 에탄올, 패스트 그린 염료, 초순수 증류수, 인산염 완충액(PBS)(재료 표 참조)을 수집합니다.
참고: DNA의 경우, 인간 유비퀴틴 프로모터 하에서 녹색 형광 단백질(GFP)을 발현하는 구축물을 Addgene(FUGW, https://www.addgene.org/14883/)으로부터 입수하였다. 유비쿼터스 프로모터의 제어 하에 GFP 또는 다른 형광 단백질을 발현하는 임의의 구축물은 작동해야 한다. 이 기술을 사용한 CGN 특정 라벨링은 구조에 의존하지 않고 전기천공에 의존합니다. - 원하는 양의 DNA, 10 부피 %의 3 M 아세트산 나트륨 및 250 부피 %의 100 % 얼음 차가운 에탄올을 혼합하여 전기 천공을 위해 DNA를 준비합니다. DNA는 용액에서 즉시 침전됩니다.
- DNA 혼합물을 -20°C에서 하룻밤 동안 또는 -80°C에서 1시간 동안 계속 침전시킨다.
- 펠렛 침전 DNA를 탁상용 원심분리기에서 >16,000 × g 으로 70% 에탄올로 2회 세척한다.
- DNA 펠릿이 완전히 건조되도록 하고 1x PBS + 0.02% Fast Green 용액으로 재구성합니다.

그림 1: 스페이서를 사용하여 주입 깊이를 1.5mm로 제한. (A) 면도날을 사용하여 로딩 피펫에서 11.2mm 세그먼트를 절단합니다. (B) 스페이서를 해밀턴 주사기 끝 부분(총 길이 1.27cm 또는 0.5인치)에 끼우고 접착제 또는 파라필름으로 고정합니다. 노출된 팁의 길이는 1.5mm여야 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 생후 7일 된 생쥐에서 과립 뉴런 전구체의 생체 내 전기천공법
참고: 모든 전기천공 수술은 환기가 잘 되는 멸균 수술실에서 수행되었으며 모든 직원은 장갑, 안면 마스크, 헤어 보닛, 가운 및 신발 커버를 포함한 완전한 개인 보호 장비를 착용했습니다. 또는 통풍이 잘되고 멸균 된 후드에서 수술을 수행 할 수 있습니다.
- 다음 자료를 수집하십시오: 전기천공용 DNA, 소형 수술용 가위, 소형 수술용 핀셋, 맞춤형 해밀턴 주사기, 면봉 어플리케이터, 히팅 패드, 베타딘, 70% 에탄올, 1x PBS, 파라필름, 조직 접착제(n-부틸-에스테르 시아노아크릴레이트), 이소플루란, 전기천공기 및 핀셋 유형 전극( 재료 표 참조).
- 멸균된 로딩 팁에서 스페이서를 잘라 해밀턴 주사기에 맞도록 하여 주입 깊이를 1.5mm로 제한합니다(그림 1A, B). 접착제 또는 파라필름으로 스페이서를 고정합니다.
- P7 강아지를 이소플루란 챔버에서 0.8L/min의 전달 속도로 마취합니다. 호흡 감소와 발가락 또는 꼬리 꼬집음 반응의 부족에 대해 동물을 모니터링하여 완전한 마취를 확인합니다(그림 2A).
- 동물이 완전히 마취되면 새끼를 코 콘이 장착된 받침대에 놓고 4L/min의 전달 속도로 일정한 0.8% 이소플루란을 전달합니다. 베타 딘의 멸균 면봉으로 강아지의 머리 꼭대기를 3 번 청소 한 다음 70 % 에탄올을 번갈아 가며 두 부위를 준비합니다. 계속하기 전에 용액을 건조시키십시오.
- 멸균된 가위를 사용하여 귀 위쪽에서 아래쪽까지의 거리를 한 번에 잘라서 뒷뇌를 드러냅니다(그림 2B).
- 소뇌(그림 2C)를 찾아 해밀턴 주사기의 노출된 끝을 뇌에 수직인 두개골을 통해 삽입하고 주사기의 뒤쪽 플런저를 천천히 밀어 소뇌 실질에 DNA 혼합물 1.5μL를 주입합니다. DNA 혼합물을 전달한 후 바늘을 천천히 뒤로 당겨 역유출을 방지하고 DNA 용액이 30초 동안 확산되도록 합니다.
- 이소플루란을 끄고 강아지를 37°C 가열 패드에 놓습니다. 양쪽 끝을 멸균된 1x PBS에 담궈 전기천공을 위한 핀셋더 유형 전극을 준비합니다.
알림: 핀셋형 전극을 적시면 전기 펄스를 투여하는 동안 강아지 피부에 접촉 화상을 입는 것을 방지할 수 있습니다. - 플러스 끝이 아래를 향하고 음극 끝이 동물의 머리 위를 향하도록 주사 부위 위의 핀셋 전극을 향하게 합니다(그림 2D). 다음 설정으로 electroporator에서 5개의 전기 펄스를 관리합니다: 50ms, 130V 및 950ms 펄스 간 간격.
알림: 필요한 경우 테스트 주입을 수행하여 주사 부위가 소뇌 vermis에 있는지 확인합니다(그림 2E). - 절개 부위를 꼬집어 봉합하고, 무독성 n-부틸-에스테르 시아노아크릴레이트 조직 접착제로 상처를 밀봉한다. 미량의 혈액이 부모의 영아 살해 및 식인 풍습의 가능성을 증가시키므로 70% 에탄올로 상처를 닦으십시오.
- 강아지를 댐으로 돌려보내기 전에 동물이 37°C 가열 패드에서 회복되도록 합니다. 수술 후 최소 30시간 동안 2분마다 강아지를 모니터링하여 완전한 회복을 보장합니다.
알림: 부모 중 한 사람에 의한 영아 살해는 매우 일반적입니다. 식인 풍습을 방지하려면 전기 천공을 시작하기 전에 폐하를 다른 케이지에 보관하고 항상 청소하고 회수한 새끼(즉, 핏자국 없음, 완전히 움직일 수 있음)를 원래 침구의 원래 케이지로 되돌립니다. 새끼는 피 냄새를 최소화하기 위해 원래 케이지의 배설물로 닦을 수도 있습니다. 원래 댐이 계속해서 새끼를 잠식하는 경우 대리 댐을 사용해야 할 수 있습니다.

그림 2: P7 야생형 마우스 새끼에서 과립 뉴런 전구체의 생체 내 소뇌 전기천공. (A) 새끼는 DNA 용액을 주입하는 동안 마취를 보장하기 위해 0.8L/min의 속도로 전달되는 4% 이소플루란으로 마취됩니다. 이소플루란은 0.8L/min의 속도로 전달됩니다. (B) 베타딘과 70% 에탄올로 마우스를 3회 살균한 후 귀의 거리에 걸쳐 절개를 하여 후뇌를 드러냅니다. (C) 주사 부위의 랜드마크인 두개골의 흰색 경계를 확대한 이미지. DNA 구조는 표시에서 1mm 이내에 주입해야 합니다. 점선은 경계를 나타내고 검은색 화살표는 주사 부위를 나타냅니다. 소뇌 vermis의 융기 부분이 보일 수 있으며 주사 부위를 찾는 데 유용 할 수 있습니다. (D) 효율적인 전기천공을 위한 핀셋형 전극 방향. 플러스(+) 끝은 전기 펄스를 투여하기 전에 음전하를 띤 DNA를 소뇌 실질로 끌어당기기 위해 아래쪽을 향해야 합니다. (E) 0.02% Fast Green 염료 1μL의 테스트 주입은 주사가 소엽 5-7 사이의 소뇌 vermis의 중간에 국한되어 있음을 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 전기천공된 CGN의 면역조직화학
- 이소플루란, PBS 1개, 파라포름알데히드(PFA) 4%, 자당 30%, 일반 염소 혈청, 비이온성 세제, 유리 슬라이드, 유리 커버슬립, 매니큐어, 마운팅 미디어, Hoechst 핵 염료 및 적절한 1차 및 2차 항체(재료 표 참조).
- 이소플루란으로 실험동물을 마취시키고 발가락과 꼬리 핀치로 완전 마취를 확인합니다.
- 1x PBS와 4% PFA를 동물 심장의 좌심실에 천천히 주입하여 경심 관류를 수행합니다. 대정맥을 절단하여 동물에게서 혈액이 배출되도록하십시오.
- 뇌를 4°C에서 4% PFA에 담가 밤새 고정합니다. 다음 날, 뇌를 1x PBS로 빠르게 헹구고 최소 24시간 동안 냉동 보호를 위해 1x PBS의 30% 자당으로 뇌를 옮깁니다.
- 필요한 경우 주둥이-꼬리 축을 따라 뇌를 반으로 자르고 직립 형광 해부 현미경을 사용하여 형질감염된 리포터 구조의 발현을 확인합니다.
알림: 뇌가 마르지 않도록 작은 접시에 1x PBS에 담가 두십시오. - 냉동 마이크로톰에 뇌를 장착하고 25μm 시상 절편을 자른 다음 1x PBS와 글리세롤의 1:1 혼합물로 절편을 펼칩니다.
알림: 섹션은 장기 보관을 위해 -20°C에서 이 동결 방지 용액에 보관할 수 있습니다. - 절편을 1x PBS에서 각각 10분 동안 3회 세척하여 동결방지제를 제거하고, 실온에서 1시간 동안 오비탈 셰이커에서 1x PBS + 10% 정상 염소 혈청 + 0.2% 비이온성 세제로 조직을 차단합니다.
- 1차 항체 용액을 준비합니다: 1x PBS, 10% 정상 염소 혈청, 0.2% 비이온성 세제 및 항-GFP 항체, >16,000×g에서 5분 동안 용액을 원심분리 합니다. 4°C에서 48시간 동안 오비탈 쉐이커에서 항체 용액 중 절편을 배양합니다.
- 1차 항체 용액을 1x PBS + 0.2% 비이온성 세제로 15분 동안 5회 세척합니다.
- 2차 항체 용액 준비: 1x PBS, 10% 정상 염소 혈청, 0.2% 비이온성 세제 및 GFP를 검출하기 위한 적절한 2차 항체; 용액을 >16,000 × g에서 원심분리합니다. 실온에서 2-3시간 동안 오비탈 셰이커에서 항체 용액의 절편을 배양합니다. 표백을 방지하기 위해 섹션을 빛 노출로부터 보호하십시오.
- 2차 항체 용액을 1x PBS + 0.2% 비이온성 세제로 매번 15분 동안 3회 세척합니다. 핵을 염색하기 위해 1x PBS + Hoechst에서 5분 동안 절편을 배양합니다.
- 1x PBS + 0.2% 비이온성 세제로 Hoechst 용액을 씻어내고 유리 슬라이드에 장착합니다. 장착 매체로 섹션을 덮고, 슬라이드를 덮고, 슬라이드를 매니큐어로 밀봉하여 증발을 방지합니다.
4. CGN의 형태학적 분석 - 3차원(3D) 재구성 및 표면적 및 세포 부피
- 컨포칼 현미경에서 2배 줌으로 63x 대물렌즈에서 단일 전기천공된 CGN을 이미지화하여 스택당 0.5μm의 z-스택 이미지를 촬영합니다. 이미지 창당 하나의 셀을 이미지화하여 이미지를 쉽게 분석하고 재구성할 수 있습니다.
- 다음 링크(https://imagej.net/Simple_Neurite_Tracer:_Basic_Instructions)를 사용하여 FIJI용 Simple Neurite Tracer 플러그인을 설치하면 3차원(3D) 공간에서 전기천공된 CGN의 구조를 쉽고 효율적으로 추적할 수 있습니다.
참고: 플러그인(https://imagej.net/SNT)의 업데이트된 버전이 있습니다. - Simple Neurite Tracer를 사용하여 맹검 방식으로 신경돌기 길이와 수지상 발톱 형성을 분석합니다. 전기천공된 CGN의 단일 채널 z-스택 이미지를 FIJI에 업로드하고 플러그인 | 세그멘테이션 | 간단한 신경돌기 추적기 (그림 3D).
- 드롭다운 메뉴에 액세스하고 새 3D 뷰어 만들기 (그림 3D)를 선택합니다.
- 수상 돌기의 바닥으로 스크롤하여 셀 소마에 연결하고 접합부를 클릭하여 경로를 시작합니다. 셀 채우기 신호가 가장 밝은 부분을 클릭하여 경로를 수동으로 추적하고 [y]를 눌러 추적을 유지합니다. 집게발이 없는 경우 수상돌기 끝까지 또는 발톱 바닥까지 추적하고 [f]를 눌러 경로를 확인합니다(그림 4D).
- 다음으로, 구조물의 바닥에서 경로를 시작하고 가장 긴 중성석이 끝날 때까지 추적하여 발톱을 추적합니다. Windows의 경우 [ctrl]을, Mac OS의 경우 [alt]를 누른 상태에서 경로를 클릭하여 2차 및 3차 분기를 추적합니다. [f]를 눌러 경로를 확인합니다.
- 추적에 대한 측정값이 별도의 창에 표시되는지 확인합니다. 발톱 가지(1차, 2차, 3차)의 모든 측정값을 합산하여 각 발톱의 총 길이를 구합니다.
- 전기천공된 CGN의 표면적과 세포 부피를 분석하려면 Imaris 세포 분석 소프트웨어(https://imaris.oxinst.com/)를 다운로드하십시오.
참고: FIJI는 쉽게 구할 수 있는 무료 플러그인을 사용하여 z-스택 이미지에서 3D로 셀을 재구성하는 데에도 사용할 수 있습니다. 또한 Simple Neurite Tracer에는 볼류메트릭 렌더링 기능이 있지만 아래에 설명된 이유로 Imaris가 사용되었습니다. - 전기천공된 CGN의 z-스택 이미지를 Imaris에 업로드합니다. Surpass를 눌러 3D 재구성 툴킷에 액세스합니다.
- CGN을 재구성하려면 서피스(Surfaces)를 누르고 이미지 창 내의 셀 전체를 포함하는 관심 영역을 선택합니다. 완료되면 만들기 아래의 오른쪽 하단 모서리에 있는 파란색 앞으로 화살표를 누릅니다.
- 이미지에 서로 다른 신호에 대한 여러 채널이 포함되어 있는 경우 전기천공된 CGN이 포함된 채널을 선택하고 파란색 앞으로 화살표를 누릅니다.
- 슬라이드바를 사용하여 전기천공된 셀의 신호에 가장 정확하게 맞는 원하는 임계값을 설정합니다. 임계값을 정확하게 결정하기 위해 셀 표면에 더 가깝게 확대합니다. 완료되면 이중 녹색 화살표를 눌러 셀을 재구성하고 메타데이터에서 표면적과 볼륨 크기를 가져옵니다.

그림 3: 전기천공된 과립 뉴런의 면역조직화학적 분석 및 3차원 재구성. P7 CD-1 마우스를 GFP를 발현하는 작제물로 전기천공하였다. 뇌를 채취하여 면역조직화학, 공초점 현미경 검사, 형태학적 분석을 위한 3D 재구성을 실시했습니다. (A) 10DPI 마우스의 전기 천공에서 이미지 처리까지의 타임라인. (B) 전기천공된 소뇌 10-DPI의 시상 단면의 최대 투영 이미지; 흰색 선은 소뇌층을 구분하고 스케일 바는 25μm입니다. (C) 단일 전기천공된 과립 뉴런의 최대 투영 이미지 10-DPI 및 이에 대응하는 3D 트레이스, 스케일 바는 10μm입니다. (D) FIJI 플러그인 Simple Neurite Tracer를 사용하여 3D 재구성을 생성했습니다. 모든 측정은 셀 채우기 신호에 따라 z-스택을 통해 추적되었습니다. 샤프트 및 클로 측정은 모든 덴드라이트에 대해 별도로 추적되었습니다. 점선은 현재 평면 내에서 수상 돌기의 일부를 나타냅니다. 약어: 3D = 3차원; GFP = 녹색 형광 단백질; DPI = 주입 후 일수; PSD-95 = 시냅스후 밀도 단백질 95; GNPs = 과립 뉴런 전구체; PFA = 파라포름알데히드. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results

그림 4: 소뇌 발달 중 과립 뉴런 형태 분석. (A) 3-DPI에서 14-DPI(출생 후 연령 P10 내지 P21), 핵(파란색) 및 GFP(녹색)에서 전기천공된 CGN의 최대 투영 이미지; 화살촉은 개별 수상 돌기를 나타내며 스케일 바는 10 μm입니다. (B) 수상 돌기의 평균 수. (C) 소마의 기저부에서 수상돌기의 끝까지 측정한 평균 수상돌기 길이. (D) 발톱을 포함하는 수상 돌기의 분율; 1.00의 값은 100%이며, 즉, 모든 수상돌기에는 발톱이 있습니다. (E) 수지상 발톱의 전체 길이. 조건당 N > 30개의 세포, 조건당 적어도 4마리의 동물로부터 수집; 모든 측정은 일원 분산 분석과 Dunnett의 다중 비교 검정(B, C 및 D) 또는 Tukey의 다중 비교 검정(E)으로 분석되었으며, ****는 시간 경과에 따른 p <0.0001로 유의성을 나타냅니다. 오차 막대는 S.E.M. 약어: GFP = 녹색 형광 단백질; DPI = 주입 후 일수; PSD-95 = 시냅스후 밀도 단백질 95; CGNs = 소뇌 과립 뉴런; 분산 분석 = 분산 분석; S.E.M. = 평균의 표준 오차. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
생체 내에서 과립 뉴런 형태의 발달을 연구하기 위해, 인간 유비퀴틴 프로모터(FUGW)의 제어 하에 GFP를 발현하는 구조체를 CD-1 마우스의 발달 중인 소뇌 내로 전기천공하고 주사 후 3일, 5일, 7일, 10일 및 14일(DPI)에 뇌를 수집했습니다. 공초점 현미경과 함께 전기천공에 의한 세포의 희박한 라벨링은 수지상 가지치기, 성장 및 성숙 기간 동안 CGN의 스냅샷을 캡처합니다. CGN 시냅스 구조의 성장을 정량적으로 분석하고 추적하기 위해 FIJI 플러그인 SNT(Simple Neurite Tracer)를 사용하여 각 수상돌기를 추적했습니다. SNT는 3차원(3D) 공간에서 신경돌기 및 발톱 길이를 측정하기 위한 쉽고 빠르며 효율적이며 쉽게 사용할 수 있는 방법입니다. 반대로, Imaris는 프로그램이 각 셀의 빠르고 정확한 렌더링을 제공하고 임계값 기능이 근처의 라벨링된 셀 파편에서 라벨링된 셀을 분리할 수 있기 때문에 표면적 및 부피 측정을 얻기 위해 CGN의 3D 재구성에 사용되었습니다.
신생아 CGN은 수지상 성장의 활발한 단계를 거친 후 P10에서 P14(3-7-DPI)로 미세 조정되어 초과 수상돌기의 50% 이상이 가지치기됩니다(그림 4B). 이 사건은 나머지 아버의 점진적인 길어짐(그림 4C) 및 각 수상돌기의 끝에 발톱과 같은 구조가 형성되는 것(그림 4D)과 일치하며, 이는 이러한 발달 과정이 동시에 일어나고 있음을 나타냅니다. 그러나 발톱은 P14(7-DPI)에 의해 수상 돌기의 약 75%에서 발견되지만 이러한 구조는 P21(14-DPI)까지 크기가 계속 증가합니다(그림 4E).
수상돌기와 발톱 형태의 변화는 전체 세포 크기의 전반적인 변화 또는 세포막의 재분포를 반영할 수 있습니다. 이 문제를 해결하기 위해 표지된 각 과립 뉴런을 Imaris에서 재구성하여 총 체성 수지상 표면적과 부피를 정량화했습니다. CGN 크기는 개발 전반에 걸쳐 비교적 일정하게 유지되었지만(그림 5A, B), P14에서 CGN은 P10, P12 및 P17(3, 5 및 10-DPI)에 비해 부피가 크게 20% 감소했습니다(그림 5B). 이러한 데이터는 수축된 수상돌기로부터의 막 재활용이 수지상 말단을 발톱으로 확대하는 데 특히 중요할 수 있으며 가지치기에서 시냅스 발달로의 전환의 핵심 시점으로 P14(7-DPI)를 가리킬 수 있음을 시사합니다.

그림 5: 소뇌 발달 중 과립 뉴런 크기 분석. 세포 크기를 결정하기 위해 전기천공된 CGN을 Imaris에서 재구성했습니다. (ᄀ-비) 소뇌 발달 중 과립 뉴런(즉, 세포 소마 및 수상돌기)의 표면적 및 체적 분석. 조건당 N> 30개의 세포, 조건당 최소 4마리의 동물로부터 수집. 모든 측정은 단방향 ANOVA와 Dunnett's multiple comparison test에 의해 분석되었으며, **는 p <0.005로 유의성을 나타내고; 오류 막대는 S.E.M. 약어: DPI = 주입 후 일수; CGNs = 소뇌 과립 뉴런; 분산 분석 = 분산 분석; S.E.M. = 평균의 표준 오차. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
소뇌 과립 뉴런은 포유류 뇌에서 가장 풍부한 뉴런으로 설치류 뇌의 전체 뉴런 인구의 거의 60-70 %를 차지합니다 1,14. 소뇌는 세포 증식, 이동, 수상돌기 형성 및 시냅스 발달의 메커니즘을 밝히기 위해 광범위하게 활용되었습니다 6,9,10,11,15,16,17,18,19,20 . 더욱이, 수십 년에 걸친 전기생리학적 연구는 학습된 운동 행동에 대한 회로의 관여의 기초가 되는 장기 소뇌 가소성에서 과립 뉴런의 역할을 확립하는 데 도움이 되었습니다21,22,23. 따라서 과립 뉴런은 시냅스 및 회로 발달에 관한 주요 질문을 조사하는 훌륭한 모델 시스템입니다.
이 연구의 목표는 생체 내에서 단일 뉴런 유형의 형태를 추적하기 위해 소뇌를 활용하는 기술을 강조하는 것입니다. 소뇌의 전기 천공은 분열 세포를 표적으로 삼습니다. 따라서, 과립 뉴런 전구체와 신경교 세포 모두를 기술적으로 표지할 수 있지만, 과립 뉴런 전구체가 너무 많기 때문에 전기천공된 집단은 세포 유형 특이적 프로모터가 필요하지 않더라도 대부분 뉴런입니다. 또한 이 기술은 CGN 발달에서 유전자의 역할을 연구하기 위해 생체 내에서 유전자를 유전적으로 조작하는 데 적용할 수 있습니다. 이는 짧은 헤어핀 또는 작은 간섭 RNA를 발현하는 플라스미드를 형질감염시켜 유전자를 녹다운시키거나 Cre 재조합효소를 발현하는 플라스미드를 형질전환 마우스 균주로 형질전환하여 LoxP 부위 옆에 있는 영역을 절제하고 의도된 관심 유전자를 녹아웃함으로써 달성할 수 있습니다10,24.
Electroporation은 유전 연구에 강점과 약점을 모두 가지고 있습니다. 전통적인 형질전환 전략에 비해 유전자를 조작하는 더 빠른 방법을 제공하지만, 전기천공법의 여유는 효과를 보기 위해 많은 수의 유전자 변형 세포가 필요한 행동 연구에 대한 유용성을 제한합니다. 두 번째 한계는 소엽 5와 7 사이의 과립 뉴런만을 안정적으로 표적으로 삼는다는 것인데, 이는 부분적으로 소뇌가 주사 부위에서 어떻게 배향되는지에 기인합니다. 그러나 전기천공된 영역 내에서 이 방법은 상대적으로 많은 수의 개별 라벨링된 셀을 생성하여 통계적으로 강력한 측정의 가능성을 제공합니다. 예를 들어, 시간이 지남에 따라 수상돌기 발달을 추적할 수 있었을 뿐만 아니라, 수상돌기와 발톱 사이의 막의 미묘한 재분포를 측정할 수 있었고, 이전에 발표된 데이터(20)를 확장할 수 있었다. CGN 발톱은 이러한 수지상 구조의 확대가 과립 뉴런이 이끼 낀 섬유 말단 및 단극 브러시 세포와의 흥분성 연결뿐만 아니라 인근 골지 세포와의 억제 연결을 형성할 수 있는 추가 공간을 제공하기 때문에 연구하는 것이 특히 흥미롭습니다. 따라서 이러한 수지상 측정을 특정 시냅스 전 및 시냅스 후 단백질의 면역조직화학적 표지와 결합하면 소뇌 회로 형성 및 시냅스 성숙 연구를 발전시키는 데 유용할 수 있습니다.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
저자는 이해 상충을 선언하지 않습니다.
Acknowledgments
이 연구는 NIH 보조금 R01NS098804 (AEW), F31NS113394 (UC) 및 Duke University의 Summer Neuroscience Program (DG)의 지원을 받았습니다.
Materials
| Name | Company | Catalog Number | Comments |
| Betadine | Purdue Production | 67618-150-17 | |
| Cemented 10 µL needle | Hamilton | 1701SN (80008) | 33 gauge, 1.27 cm (0.5 in), 4 point style |
| Chicken anti-GFP | Millipore Sigma | AB16901 | Our lab uses this antibody at a 1:1000 concentration |
| Cotton-tip applicator | |||
| Donkey anti-chicken Cy2 | Jackson ImmunoResearch | 703-225-155 | Our lab uses this antibody at a 1:500 concentration |
| Ethanol (200 proof) | Koptec | V1016 | |
| Electroporator ECM 830 | BTX Harvard Apparatus | 45-0052 | |
| Fast Green FCF | Sigma | F7252-5G | |
| FUGW plasmid | Addgene | 14883 | |
| Glass slides | VWR | 48311-703 | Superfrost plus |
| Glycerol | Sigma-Aldrich | G5516 | |
| Heating pad | Softheat | ||
| Hoescht 33342 fluorescent dye | Invitrogen | 62249 | |
| Imaris | Bitplane | ||
| Isoflurane | Patterson Veterinary | 07-893-1389 | |
| Micro cover glass | VWR | 48382-138 | |
| Nail polish | Sally Hansen | Color 109 | |
| Normal goat serum | Gibco | 16210064 | |
| O.C.T. embedding compound | Tissue-Tek | 4583 | |
| Olympus MVX10 Dissecting Scope | Olympus | MVX10 | |
| P200 pipette reach tip | Fisherbrand | 02-707-138 | Used for needle spacer |
| Parafilm | Bemis | PM-996 | |
| PBS pH 7.4 (10x) | Gibco | 70011-044 | |
| Simple Neurite Tracer | FIJI | https://imagej.net/Simple_Neurite_Tracer:_Basic_ Instructions |
|
| Sucrose | Sigma | S0389 | |
| Surgical tools | RWD Life Science | Small scissors and tweezers | |
| Triton X-100 | Roche | 11332481001 | non-ionic detergent |
| Tweezertrodes | BTX Harvard Apparatus | 45-0489 | 5 mm, platinum plated tweezer-type electrodes |
| Ultrapure distilled water | Invitrogen | 10977-015 | |
| Vectashield mounting media | Vectashield | H1000 | |
| Vetbond tissue adhesive | 3M | 1469SB | |
| Zeiss 780 Upright Confocal | Zeiss | 780 |
References
- Altman, J., Bayer, S. A. Development of the cerebellar system : in relation to its evolution, structure, and functions. , CRC Press. (1997).
- Rahimi-Balaei, M., Bergen, H., Kong, J., Marzban, H. Neuronal migration during development of the cerebellum. Frontiers in Cellular Neuroscience. 12, 484 (2018).
- Alder, J., Cho, N. K., Hatten, M. E. Embryonic precursor cells from the rhombic lip are specified to a cerebellar granule neuron identity. Neuron. 17 (3), 389-399 (1996).
- Hatten, M. E., Heintz, N. Mechanisms of neural patterning and specification in the developing cerebellum. Annual Review of Neuroscience. 18, 385-408 (1995).
- Ben-Arie, N., et al. Math1 is essential for genesis of cerebellar granule neurons. Nature. 390 (6656), 169-172 (1997).
- Borghesani, P. R., et al. BDNF stimulates migration of cerebellar granule cells. Development. 129 (6), 1435-1442 (2002).
- Espinosa, J. S., Luo, L. Timing neurogenesis and differentiation: insights from quantitative clonal analyses of cerebellar granule cells. Journal of Neuroscience. 28 (10), 2301-2312 (2008).
- Markwalter, K. H., Yang, Y., Holy, T. E., Bonni, A. Sensorimotor coding of vermal granule neurons in the developing mammalian cerebellum. Journal of Neuroscience. 39 (34), 6626-6643 (2019).
- Shalizi, A., et al. PIASx is a MEF2 SUMO E3 ligase that promotes postsynaptic dendritic morphogenesis. Journal of Neuroscience. 27 (37), 10037-10046 (2007).
- Shalizi, A., et al. A Calcium-regulated MEF2 sumoylation switch controls poststynaptic differentiation. Science. 311 (5763), 1012-1017 (2006).
- Konishi, Y., Stegmuller, J., Matsuda, T., Bonni, S., Bonni, A. Cdh1-APC controls axonal growth and patterning in the mammalian brain. Science. 303 (5660), 1026-1030 (2004).
- Holubowska, A., Mukherjee, C., Vadhvani, M., Stegmuller, J. Genetic manipulation of cerebellar granule neurons in vitro and in vivo to study neuronal morphology and migration. Journal of Visualized Experiments: JoVE. (85), e51070 (2014).
- Yang, Y., et al. Chromatin remodeling inactivates activity genes and regulates neural coding. Science. 353 (6296), 300-305 (2016).
- Herculano-Houzel, S. Coordinated scaling of cortical and cerebellar numbers of neurons. Frontiers in Neuroanatomy. 4, 12 (2010).
- Wilson, P. M., Fryer, R. H., Fang, Y., Hatten, M. E. Astn2, a novel member of the astrotactin gene family, regulates the trafficking of ASTN1 during glial-guided neuronal migration. Journal of Neuroscience. 30 (25), 8529-8540 (2010).
- Kokubo, M., et al. BDNF-mediated cerebellar granule cell development is impaired in mice null for CaMKK2 or CaMKIV. Journal of Neuroscience. 29 (28), 8901-8913 (2009).
- Schwartz, P. M., Borghesani, P. R., Levy, R. L., Pomeroy, S. L., Segal, R. A. Abnormal cerebellar development and foliation in BDNF-/- mice reveals a role for neurotrophins in CNS patterning. Neuron. 19 (2), 269-281 (1997).
- Segal, R. A., Pomeroy, S. L., Stiles, C. D. Axonal growth and fasciculation linked to differential expression of BDNF and NT3 receptors in developing cerebellar granule cells. Journal of Neuroscience. 15 (7), Pt 1 4970-4981 (1995).
- Zhou, P., et al. Polarized signaling endosomes coordinate BDNF-induced chemotaxis of cerebellar precursors. Neuron. 55 (1), 53-68 (2007).
- Dhar, M., Hantman, A. W., Nishiyama, H. Developmental pattern and structural factors of dendritic survival in cerebellar granule cells in vivo. Scientific Reports. 8 (1), 17561 (2018).
- Ito, M. Synaptic plasticity in the cerebellar cortex and its role in motor learning. Canadian Journal of Neurological Sciences. 20, Suppl 3 70-74 (1993).
- Jorntell, H., Hansel, C. Synaptic memories upside down: bidirectional plasticity at cerebellar parallel fiber-Purkinje cell synapses. Neuron. 52 (2), 227-238 (2006).
- Nakanishi, S. Genetic manipulation study of information processing in the cerebellum. Neuroscience. 162 (3), 723-731 (2009).
- Chang, C. H., et al. Atoh1 controls primary cilia formation to allow for SHH-triggered granule neuron progenitor proliferation. Developmental Cell. 48 (2), 184-199 (2019).
Tags
신경 과학 제 172 호 신경 발달 소뇌 수상 돌기 시냅스 과립 뉴런 전기 천공Erratum
Formal Correction: Erratum: Utilizing In Vivo Postnatal Electroporation to Study Cerebellar Granule Neuron Morphology and Synapse Development
Posted by JoVE Editors on 04/06/2023.
Citeable Link.
An erratum was issued for: Utilizing In Vivo Postnatal Electroporation to Study Cerebellar Granule Neuron Morphology and Synapse Development. A figure was updated.
Figure 2 was updated from:
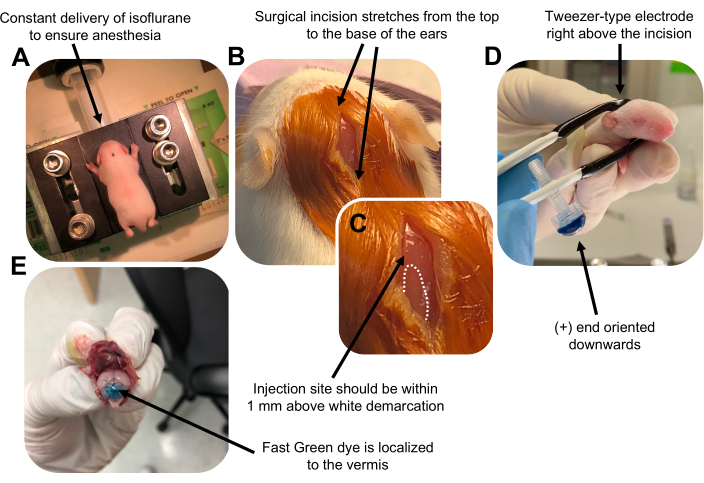
Figure 2: In vivo cerebellar electroporation of granule neuron progenitors in P7 wildtype mouse pups. (A) Pups are anesthetized with 4% isoflurane delivered at a rate of 0.8L/min to ensure anesthesia throughout the injection of the DNA solution. Isoflurane is delivered at a rate of 0.8 L/min. (B) After sterilizing the mouse 3 times with betadine and 70% ethanol, an incision is made that spans the distance of the ears, revealing the hindbrain. (C) A magnified image of a white demarcation on the cranium, a landmark for the injection site. DNA construct should be injected within 1 mm above the mark; dotted lines outline the demarcation, and black arrow denotes the injection site. The ridges of the cerebellar vermis may be visible and can be useful for finding the injection site. (D) Tweezer-type electrode orientation for efficient electroporation. Plus (+) end must be oriented downwards to pull negatively charged DNA into the cerebellar parenchyma prior to administration of electrical pulses. (E) Test injection of 1 µL of a 0.02% Fast Green dye shows injection is localized to the middle of the cerebellar vermis between lobules 5-7. Please click here to view a larger version of this figure.
to:
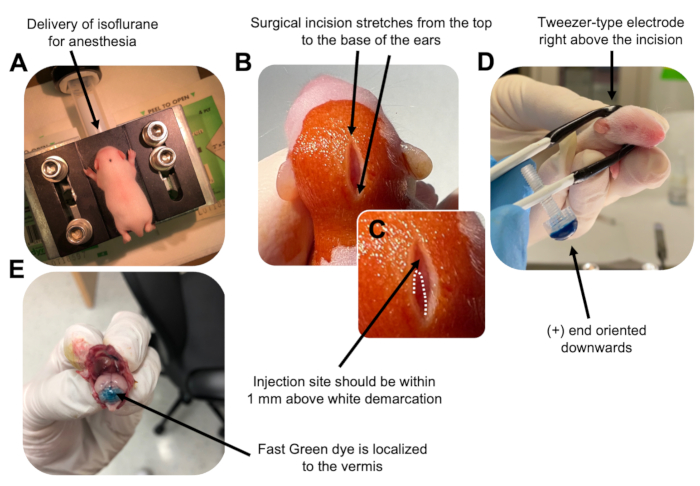
Figure 2: In vivo cerebellar electroporation of granule neuron progenitors in P7 wildtype mouse pups. (A) Pups are anesthetized with 4% isoflurane delivered at a rate of 0.8L/min to ensure anesthesia throughout the injection of the DNA solution. Isoflurane is delivered at a rate of 0.8 L/min. (B) After sterilizing the mouse 3 times with betadine and 70% ethanol, an incision is made that spans the distance of the ears, revealing the hindbrain. (C) A magnified image of a white demarcation on the cranium, a landmark for the injection site. DNA construct should be injected within 1 mm above the mark; dotted lines outline the demarcation, and black arrow denotes the injection site. The ridges of the cerebellar vermis may be visible and can be useful for finding the injection site. (D) Tweezer-type electrode orientation for efficient electroporation. Plus (+) end must be oriented downwards to pull negatively charged DNA into the cerebellar parenchyma prior to administration of electrical pulses. (E) Test injection of 1 µL of a 0.02% Fast Green dye shows injection is localized to the middle of the cerebellar vermis between lobules 5-7. Please click here to view a larger version of this figure.



