Summary
Hela-cell patch-clamp inspelningar från fiber hörselnerven dendriter vid den inre hårceller band synaps i däggdjur snäckan.
Abstract
Den afferenta synapsen mellan det inre hårceller (IHC) och hörselnerven fiber ger en elektrofysiologiskt tillgänglig webbplats för att registrera postsynaptiska aktiviteten av ett enda band synaps 1-4. Bandet synapser av sensoriska celler släpper signalsubstans kontinuerligt, andelen som är modulerad svar på graderade förändringar i IHC membranpotential 5. Ribbon synapser har visat sig fungera genom multivesicular release, där flera blåsor kan frigöras samtidigt att framkalla excitatoriska postsynaptiska strömmar (EPSCs) av varierande amplituder 1, 4, 6-11. Varken roll presynaptiska band, eller mekanismen bakom multivesicular release är nu väl förstådd.
IHC är innerveras med 10-20 fibrer hörselnerven, och alla kontakter fiber av IHC med en unmyelinated enda slut till ett enda band synaps. Den lilla storleken på afferenta boutons kontakta IHCs (ca 1 mikrometer i diameter) gör inspelningar med exceptionell tidsupplösning göras. Dessutom kan tekniken anpassas för att spela in från både pre-och postsynaptiska celler samtidigt, vilket gör att överföringsfunktionen i synapsen som ska studeras direkt 2. Denna metod ger alltså ett sätt för grundläggande aspekter av neurotransmission kan studeras, från multivesicular utsläpp till svårfångade funktion av bandet i sensoriska celler.
Protocol
1. Lösningar
- Lösningar kan förberedas i förväg. Extracellulär lösningar kan lagras vid 4 ° C i upp till en månad. Alikvoter av intern lösning kan förvaras fryst (-20 ° C). Se till att lösningar i rumstemperatur innan du börjar experiment.
- Dissekera lösning och extracellulära inspelning lösning (mm): 5,8 KCl, 144 NaCl, 0,9 MgCl 2, 1,3 CaCl 2, 0,7 NaH 2 PO 4, 5,6 glukos, 10 HEPES, 1 Na pyruvat, pH 7,4 (NaOH), 300 mOsm. För IHC Ca 2 + nuvarande isolering den extracellulära lösningen kan ändras enligt: 5,8 KCl, 114 NaCl, 0,9 MgCl 2, 1,3 CaCl 2, 0,7 NaH 2 PO 4, 5,6 glukos, 10 HEPES, 30 TEA Cl, pH 7,4 (NaOH ), 300 mOsm.
- 1-2 mikroM tetrodotoxin (TTX) kan läggas till den extracellulära lösningen att blockera spänning natriumkanaler och isolera excitatoriska postsynaptiska strömmar eller potentialer (EPSCs eller EPSPS).
- Intracellulär inspelning lösning (mm): 20 KCl; 110 K-methanesulfonate, 5 MgCl 2, 0,1 CaCl 2, 5 EGTA, 5 HEPES, 5 Na 2 ATP, 0,3 Na 2 GTP, 5 Na 2 phoshocreatine, pH 7,2 (KOH), 290 mOsm, eller 135 KCl, 3,5 MgCl 2, 0,1 CaCl 2, 5 EGTA, 5 HEPES, 4 Na 2 ATP, 0,2 Na 2 GTP, pH 7,2 (KOH), 290 mOsm. Intracellulär lösning för IHC Ca 2 + nuvarande isolering: 135 CsMeSO3, 13 TEA Cl, 3,5 MgCl 2, 2,5 Na 2 ATP, 1 EGTA, pH 7,2 (CsOH), 290 mOsm. Denna lösning skulle blockera en betydande del av den mycket större conductances K +, lämnar Ca 2 + ström kvar.
2. Göra Hållare för dissekerade Tissue
- Ändrad täckglas används för att hålla förberedelserna på plats under inspelningarna kan också vara beredda i förväg.
- Applicera en droppe Sylgard (Dow Corning, Midland, MI) mot kanten av en cirkulär glas täckglas (8-12 mm). Placera den tjocka änden av en fin insekt stift (FST, Varunr 26.002 till 10) på täckglas. Håll insekt stift tätt mot glaset med pincett och hålla nära en uppvärmd spole för att ställa in sylgard.
3. Göra Elektroder
- Förbered elektroder färsk på varje experimentell dag och förvara i en lufttät låda. Fabricera 10-20 elektroder för varje beredning.
- Välj elektrod av glas, vi använder 1 mm borosilikatglas kapillärer (1B100F-4 från WPI, Sarasota, FL).
- Designa ett program på en flera steg avdragare för att dra elektroder med en spets diameter på cirka 2-3 ìm (~ 6 Mohm i lösningar som beskrivs ovan). Vi använder en Sutter P-87 i flera steg horisontella avdragare eller en Narishige vertikal PC-10 avdragare.
- Försiktigt päls skaftet av elektroden med Sylgard så nära toppen som möjligt. Detta minskar pipett kapacitans och minimerar inspelning buller.
- Fire-polish elektroder med hjälp av en microforge med en uppvärmd glödtråd som den tillgängliga från WPI. Fire Polished elektroder ska ha en yttre spets diameter på cirka 1 mikrometer (10-15 Mohm i lösningar som beskrivs ovan). Tjockleken på pipetten väggen är ca 1 / 3 ìm. Den ytterdiameter har cirka storleken på afferenta Bouton ska lagas.
- Vid genomförandet av samtidiga inspelningar: bör IHC pipetten byggas på samma sätt (samma glas, samma dra-programmet), med skillnaden att brand polering bör lämna ett större tips diameter på ~ 3 mikrometer (6 - 8 Mohm).
4. Ställa in experimentet
- Fyll kammare ansluten till allvaret matas perfusionen system med extracellulära lösning och testlösningar som innehåller läkemedel eller toxiner av intresse.
- Ställ perfusion så att badet volym är ca 2 ml, ständigt BEGJUTA med en hastighet på order av 1,5 ml min-1.
- Om olika lösningar som skall tillämpas under försöket med en lokal genomblödning system, fylla behållare med lösningar. Kör lösningar genom systemet och se till att det inte finns några luftbubblor.
5. Dissektion och provberedning
- Den medföljande filmen illustrerar dissekering av organ Corti för tre veckor gamla råttor (Sprague Dawley, Charles River), vilket är svårare än tidigare postnatal etapper. Fördelar och nackdelar med inspelning från råttor i olika åldrar granskas i diskussionen.
- Djupt söva råttan av isofluran inandning. När uttag reflexer är frånvarande och hornhinnan reflexer är allvarligt deprimerad, halshugga. Dessa förfaranden har godkänts av Johns Hopkins University Djurvård och användning kommittén.
- Ta bort nos och hud från de avhuggna huvudet. HALVERA huvudet och ta bort hjärnan att exponera temporal ben.
- Ta bort både tidsmässiga ben och placera i rena dissekera rätter som innehåller vanliga extracellulära lösning.
- Ta bortbenet kapsla in tinningbenet så att exponera snäckan. Håll tinningbenet ordentligt vid basen med en pincett. Identifiera runda och ovala fönster. Orientera snäckan så att det ovala fönstret och spiral sidan av snäckan ansiktet uppåt och ta bort överflödigt ben runt snäckan.
- Ta bort ben kapsla snäckan att exponera sensoriska epitelet, var noga med att skydda apikala spole, som kommer att användas för experimentet. Använd en andra par fina pincett för chip benet direkt från snäckan, börjar med det område som är mer öppen än resten av benet. Här benet är tunnare och lättare att ta bort. Fortsätt att ta bort ben från omkring den apikala spolen.
- Använd mikro-dissekera sax för att klippa igenom modiolus under apikala tur. Koppla sedan bort apikala tur från de lägre varv på snäckan.
- Använd mikro-dissekera sax igen, om nödvändigt, se till att den apikala sin tur är helt avskurna. Var noga med att skydda den apikala spolen, det bör inte dras eller sträckas. Använd fin pincett för att lura den apikala sväng från resten av snäckan.
- Ta bort resten av ben från båda sidor av den apikala tur.
- Ta försiktigt bort stria vascularis, den blanka band av vävnad som ligger utanför de hårceller regionen (Schematisk 1). Se till att undvika att ta bort de sensoriska hårceller, som lätt kan lossna tillsammans med stria vascularis.
- Använd fin pincett för att ta loss tektorialmembranet, den blanka, halvt genomskinliga membran som sitter ovanför sensoriska hårceller.
- Nu trimma överflödig vävnad och ben och platta beredningen med pincett. Detta är nödvändigt, så att vävnaden kan placeras jämnt under ett stift.
- Placera förberedelser inom stiftet bifogas ett täckglas (förberett tidigare), var noga med att placera stift bort från hårcellerna.
- Använd pincett för att överföra täckglas till inspelningen kammaren. Se till att cochlea vävnaden är helt täckt med en droppe av extracellulärt lösning, medan överföring av täckglas. Tryck på täckglas ner fast på glaset botten av kammaren att säkerställa att det inte rör sig under inspelningen.
- Omedelbart börjar perfusion med extracellulärt lösning, för att säkerställa bättre överlevnad av preparatet.
6. Inspelning
- Leta reda på preparatet i mikroskopet okularen med 10x och 40x nedsänkning i vatten mål DIC. Orientera preparatet så att inspelning elektroder kan närma IHCs ortogonalt till laterala väggen i IHC.
- Om preparatet är ringlad över, vilket begränsar synligheten av de basala regionen IHCs, använd en inspelning elektrod att driva den yttre kanten av preparatet ner mot glaset täckglas, ta hand för att undvika att trycka på IHCs själva.
- * Om du använder unga råttor, i detta skede tjockt lager stödja celler ovanför hårcellerna kan tas bort med en rengöring pipett (med en spets diameter på ~ 10-20 mikrometer) för att få tillgång till de sensoriska celler 1, 12.
- Använd skärmen för att bedöma om vävnaden är frisk. Med hjälp av en 4x förstoring linsen mellan mikroskop och NC70 Newvicon kameran ytterligare förstorar bilden och projekt ett område på ca 4800 ìm 2 på monitorn. Hårcellerna bör vara långsträckt med intakt hår buntar. När vävnaden försämras, hårceller svälla och bli mer transparent och kornig.
- Lokalisera afferenta boutons runt basen av IHCs. Boutons är sfäriska eller ellipsformade, ungefär 1 mikrometer i diameter och är lätta i färg med ett blankt utseende. Majoriteten av boutons är lokaliserade under nivån för kärnan. När vävnaden är ohälsosamt boutons svälla till ungefär 4 gånger den normala storleken och blir genomskinliga, snarare än blanka.
- Fyll en inspelning elektrod med intracellulär lösning, tillämpa positiv press och använda mikromanipulator att manövrera elektroden med förberedelserna.
- Gör ett snitt i preparatet i nivå med IHC bas med elektroden. Tryck elektroden mellan det tunna lagret av stöd celler och IHCs, med hjälp av positiv press för att skapa en tillfartsväg till området vid foten av IHCs. Detta steg är "nyckeln" för att nå afferenta Bouton och för att inte spela in från att stödja celler som tätt ensheath den afferenta ändelser.
- Ta försiktigt bort elektroden och ersätta med en nyligen fylld elektrod.
- Använda positivt tryck för att upprätthålla en ren elektrod spets, manövrera elektroden genom hålet till membranet i IHC. Det positiva trycket bör bidra flytta runt den stödjande celler som omger IHCs.
- Flytta elektroden runt intilliggande stödja celler mot afferenta Bouton (som visas i den medföljande filmen. Ett alternativ är att närma sig afferenta Bouton genom att flytta enlänge IHC membranet tills spetsen av elektroden vidrör Bouton). Se till att elektroden spets är direkt framför den afferenta Bouton (det finns fortfarande ett litet gap mellan Bouton och elektroden på grund av de positiva trycket på pipetten). Boutons erbjuda mer motstånd mot förflyttning av pipetten än stödjande celler och IHC-membran, de kan "kände" av försöksledaren.
- Flytta pipett upp och ner och push to se till att Bouton rör sig. Detta indikerar att pipettspetsen och Bouton är i samma Z-planet.
- Med elektroden pressas mot afferenta Bouton, samtidigt släppa positivt tryck och applicera sug för att bilda en GΩ tätning. Bildande av ett GΩ sigill på en afferenta Bouton liknar på ett hår cell. Seal bildning kan vara snabb eller kan uppstå långsamt.
- Försiktigt skurar av sug att brista membranet i elektroden och in hela konfigurationen cellen inspelning.
- Om cellen lappade är ett afferenta Bouton, kommer små capacitative transienter visas på testet torget pulsen övervakas under tätningen bildning (se figur 1). Vi har beräknat kapacitans i afferenta slut att vara 0,4 till 1,8 pF (se 3, 4). Om cellen lappat är en IHC kommer transienter bli i storleksordningen 3-5 gånger större, beroende på tillgång motstånd.
- För att bekräfta att cellen är en afferenta Bouton, köra ett protokoll med hyperpolarizing och depolarizing spänningen steg. Den aktuella spänningen relationer (IVS) för afferenta fibrer och IHCs (ofta lappade misstag när man siktar på en afferenta Bouton) är karakteristiska för de enskilda celltyperna och visas i figur 2.
- Övervaka membranpotential, för en afferenta fiber, är det normalt ca -60 till -65 mV.
- Om cellen inte är en afferenta Bouton, ta bort elektroden och upprepa steg 8 till 13 med en nyligen fylld elektrod. Använd en ny elektrod för varje försök.
- Monitor-serien motstånd under hela inspelningen genom att spänningen steg för att se till att tätningen inte avslutas upp. Om serien motståndet ökar, kan det vara bra att försiktigt pulser av sug eller för att flytta elektroden lätt bakåt. Serien motstånd är oftast runt 30 Mohm. Vid analys av synaptisk aktivitet, kasta vi inspelningar med serier motstånd större än 50 Mohm.
- Du kan nu spela in synaptisk aktivitet (se figur 3). Antingen afferenta fibrer uppvisar spontan aktivitet, eller håret cellen behöver depolarized att aktivera sändaren release. Tillämpa ett extracellulärt lösning med en högre kalium koncentration (till exempel 40 mm) kommer depolarize håret cell och ofta aktivera eller öka graden av sändaren release.
- För samtidig inspelningar av IHCs och afferenta boutons 2 bör förfarandet ändras på följande sätt: Gå igenom steg 1 till 5. Fyll en IHC pipett med motsvarande intracellulära lösningen för Ca 2 + nuvarande isolering och följa vad som anges i 6. Låt pipetten för IHC inspelning i "vänteläge" nära IHC som skall spelas in från. Fortsätt med steg 6 - 14 för afferenta inspelning. När afferenta pipetten är helt cell konfigurationen fortsätta med IHC pipetten. Manövrera den andra pipetten mot sidovägg för motsvarande IHC, alltid upprätthålla ett positivt tryck. IHC ska visa ett indrag på den laterala väggen med hjälp av trycket och det måste säkerställas att stödja cellerna separeras från det. Steg 12 - 13 skulle kunna tillämpas för IHC också. Som framgår av 14, jämfört med afferenta fibrer, större kapacitiva transienter är ett kännetecken för en IHC-inspelning, förutom den karakteristiska IV förhållande. När samtidiga inspelningar är etablerade, någon gång bör tillåtas (3 - 5 min, beroende på serie resistans) för intracellulära lösningar för att tvätta i IHC. Detta kommer att resultera i större Ca 2 + strömmar på grund av ökad block av mycket större conductances K +.
- För att kunna utföra löst tätning extracellulära inspelningar, vid steg 12, snarare än att göra en GΩ tätning, göra en lös tätning på cirka 30 till 50 Mohm på afferenta Bouton. Detta kan uppnås genom att tillämpa mindre sug och samtidigt släppa positivt tryck. Se Figur 5 för ett exempel på ett extracellulärt inspelning från en P21 råtta afferenta Bouton.
7. Felsökning
- Om förseglingar kan bildas, men övergången från cell-anslutna till hela cellen inspelning kan inte uppnås, får innerdiametern av pipetten vara för smal.
- Om tätningar inte kan bildas, kan den inre pipetten diametern vara för stora och hela Bouton kan sugas upp i elektroden.
- Om alla synaptiska händelser är små och enhetliga, kan inspelningen extracellulära till afferenta. Test för återföring av händelser på positiva membran potential; intracellulärt inspeladeEPSCs kommer att vända till positiva potentialer.
- Om serien motstånd är genomgående hög när patchning afferenta terminaler försöka flytta pipetten bakåt innan du försöker att bryta igenom i hela cellen konfiguration. Detta bidrar till att förhindra pipett igensättning och hög tillgång till motstånd.
- Korrekt ställning pipett oförskräckt. Det är möjligt att flytta elektroden för att minska högt serier motstånd eller pipett täpps utan "förlora" förseglingen på afferenta. Under samtidig inspelning etablering är IHC vanligtvis "drev" mot Bouton. Den afferenta pipett position kan rättas.
8. Representativa resultat
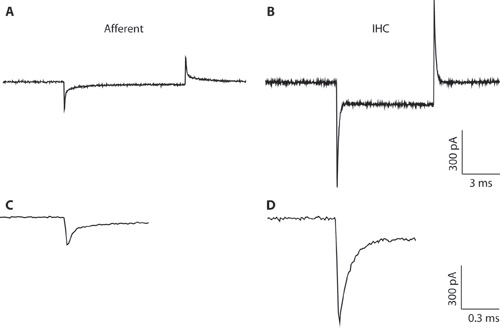
Figur 1. AB. Typiska transienter som spelats in från en afferenta fiber (A) och IHC (B) som svar på en 10 mV hyperpolarizing spänning kommando från en anläggning spänning på -94 mV. På grund av den smala pipetten diameter och hög tillgång motstånd, IHC inspelning (B) är suboptimal för hela cellen IHC inspelning. Inspelningen visas här endast för att illustrera skillnaden mellan capacitative transienter från IHCs och afferenta fibrer. Detta kan bidra till att skilja mellan de celltyper då bildar helcells-konfiguration. Helcells-capacitative transienter från IHCs är i storleksordningen 5 gånger större i amplitud än de från afferenta fibrer. Cd. Transienter från A & B visas på en utökad tid. C. sönderfallet av afferenta svar kan passa med två exponentialfunktioner. Kapacitans i afferenta slut uppskattades av den snabba komponenten.

Figur 2. IV relationer från ett afferenta Bouton (A) och en IHC (B). IV relationer är inspelade från en anläggning potential -84 mV med spänning steg från -124 mV till + 36 mV på 10 mV steg (nominell spänning). Spänningar visas till höger om några spår. Dessa inspelningar har utförts med 5,8 mM extracellulärt KCl vid rumstemperatur. Skala för båda: 500 Pa, 200 ms.
En IV. Relationer från ett afferenta fiber med postnatal dag 19. EPSCs förekommer under större delen av spänningen steg, EPSCs omvänd positiva till 6 mV. Denna inspelning gjordes i närvaro av TTX för att blockera spänningsstyrda Na + strömmar. Notera långsamt aktiverar inåt ström vid hyperpolarizing spänningar (jag h). Denna ström finns inte i IHCs eller stödja celler och ger en bra indikation på att cellen inspelade från är en afferenta fiber (se 3). B. IV relationer från en P19 IHC. På grund av den smala pipetten diameter och hög tillgång motstånd, är inspelningen suboptimal för att karakterisera IHC strömmar och strömmarna är mindre än väntat. Inspelningen visas här endast att visa på IV relationer IHCs och afferenta fibrer kan särskiljas när en afferenta fiber inspelning görs. Notera den snabba aktivering utåt K + strömmar till positiva potentialer (pil), följt av försenat likriktare K + strömmar 13.

Figur 3. Föredöme synaptiska strömmar in från en afferenta fiber med postnatal dag 21 i närvaro av 40 mM extracellulärt K + för att öka graden av utsläpp från IHC. Rumstemperatur, med TTX tillämpas för att blockera spänningsstyrda Na + strömmar. A. Skala 200 Pa, 5 ms, notera varierande storlek och form EPSCs. För en detaljerad beskrivning av EPSC egenskaper se 4. B. Två EPSCs märkta A (#: multiphasic, O: monofasiska) visas på en utökad skala: Skala 100 Pa, 1 ms.

Figur 4. Samtidig inspelning av en IHC och kontakta afferenta Bouton i ett censurerade råtta organ Corti, postnatal dag 10 (se även 2). En spänning steg depolariserande IHC framkallar frisättning av signalsubstansen och aktiverar EPSCs i afferenta Bouton Övre spåra. Spänning protokoll för IHC depolarisation. Holding potential: -79 mV, 50 ms steg till -29 mV Mellanöstern spåra. L-typ Ca2 +-strömmar in från IHC vanligtvis visar lite inaktivering och aktiveras vid negativa potentialer bottenspår:. Synaptic strömmar i afferenta fibrerna som svar till IHC depolarisation. Notera den synaptiska depression under en 50 ms IHC depolarisation.

Figur 5. A. Föredöme extracellulära inspelning från en afferenta Bouton på postnatal dag 21. Denna spelades in vid rumstemperaturTure, med 5,8 mM extracellulärt K +. Denna inspelning är en typisk signal-brus-förhållandet för en inspelning i en beredning från en tre veckor gammal råtta. B. Genomsnittlig vågform för extracellulära händelser som spelats in från en P20 afferenta Bouton. Detta är den genomsnittliga vågformen från 10.272 händelser.

Schematisk 1. Tvärsnitt genom ett varv av en råtta cochlea illustrerar anatomiska förhållandet mellan inre och yttre hårceller, spiralen ganglierna, stria vascularis och tektorialmembranet.
Discussion
Den kritiska steget i detta förfarande är dissekering. Om vävnaden sträcks eller skadas under dissektionen kommer afferenta fibrerna inte överleva. Vävnad från yngre råttor är mer elastisk och förlåtande. Vi finner att postnatal dagar 10 till 11 lättast att dissekera och experiment har högre andelen framgångsrika. En betydande grad av Cochlear mognad inträffar postnatalt, med råttor börjat höra från omkring postnatal dag 12 14. Därför, vid en ålder där dissektion är lättast kanske synapserna inte är helt mogen 4.
Den dissekering som beskrivs här för råttor är i princip samma för möss, den viktigaste skillnaden är den mindre storleken på musen snäckan. Denna teknik gör att egenskaperna hos bandet synapser som skall undersökas i transgenically modifierade möss 15. Ytterligare ändringar i denna teknik är: att lägga till en fluorescerande färg till den intracellulära lösningen att märka fibrer 3, ihop inspelningar med det presynaptiska inre hårceller och postsynaptiska afferenta Bouton, vilket gör att överföringsfunktionen mellan före-och postsynaptiska celler som skall fastställas 2 och lös- tätning extracellulära inspelningar på afferenta boutons att undvika förlust av cellulära integritet. Den extracellulära inspelning konfigurationen är lättare att uppnå än hela-cell konfiguration och experiment är i allmänhet längre livslängd.
Disclosures
Inga intressekonflikter deklareras.
Acknowledgments
Detta arbete stöddes av en Dövhet Research Foundation forskningsanslag till EY och NIDCD DC006476 till t.ex. och genom NIDCD DC005211 till Centrum för hörsel och balans, Johns Hopkins University. Konstverk upphovsrätt Tim Phelps, Johns Hopkins University.
LG skrev första manuskriptet, EY och LG filmade dissektion och inspelningen. Alla författare som förebild siffror och bidrog till att skriva manuskriptet.
Materials
| Name | Company | Catalog Number | Comments |
| Air table | TMC | ||
| Gibraltar Stage with xy-table | Burleigh | ||
| Axioscope FS2 upright microscope DIC optics Green filter | Carl Zeiss, Inc. | ||
| Newvicon camera with controller | Dage | ||
| Monitor | Dage | ||
| Multiclamp 700B (or similar) | Molecular Devices | ||
| Digidata 1322A (or similar) | Molecular Devices | ||
| Manipulator MP285 | Sutter Instrument Co. | ||
| 6-channel valve application system for local perfusion (used with hand made perfusion pipettes) | Warner Instruments | ||
| PC with acquisition software (PClamp) | Molecular Devices | ||
| Above is the equipment in our electrophysiological setups used for recording from afferent terminals. | |||
References
- Glowatzki, E., Fuchs, P. A. Transmitter release at the hair cell ribbon synapse. Nat Neurosci. 5 (2), 147-154 (2002).
- Goutman, J. D., Glowatzki, E. Time course and calcium dependence of transmitter release at a single ribbon synapse. Proc Natl Acad Sci U S A. 104 (41), 16341-16346 (2007).
- Yi, E., Roux, I., Glowatzki, E. Dendritic HCN channels shape excitatory postsynaptic potentials at the inner hair cell afferent synapse in the mammalian cochlea. J Neurophysiol. 103 (5), 2532-2543 (2010).
- Grant, L., Yi, E., Glowatzki, E. Two modes of release shape the postsynaptic response at the inner hair cell ribbon synapse. J Neurosci. 30 (12), 4210-4220 (2010).
- LoGiudice, L., Matthews, G. The role of ribbons at sensory synapses. Neuroscientist. 15 (4), 380-391 (2009).
- Singer, J. H. Coordinated multivesicular release at a mammalian ribbon synapse. Nat Neurosci. 7 (8), 826-833 (2004).
- Keen, E. C., Hudspeth, A. J. Transfer characteristics of the hair cell's afferent synapse. Proc Natl Acad Sci U S A. 103 (14), 5537-5542 (2006).
- Li, G. L. The unitary event underlying multiquantal EPSCs at a hair cell's ribbon synapse. J Neurosci. 29 (23), 7558-7568 (2009).
- Singer, J. H., Diamond, J. S. Vesicle depletion and synaptic depression at a mammalian ribbon synapse. J Neurophysiol. 95 (5), 3191-3198 (2006).
- Suryanarayanan, A., Slaughter, M. M. Synaptic transmission mediated by internal calcium stores in rod photoreceptors. J Neurosci. 26 (6), 1759-1766 (2006).
- Neef, A. Probing the mechanism of exocytosis at the hair cell ribbon synapse. J Neurosci. 27 (47), 12933-12944 (2007).
- Tritsch, N. X. The origin of spontaneous activity in the developing auditory system. Nature. 450 (7166), 50-55 (2007).
- Kros, C. J., Ruppersberg, J. P. Expression of a potassium current in inner hair cells during development of hearing in mice. Nature. 394 (6690), 281-284 (1998).
- Muller, M. Developmental changes of frequency representation in the rat cochlea. Hear Res. 56 (1-2), 1-7 (1991).
- Seal, R. P. Sensorineural deafness and seizures in mice lacking vesicular glutamate transporter 3. Neuron. 57 (2), 263-275 (2008).



