Overview
Source: Laboratories of Dr. Ian Pepper and Dr. Charles Gerba - The University of Arizona
Demonstrating Author: Alex Wassimi
Viruses are a unique group of biological entities that infect both eukaryotic and prokaryotic organisms. They are obligate parasites that have no metabolic capacity, and in order to replicate, rely on host metabolism to produce viral parts that self-assemble inside host cells.
Viruses are ultramicroscopic—too small to be viewed with the light microscope, visible only with the greater resolution of the electron microscope. A viral particle consists of a nucleic acid genome, either DNA or RNA, surrounded by a protein coat, known as a capsid, composed of protein subunits or capsomers. In some more complex viruses, the capsid is surrounded by an additional lipid envelope, and some have spike-like surface appendages or tails.
Viruses that infect the intestinal tract of humans and animals are known as enteric viruses. They are excreted in feces and can be isolated from domestic wastewater. Viruses which infect bacteria are known as bacteriophages, and those which infect coliform bacteria are called coliphages (Figure 1). The phages of coliform bacteria are found anywhere coliform bacteria are found.
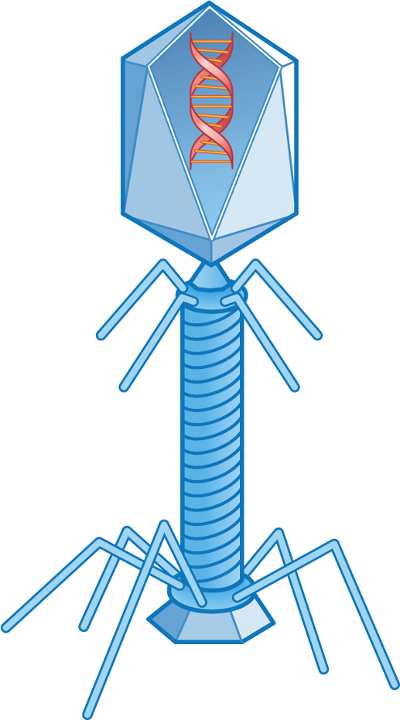
Figure 1. Coliphage T2.
Principles
Bacteriophages are studied in environmental science because they are a critical component of biological systems. They are the most abundant biological entity on earth and are important because they help control bacterial populations, food web processes, biogeochemical cycles, as well as enhance prokaryotic diversity via horizontal gene transfer. There is also evidence that phages are reliable surrogate indicators for disease-causing enteric viruses that are also fecally-transmitted but difficult to assay. The availability of relatively quick and inexpensive methods to enumerate bacteriophages makes them an attractive tool for the assessment of fecal contamination in environmental samples.
Coliphages in water are assayed by addition of a sample to soft or overlay agar along with a culture of E. coli in the log phase of growth. The phage attach to the bacterial cell and lyse the bacteria. The bacteria produce a confluent lawn of growth except for areas where the phage has grown and lysed the bacteria. These resulting clear areas are known as plaques. A soft agar overlay is used to restrict the physical diffusion of the viruses so that, upon lysing out of a bacterium, they can only spread to neighboring bacterial cells.
To obtain optimal plaque formation it is important that the host bacteria is in the log stage of growth. This ensures that all the phage attach to live bacteria and produce progeny. This requires that a culture of host bacteria be prepared each day that an assay is performed. Usually, a culture is incubated the day before the assay so that it will be in the stationary phase. On the day of the assay, the culture is used to inoculate a broth, which is incubated to obtain enough host bacteria in the log phase for the assay (this usually requires 2-3 h of incubation in a shaking water bath at 35-37 °C).
Subscription Required. Please recommend JoVE to your librarian.
Procedure
- Obtain a sample of sewage or water containing coliphage.
- Dilute the sample 1:10 and 1:100 using Tris buffer. Do this by transferring 1.0 mL of culture to 9 mL of Tris buffer, and then making a second 10-fold dilution.
- Melt three tubes of soft agar (0.7% nutrient agar or trypticase soy agar per 3 mL tube) by placing them in a steam bath or autoclave.
- Place the agar in a water bath at 45-48 °C for 15 min to allow the temperature of the agar to adjust to 45 °C.
- To the first tube, add 1 mL of a log phase broth culture of E. coli1 and 1 mL of undiluted sample.
- Remove the tube from the water bath and gently rock between hands to mix the suspension for 2-3 s.
- Wipe the water from the tube with a paper towel and pour the agar over a previously prepared Petri dish containing bottom agar (regular nutrient agar or trypticase soy agar).
- Quickly rotate the plate to spread the top agar. Be sure the agar covers the entire surface.
- Repeat Steps 5-8 with the other two tubes of soft agar, using 1 mL of bacteria and 1 mL of each sample dilution (Figure 2).
- After the agar has solidified, invert the Petri dishes and incubate at 37 °C for 48 h. Knock any moisture off the lid of the Petri dish. If a drop of moisture falls on a plaque it will cause the virus to spread across the agar surface.
- After the incubation, count the number of plaques on each dilution (Figure 3) and calculate the concentration of phage in the original sample. Record any major differences in the size or appearance of the plaques.

Figure 2. Procedure for the preparation of a bacterial lawn using top agar for coliphage enumeration.

Figure 3. Phage plaques on a bacterial lawn.
1E. coli strain ATCC 15597 usually will produce the greatest number of plaques from sewage samples. It should be grown overnight in a 250-mL Erlenmeyer flask containing 100 mL of nutrient or trypticase soy broth and incubated under shaking conditions at 35 °C. 3 h before the phage assay inoculate one mL of this culture into a fresh flask containing 100 mL of nutrient or trypticase soy broth and place in a shaking water bath at 35-37 °C. This will ensure that the bacteria are in the log phase of growth.
Viruses are infectious biological particles that are responsible for many diseases, cold and flu, to hepatitis and HIV.
Viruses are biological particles consisting of either a DNA or RNA genome, wrapped inside a protein coat known as a capsid, sometimes with an additional lipid envelope. Viruses have no metabolic or reproductive ability on their own, and must invade living cells and hijack their cellular machinery in order to make more copies of themselves.
Both prokaryotic cells, such as bacteria, and eukaryotic cells, such as those of humans, can be infected by specific classes of viruses. Specifically, bacteriophages are viruses that infect bacteria. For example, coliphages are those phages that infect E. coli, a common gut bacterium, some strains of which can cause food poisoning, and which is an indication of fecal contamination of the water supply.
While phages themselves are not generally known to be pathogenic in humans, there is evidence that they are reliable surrogate indicators for disease-causing enteroviruses that are also fecally-transmitted but difficult to assay. The availability of relatively quick and inexpensive methods to enumerate bacteriophages makes them an attractive tool for the assessment of fecal contamination in environmental samples.
This video will introduce the principles behind phage enumeration; demonstrate a protocol for quantifying phages, known as the plaque assay; and finally, explore several environmental science applications for the detection and counting of phages and other viruses.
Bacteriophages, like all viruses, must parasitize living cells, in this case bacteria, in order to reproduce.
Phages do so by landing and attaching to the bacterial cell surface and injecting their genetic materials into the cell. Once inside the cell, the viral genome is replicated and the protein components of the viral capsid are produced, both using the host cell's biochemical machinery. Once the phage particles are assembled, they are released from the bacteria, often by lysing the host and bursting out, killing the host cell in the process.
A widely used method for determining phage concentration in a sample takes advantage of this lytic activity. In this technique, the phage from the sample is mixed with bacteria and soft agar. This mixture is poured onto Petri dishes with regular agar as a substrate, and the top layer forms an overlay.
The bacteria are at such a high concentration that they form a continuous lawn. The bacteria should be obtained from culture that is in the log phase of growth, to ensure that every bacterium that the phages infect is alive and allows the phage to produce progeny.
When a phage particle infects and lyses a bacterium, the phage progeny will spread to nearby bacterial cells and continue the infection. The soft agar restricts the diffusion of the phage particles. Eventually, an area of clearing, known as a plaque, will be formed.
If the phage is diluted to a low enough concentration, then discrete, individual plaques can be observed on the bacterial lawn. These can be counted and used to calculate the number of plaque-forming units, or PFUs, of phage per mL of the original sample.
Now that you understand how phages infect bacteria and how this activity can be used to measure phage concentration, let's go through a protocol for using a plaque assay to enumerate phages in environmental water samples.
One day before performing the assay, inoculate a colony of E. coli strain ATCC 15597 into 100 mL of trypticase soy broth in a 250-mL Erlenmeyer flask. Incubate it with shaking at 35 °C overnight.
3 h before the assay, inoculate 1 mL of the overnight E. coli culture into a fresh 100 mL of broth. Place this new culture into a shaking water bath at a temperature between 35 and 37 °C. This ensures that the bacteria are in the log phase of growth when the assay begins.
To start the plaque assay, make 10- and 100-fold serial dilutions of the water sample, using 9 mL of Tris buffer.
Using a steam bath, melt three 5-mL tubes of 0.7% soft top agar, either trypticase soy or nutrient agar. Once melted, place in a water bath at 45 to 48 °C for at least 15 min for the agar's temperature to drop to 45 °C.
To the first tube of soft agar, add 1 mL of the previously prepared log-phase E. coli culture and 1 mL of the undiluted water sample. Remove the tube from the water bath and gently rock between your hands for 2-3 s to mix the suspension.
Pour the soft agar over a previously prepared Petri dish with trypticase soy or nutrient agar. Quickly rotate the plate to spread, making sure that it covers the entire surface.
Repeat the inoculation and plating for the other two tubes, using 1 mL of each of the diluted samples.
Once the top agar has solidified, invert the dishes and incubate them at 37 °C for 48 h.
After the incubation, count the number of plagues on each plate. From the count, calculate the phage concentration in the original sample
For example, if 9 plaques were obtained from the 10-fold dilution plate, then there are 9 times 10 divided by 1 mL, or 90 PFUs/mL of coliphage in the original water sample.
Now that you have seen how phage plaque assays are performed, let's look at how plaque assays can be used to enumerate phage and other types of viruses from a variety of sources.
Plaque assay-based methods can be used to isolate bacteriophage from different environmental samples such as soil. In this example, researchers first collected phage from soil by filtration. The phage was then used to infect the common soil bacteria Arthrobacter in a plaque assay. Phages were picked from individual plaques and streaked onto new agar plates, and then overlaid with bacteria-containing top agar. Phage concentration decreases along the length of the streak, so that discrete plaques, likely formed by a single type of phage, might be obtained. These individual plaques could then be picked to further analyze the phages within.
In addition to bacteriophages, plaque assays can also be performed with other viruses, including those, such as influenza, that infect mammals. To do this, mammalian cells are first grown up as monolayers in tissue culture dishes. Media containing the viruses are then added to the cells to allow infection to occur, before the cells are overlaid with an immobilizing medium such as the gel-like agarose. After an incubation period that could last up to two weeks, the infected cells are fixed and stained to allow the plaques to be visualized and counted.
Finally, in addition to samples collected from the environment, plaque assays are useful for detecting and enumerating viruses in tissue samples from infected individuals. Here, researchers obtained and homogenized lung tissues from mice infected with gamma-herpesviruses. This virus-containing homogenate was then used to infect mammalian cell culture. The number of plaques could then be counted to provide an estimate for the viral titer in the infected lung tissues.
You have just watched JoVE's video on the detection of bacteriophages in environmental samples. You should now understand the basic biology of phages, how to perform a plaque assay to quantitate phages in an environmental sample, and how plaque assays can be used to study phages and other viruses in environmental or clinical samples. As always, thanks for watching!
Subscription Required. Please recommend JoVE to your librarian.
Results
Dilution of sewage sample = 10-1
Number of plaques obtained = 9
Therefore, phage concentration in sewage sample
= 10 x 9 ÷ 1 mL
= 90 plaque-forming units / mL
Raw sewage typically contains 103 – 104 coliphage per mL, with a range of 102 – 108 per mL.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
There are many potential applications of coliphages as environmental indicators. These include their use as indicators of sewage contamination, efficiency of water and wastewater treatment, and survival of enteric viruses and bacteria in the environment. The use of bacteriophages as indicators of the presence and behavior of enteric bacteria and animal viruses has always been attractive because of the ease of detection and low cost associated with phage assays. In addition, they can be quantified in environmental samples within 24 h as compared to days or weeks for enteric viruses.
1E. coli strain ATCC 15597 usually will produce the greatest number of plaques from sewage samples. It should be grown overnight in a 250-mL Erlenmeyer flask containing 100 mL of nutrient or trypticase soy broth and incubated under shaking conditions at 35 °C. 3 h before the phage assay inoculate one mL of this culture into a fresh flask containing 100 mL of nutrient or trypticase soy broth and place in a shaking water bath at 35-37 °C. This will ensure that the bacteria are in the log phase of growth.
Subscription Required. Please recommend JoVE to your librarian.




