ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
بانتظام مجمع إينتيرسباسيد في البروتين قصيرة المتناوب يكرر/كريسبر المرتبطة 9 (كريسبر/Cas9) نظام يوفر أداة واعدة للهندسة الوراثية، وتفتح إمكانية التكامل المستهدفة من المتسلسلات. يصف لنا نهاية التماثل بوساطة من الالتحاق بالعمل (هميج)-على أساس استراتيجية للحمض النووي فعالة تستهدف الاندماج في فيفو واستهدف العلاج الجيني باستخدام كريسبر/Cas9.
Abstract
كمنصة تحرير جينوم واعدة، النظام كريسبر/Cas9 بإمكانات كبيرة لكفاءة المعالجة الجينية، خاصة بالنسبة للتكامل المستهدفة من المتسلسلات. ومع ذلك، بسبب انخفاض كفاءة جزئ المتجانسة (الموارد البشرية) والطفرات إينديل مختلف للغاية غير المتجانسة الالتحاق بالعمل (نج)-على أساس الاستراتيجيات في عدم تقسيم الخلايا، في فيفو الجينوم التحرير ما زال يشكل تحديا كبيرا. هنا، يمكننا وصف حد التماثل بوساطة الالتحاق بالعمل (هميج)-على أساس نظام كريسبر/Cas9 للكفاءة في فيفو دقيقة التكامل المستهدفة. في هذا النظام، ناقلات الجينوم المستهدفة والجهات المانحة التي تحتوي على التماثل الأسلحة (~ 800 bp) يحف به دليل واحد الحمض النووي الريبي (سجرنا) المستهدفة هي المشقوق متواليات من كريسبر/Cas9. هذه الاستراتيجية على أساس هميج يحقق التكامل التحوير كفاءة في الماوس زيجوتيس، وكذلك في خلايا الكبد في الجسم الحي. وعلاوة على ذلك، يوفر نهج فعالة لتصحيح فوماريلاسيتواسيتاتي هيدرولاز (فاه) الطفرات في خلايا الكبد استراتيجية تستند إلى هميج وتنقذ فاه-النقص الناجم عن فشل الكبد في الفئران. مجتمعة، مع التركيز على استهداف التكامل، وتوفر هذه الاستراتيجية على أساس هميج أداة واعدة لمجموعة متنوعة من التطبيقات، بما في ذلك توليد نماذج حيوانية معدلة وراثيا والعلاج بالجينات المستهدفة.
Introduction
تحرير الجينوم الدقيقة، وتستهدف في كثير من الأحيان المطلوبة لإنتاج نماذج حيوانية معدلة وراثيا والعلاجات السريرية. بذلت الكثير من الجهد لوضع استراتيجيات مختلفة لكفاءة الجينوم المستهدفة، مثل نوكلاس إصبع الزنك (زفن)، تحرير النسخ المستجيب المنشط--مثل نوكليسيس (تالينس)، ونظم كريسبر/Cas9. هذه الاستراتيجيات إنشاء فواصل مزدوجة-حبلا الحمض النووي المستهدف (جهاز تسوية المنازعات) في الجينوم، والاستفادة من أنظمة إصلاح الحمض النووي الجوهرية، مثل جزئ المتجانسة (الموارد البشرية)1،2، ميكروهومولوجي بوساطة نهاية الالتحاق بالعمل (ميج)3 , 4 , 5، ونهاية غير المتجانسة الالتحاق بالعمل (نج)6،،من78 للحث على التكامل المستهدفة المتسلسلات1،9. الاستراتيجية المستندة إلى الموارد البشرية حاليا الأكثر استخداماً الجينوم تحرير نهج، وفعالة جداً في خطوط الخلايا، ولكن لا يسهل على عدم تقسيم الخلايا بسبب حدوثه المقيدة في أواخر المرحلة S/G2. وهكذا، الاستراتيجية المستندة إلى الموارد البشرية لا ينطبق للتحرير في فيفو الجينوم. في الآونة الأخيرة، وضعت استراتيجية تستند إلى نهيج للجينات كفاءة تدق في الماوس الأنسجة8. ومع ذلك، الأسلوب القائم على نج عادة ما يدخل إينديلس في الوصلات، مما يجعل من الصعب على توليد التحرير الجينوم الدقيقة، وخصوصا عندما تحاول بناء الجينات الانصهار في الإطار8. ميج-على أساس التكامل المستهدف قادر على تحرير الجينوم الدقيقة. ومع ذلك، فقط تواضع أنه يزيد من كفاءة التكامل المستهدفة في التقارير السابقة5. ولذلك، تحسين كفاءة دقيقة التكامل المستهدفة في فيفو حاجة ملحة لتطبيقات علاجية واسعة3.
في عمل نشرت مؤخرا، أثبتنا حد التماثل بوساطة الالتحاق بالعمل (هميج)-على أساس الاستراتيجية، التي أظهرت أعلى كفاءة التكامل المستهدفة في استراتيجيات كل المبلغ عنها على حد سواء في المختبر و في فيفو10. هنا، يمكننا وصف بروتوكول لإنشاء نظام هميج، وأيضا بناء ناقلات الجيش الملكي النيبالي (سجرنا) واحد-دليل استهداف الجين للفائدة والجهة المانحة متجهات إيواء المواقع المستهدفة سجرنا و ~ 800 شركة بريتيش بتروليوم التماثل الأسلحة (الشكل 1) . في هذا البروتوكول، كما تصف الخطوات التفصيلية لجيل من الحمض النووي تدق في الفئران وخطوات قصيرة للتكامل المستهدفة في الأنسجة في الجسم الحي. وعلاوة على ذلك، دراسة دليل على مفهوم الاستراتيجية المستندة إلى هميج أثبت قدرته على تصحيح الطفرة فاه وإنقاذ فاه-/- الكبد الفشل الفئران، كما كشفت عن إمكانياتها العلاجية.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
جميع الإجراءات بما في ذلك المواد الحيوانية عليها قبل "لجنة أخلاقيات البحوث الطبية الحيوية" في "معاهد شانغهاي" للعلوم البيولوجية (CAS).
1-تصميم والبلازميدات المانحين
-
اختيار سجرنا
- استخدام أدوات التصميم كريسبر أون لاين للتنبؤ سجرناس على الهدف المنطقة11،12،13،،من1415. لمحور Cdx2 ، تصميم ستة سجرناس مختلفة (Cdx2-sgRNA1 ~Cdx2-sgRNA6) حول الإيقاف كودون مع إمكانيات أعلى رتبة وأقل قبالة-الأهداف (الشكل 1أ)16.
- لينيريزي 2 ميكروغرام من ناقلات التعبير Cas9-CMV-اجفب وسجرنا ببسي الهضم (1 ميليلتر من بسي ح 2 في 37 درجة مئوية بتركيز نهائي 1 يو/ميليلتر في حجم 20 ميليلتر). ثم تنقية المنتج من جل تنقية عدة مع 1% [اغروس] هلام × 1 تاي المخزن المؤقت.
- ميكس زوج من النوكليوتيد سجرنا في 10 ميليلتر من الحمض النووي T4 × 1 ليجاسى المخزن المؤقت إلى تركيز نهائي من 50 ميكرومتر. احتضان اليغو الحل باستخدام تدرج درجة الحرارة من 95 درجة مئوية إلى 25 درجة مئوية بمعدل تغير درجة حرارة من 5 درجة مئوية/5 دقيقة (95 درجة مئوية لمدة 5 دقائق ، ثم 90 درجة مئوية لمدة 5 دقائق، 85 درجة مئوية لمدة 5 دقائق، إلخ.)، الذي سوف يصلب في أوليجوس.
- ميليلتر 4 مزيج من تعتيق المنتج، 2 ميليلتر من ناقلات خطية مع 1 ميليلتر من ليجاسى T4 الحمض النووي في ميليلتر 10 1 × الحمض النووي T4 ليجاسى المخزن المؤقت، واضطر ثم عند 22 درجة مئوية ح 1-2 (الشكل 1ب).
-
مساح نوكلاس المقايسة من سجرنا
ملاحظة: كفاءة سجرنا استخدمت في التجربة تدق في استهداف تم تقييمه بواسطة الإنزيم nuclease مساح (المعروف أيضا T7 endonuclease أنا (T7EI) الاعتداء)17. حدد سجرنا مع كفاءة عالية من الانقسام والحمض النووي وعلى مسافة منخفضة بين الموقع قطع سجرنا كودون التوقف.- ترانسفيكت Cas9-سجرنا-اجفب التعبير متجهات إلى خطوط الخلايا N2a المستزرعة في دميم وتستكمل مع 10% مصل بقرى الجنين، 1% باريس سان جيرمان، و 1% من الأحماض الأمينية غير الضرورية قبل تعداء كيت (انظر الجدول للمواد). احتضان transfected الخلايا عند 37 درجة مئوية في شركة 5%2.
- بعد 48 ساعة حضانة، جمع الخلايا transfected 5,000 (التجارة والنقل+) بالأسفار تنشيط الخلية الفرز (نظام مراقبة الأصول الميدانية) باستخدام خلايا غير transfected كعنصر تحكم.
- هضم الخلايا التي تم جمعها في 2-5 ميليلتر أوفليسيس العازلة (0.1% X-100 تريتون، 0.1% توين 20، و 100 ميكروغرام/مل ك البروتيناز) في 56 درجة مئوية لمدة 30 دقيقة، ومن ثم تعطيل الحرارة بروتيناز ك عند 95 درجة مئوية لمدة 10 دقائق.
- تضخيم العينة من يعشق [بكر] (الجدول 1) باستخدام البروتوكول الخاص بالشركة المصنعة. يتم تعيين حجم منتجات PCR إلى 300-500 bp.
- ميليلتر 1 مزيج المنتج تحلل مع بوليميراز الدنا وزوج من الإشعال الخارجي الاعتراف بالتسلسل حول الموقع المستهدف سجرنا (0.1 ميكرومتر، وتركيز النهائي) (الجدول 1)، وأداء بكر الأساسي في حجم 20 ميليلتر.
- تنشيط بوليميراز الدنا في 95 درجة مئوية لمدة 5 دقائق، وأداء بكر الابتدائي لدورات 30 عند 95 درجة مئوية لمدة 30 ثانية، 60 درجة مئوية لمدة 30 s، و 72 درجة مئوية 24 s (1 دقيقة/1 كيلو بايت)، مع ملحق نهائي في 72 درجة مئوية لمدة 5 دقائق.
- أداء بكر الثانوية باستخدام 1 ميليلتر من المنتجات الأولية بكر وزوج من أجهزة الإشعال الداخلية المتداخلة.
- تؤذي ويصلب نغ 300-600 منتج بكر المنقي في ميليلتر 20 × 1 T7EI رد فعل المخزن المؤقت (50 مم كلوريد الصوديوم، 10 مم تريس-HCl، 10 مم مجكل2، 1 مم DTT الأس الهيدروجيني 7.9) لإعادة استخدام تدرج في درجة الحرارة من 95 درجة مئوية إلى 25 درجة مئوية بمعدل 5 درجات مئوية/5 دقيقة.
- أضف 1 ميليلتر من الإنزيم T7EI ملدنة [بكر] منتوجات وهضم في 37 درجة مئوية ح 2. قم بتشغيل المنتج الهضم على 2% [اغروس] هلام في المخزن المؤقت تاي 1 × في 120 الخامس لمدة 40 دقيقة حتى يتم فصل الأجزاء (انظر الجدول للمواد).
- استخدام إيماجيج لتحديد كثافة الفرقة قص وتقطيعه الحمض النووي. حساب التردد إينديل استخدام الأساليب كما سبق وذكرت9 (الشكل 1ج).
-
بناء ناقلات المانحين
ملاحظة: لإنشاء هميج المانحة الناقلة للجينات Cdx2 ، بناء إحدى الجهات مانحة الحمض النووي (800 هال-p2A-مشري-800 شركة بريتيش بتروليوم bp هار) الذي كان واقفاً مع 23 nt Cdx2-سجرناس استهداف تسلسل في كلا طرفي (الشكل 1د والرقم 1ﻫ). وكان بام تسلسل الهدف المتاخمة لنهاية الذراع مثلى. وأوصت الجمعية جيبسون هو للمانحين هميج الاستنساخ.- تضخيم الذراع الأيسر التماثل bp 800 (HAL) مع الأمام التمهيدي-1F (تحتوي على 15-20 nt التداخل تسلسل من ناقلات، 23 nt تسلسل استهداف Cdx2-سجرنا، وتسلسل nt حوالي 20 من HAL) وعكس التمهيدي-1R (تحتوي على 15-20 شركة بريتيش بتروليوم التداخل تسلسل من p2A-مشري وتسلسل nt حوالي 20 من HAL) في تركيز 0.1 ميكرومتر النهائي باستخدام الماوس المجينية الحمض النووي في 200 نانوغرام/ميليلتر (الشكل 1د، الجدول 1).
- تضخيم الجزء الإدراج مشري p2A مع التمهيدي إلى الأمام-2 واو (التي تحتوي على تسلسل التداخل nt 15-20 من هال وتسلسل nt حوالي 20 من يفتت الإدراج) وعكس التمهيدي-2R (التي تحتوي على تسلسل التداخل nt 15-20 من هار وتسلسل nt حوالي 20 من الجزء الإدراج) 0.1 ميكرومتر النهائي تركيز استخدام الجينوم الحمض النووي أو بلازميد مع تسلسل مراسل في 100 نانوغرام/ميليلتر أو 30 نانوغرام/ميليلتر (الشكل 1د، الجدول 1).
- تضخيم الذراع اليمنى التماثل bp 800 (هار) مع الأمام التمهيدي-3F (تحتوي على 15-20 nt التداخل تسلسل من ناقلات، 23 nt تسلسل استهداف Cdx2-سجرنا، وتسلسل nt حوالي 20 من هار) وعكس التمهيدي-3R (تحتوي على 15-20 nt التداخل تسلسل من p2A-مشري وتسلسل nt حوالي 20 من هار) في تركيز 0.1 ميكرومتر النهائي باستخدام الماوس المجينية الحمض النووي في 200 نانوغرام/ميليلتر (الشكل 1د، الجدول 1).
- تشغيل كافة منتجات PCR على 1% [اغروس] هلام × 1 تاي المخزن المؤقت، وتنقية منتجات PCR الحجم المتوقع من جل استخراج عدة، وفقا لإرشادات الشركة المصنعة (الجدول 1).
- هضم 50-100 نانوغرام من ناقل بناء مع كبني وإكسباي. تضخم ميليلتر ميكس 2 ناقل خطية في 30-40 نانوغرام/ميليلتر مع بكر ثلاث شظايا (1 ميليلتر لكل، 100-200 نانوغرام/ميليلتر) في 2 x ميكس جيبسون. إضافة ح2س لضبط وحدة التخزين النهائي إلى 10 µL.Incubate ميكس في 50 درجة مئوية لمدة 60 دقيقة.
- تحويل المختصة كولاي الخلايا مع جميع المنتجات المجمعة واستخراج بلازميد نيات بأدوات استخراج الحمض النووي وفقا لإرشادات الشركة المصنعة. التحقق من الجهة المانحة هميج بتسلسل الحمض النووي.
2-الجينوم التحرير في الأجنة الماوس باستخدام الأسلوب القائم على هميج
-
إنتاج مرناً Cas9
- لإعداد Cas9 مرناً، إضافة تسلسل المروج T7 إلى Cas9 ترميز المنطقة من [بكر] تضخيم استخدام زوج التمهيدي المناسبة المدرجة في الجدول 1. إضافة التمهيدي Cas9 F/R في تركيز نهائي من 0.1 ميكرون و 20 نانوغرام Cas9 التعبير عن متجه إلى 1 × عالي الدقة ميكس بوليميريز الحمض النووي. ضبط الحجم النهائي إلى 50 ميليلتر مع H2o.
- تنشيط بوليميراز الدنا في 95 درجة مئوية لمدة 5 دقائق، والقيام بكر لدورات 36 في 95 درجة مئوية لمدة 30 ثانية، 60 درجة مئوية لمدة 30 ثانية، و 68 درجة مئوية لمدة 4 دقيقة (1 دقيقة/1 كيلو بايت)، مع ملحق نهائي في 68 درجة مئوية لمدة 10 دقائق.
- تنقية المنتج "بكر" T7-Cas9 للنسخ في المختبر (IVT) ومن ثم نسخ 0.5-1 ميكروغرام الحمض النووي من مجموعة النسخ مرناً في 37 درجة مئوية ح 8 في إجمالي حجم 20 ميليلتر، وفقا لإرشادات الشركة المصنعة (انظر الجدول للمواد).
- أضف 1 ميليلتر من الدناز إلى الخليط إزالة قالب الحمض النووي في 37 درجة مئوية ل 15 دقيقة إضافة ذيل بولي-أ لمدة 45 دقيقة عند 37 درجة مئوية واسترداد مرناً Cas9 بمواد تنقية الجيش الملكي النيبالي، وفقا لإرشادات الشركة المصنعة (انظر الجدول للمواد).
-
إنتاج سجرنا
- إنشاء قالب سجرنا مدفوعا بمروج T7 مع بوليميراز الدنا عالي الدقة كما أعلاه. اختر سقالة سجرنا التي تحتوي على ناقل كالقالب. يتم سرد أجهزة الإشعال المستخدمة في الجدول 1.
- تنقية المنتج بكر سجرنا T7 واستخدام 0.5-1 ميكروغرام DNA كالقالب للنسخ في المختبر من سجرنا استخدام مجموعة نسخ الحمض النووي الريبي قصيرة في 37 درجة مئوية ح 6 في إجمالي حجم 20 ميليلتر، وفقا لإرشادات الشركة المصنعة (انظر "الجدول للمواد" < /c11 >).
- إضافة 1 ميليلتر من الدناز إلى الخليط ويستمر في الحضانة عند 37 درجة مئوية لمدة 15 دقيقة لإزالة قالب الحمض النووي. تنقية سجرناس بالحمض النووي الريبي تنقية عدة، كما ذكر أعلاه (انظر الجدول للمواد).
- تمييع سجرنا إلى 500 نانوغرام/ميليلتر في المياه خالية من رناسي وتخزين العينات في −80 درجة مئوية لمدة تصل إلى 3 أشهر.
ملاحظة: ريبونوكليوبروتينس كريسبر (رنبس) استبدال بديلة مع أفضل قطع كفاءة18،،من1920.
-
ثقافة جمع و microinjection و في المختبر الجنين
- سوبيروفولاتي الإناث B6D2F1 (C57BL/6 × DBA2J) الفئران (7-8 أسابيع من العمر) التي تروج مصل الفرس الحامل (بمسج)، تليها تروج المشيمية البشرية (hCG) 48 ساعة في وقت لاحق. بعد حقن قوات حرس السواحل الهايتية، دار الإناث مع الذكور B6D2F1 خلال الليل.
- التضحية الإناث بأول أكسيد الكربون2 التخدير، 24 ساعة بعد الحقن قوات حرس السواحل الهايتية. جمع أجنة مخصبة من أوفيدوكتس بهم (مع الأجنة 30-50 لكل أنثى) في المتوسط M2.
- مكان أجنة مخصبة (البيض حوالي 300 لحقن يوم واحد) في المتوسط كسم (5.55 غرام/لتر كلوريد الصوديوم، 0.19 غرام/لتر بوكل، 0.05 غرام/لتر خ2ص4، 0.05 غرام/لتر •7H مجسو42س، 0.04 غرام/لتر جلوكوز، 1.12 غرام/لتر الصوديوم لاكتات، 2.1 غرام/لتر ناكو3 ، بيروفات صوديوم 0.02 غرام/لتر، 0.25 غرام/لتر كاكل2•2H2س، يدتا 0.004 غرام/لتر، 0.146 غرام/لتر لتر-الجلوتامين، والبومين المصل البقري 1 غرام/لتر) عند 37 درجة مئوية في حاضنة مع شركة 5%2.
- Cas9 ميكس مرناً (100 نانوغرام/ميليلتر)، سجرنا (50 نانوغرام/ميليلتر)، والجهات المانحة هميج ناقلات (100 نانوغرام/ميليلتر)، وإضافة ح2س لضبط وحدة التخزين النهائي إلى 10 ميليلتر. وضع الخليط على الجليد.
- سحب الإبر الشعرية (القطر الخارجي 1.0 مم، القطر الداخلي 0.78 مم مع خيوط) باستخدام "ساحبة ميكروبيبيتي" (معلمات: الحرارة، الضغط، 300 74؛ سحب، 60؛ والتأخر، 200؛ السرعة، 80. انظر الجدول للمواد). وسيكون الإبر التجارية استبدال بديلة microinjection.
- حقن وحدة تخزين محتمل الخليط في السيتوبلازم زيجوتيس مع برونوكلي المعالم في معالجة تجميعية من كزب حبيس المتوسطة التي تحتوي على 5 ميكروغرام/مل سيتوتشالاسين ب استخدام ميكروينجيكتور مع ثابت تدفق إعدادات (الشكل 2أ) (انظر جدول المواد)21.
ملاحظة: يجب أن تحقن كل مجموعة من زيجوتيس خلال 20-30 دقيقة ب سيتوتشالاسين يمكن أن تزيد صلاحية اقحه الماوس بعد الحقن. وبدلاً من ذلك، يمكن أن تعمل microinjection مع نظام بيزو، كما هو موضح سابقا22. - الثقافة zygotes حقنه في المتوسط كسم في 37 درجة مئوية تحت 5% CO2 حتى الكيسة المرحلة بعد أيام 3.5 للمراقبة الفلورية (الأرقام 2 2ج).
-
نقل الأجنة وجيل من الفئران
- ورفيقه استروس الفئران الإناث الممثل المدني الدولي مع الممثل المدني الدولي استؤصل الاسهر لديهم الفئران الذكور كحقن في اليوم نفسه.
- الثقافة zygotes حقنه في مرحلة 2-خلية عند 37 درجة مئوية تحت 5 CO2، ونقل 25-30 2-خلايا الأجنة في أوفيدوكتس بسيودوبريجنانت الإناث الممثل المدني الدولي في يوم 0.5 وظيفة كويتوم (dpc). تسليم الأمهات المستفيدات الجراء في 19.5 dpc.
-
التنميط الماوس
- استخراج الحمض النووي الماوس من أخمص القدمين أو ذيل العينات باستخدام مجموعة أدوات استخراج الحمض النووي، طبقاً لإرشادات الشركة المصنعة (انظر الجدول للمواد).
- تحديد تقاطع 5 'و 3' تدق في الأحداث باستخدام 200-400 نانوغرام من الحمض النووي تقاس الأشعة فوق البنفسجية/إزاء قياس الطيف الكتلي كقالب لأداء amplification بكر.
- تنشيط بوليميراز الدنا في 95 درجة مئوية لمدة 5 دقائق، والقيام بكر لدورات 38 في 95 درجة مئوية لمدة 30 ثانية، 60 درجة مئوية لمدة 30 ثانية، و 72 درجة مئوية لمدة 1 دقيقة (1 دقيقة/1 كيلو بايت)، مع تمديد نهائي في 72 درجة مئوية لمدة 10 دقائق. لتقاطع 5 '، استخدم التمهيدي إلى الأمام في المراحل الأولى من HAL، بعكس في جزء طريقة الكبس (p2A-مشري). بشأن 3 ' تقاطع، استخدام التمهيدي إلى الأمام في جزء طريقة الكبس (p2A-مشري)، بعكس واحد على المتلقين للمعلومات من هار (الجدول 1).
- تشغيل 6 ميليلتر من المنتج بكر على 1% [اغروس] هلام في 1 × تاي المخزن المؤقت والتحقق من حجم جزء المتوقعة. ثم التحقق منها بالحمض النووي التسلسل (الشكل 2د).
3. المستندة إلى هميج في فيفو الجينوم التحرير في خلايا الكبد
- ضع الماوس C57BL/6J المتلقية (8 أسابيع) في جهاز تقييدي والذيل من خلال الشق.
- مزيج هميج المانحة ناقلات (30 ميكروغرام) وناقلات التعبير spCas9 (30 ميكروغرام) في 2 مل المحلول الملحي. لمراقبة التجربة، تعليق هميج المانحة ناقلات (30 ميكروغرام) في 2 مل المحلول الملحي (الشكل 3أ).
- تنظيف ذيل الماوس مع الإيثانول 70%. إدراج الإبرة في الذيل الوريد وحقن الحل بلازميد الحمض النووي داخل س. 5-7 إزالة الإبرة وحرر الماوس من الجهاز تقييدي.
- التضحية الفئران بأول أكسيد الكربون2 التخدير بعد 5-9 أيام بعد الحقن. نتخلل ترانسكارديالي الفئران مع المالحة 0.9 في المائة وتليها بارافورمالدهيد 4% باستخدام مضخة تمعجية وإصلاح الكبد بين عشية وضحاها في 4 درجات مئوية.
- يذوي الأنسجة استخدام السكروز 30% بين عشية وضحاها، حتى أنها المصارف إلى الجزء السفلي من الأنبوب.
- قسم الأنسجة المجمدة في سمك من 10 ميكرون لعينات الكبد.
- شطف المقاطع ثلاث مرات في مخزنة الفوسفات 0.1 M (PB) واحتضانها لهم مع جسم الأولية: أرنب المضادة-مشري (مخففة في 5% خ ع) بين عشية وضحاها في 4 درجات مئوية.
- أغسل أقسام ثلاث مرات في الجريدة الرسمية، وثم احتضانها لهم مع الجسم المضاد الثانوي: Cy3-أفينيبوري الماعز الأرنب المضادة "مفتش" ح 2 في درجة حرارة الغرفة على شاكر مداري.
- كونتيرستين الأقسام مع DAPI لمدة 20 دقيقة وجبل مع الغليسرين على الشرائح الزجاجية لمزيد من المراقبة الفلورية (الشكل 3ب).
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
الجينوم المستندة إلى هميج التحرير في أجنة الفأر: لتحديد كفاءة تدق في الأسلوب القائم على هميج في زيجوتيس الماوس، ونحن تسليمها Cas9 مرناً، سجرنا استهداف الجين Cdx2 والجهة المانحة هميج في الماوس زيجوتيس، الذي صمم للصمامات جين مراسل مشري p2A إلى كودون آخر من Cdx2 الجينات (الشكل 2أ). وتطورت zygotes حقن بلاستوسيستس في الثقافة. لتقييم فعالية طريقة الكبس، قمنا بتحليل fluorescence مشري مع مجهر فلوري، ووجدنا أن 12.9% blastocysts تلقي الجهات المانحة هميج كانت إيجابية مشري، الذي أعرب عن دقة في تروفيكتوديرم (أرقام 2B ، ج 2). حسب تسلسلها الفئران إيجابية PCR، وجدنا أيضا أن كل دراسة أحداث التكامل كانت دقيقة في إطار التكامل في تقاطعات وعلى حد سواء 5 '3' (الشكل 2د).
الجينوم المستندة إلى هميج التحرير في أنسجة البالغين، والعلاج الجيني بوساطة هميج: للتحقيق في ما إذا كان التحرير على أساس هميج الجينوم يمكن تطبيقها في أنسجة البالغين، أدرجنا كاسيت مشري الحق قبل كودون التوقف للجينات أكتب من ترانسدوسينج أكتب-هميج ثوابت لكبد الفأر C57/B6J بالوريد الذيل حقن هيدرودينامية (الشكل 3أ). وبعد 7 أيام حقن، وجدنا أن ما يقرب من نصف خلايا الكبد ترانسفيكتيد وأعرب عن متشيري كما الملون في أقسام الكبد (الشكل 3ب).
لاستكشاف إمكانية استخدام استراتيجية تستند إلى هميج للعلاج الجيني، استخدمنا فوماريلاسيتواسيتاتي هيدرولاز (فاه)-الفئران ناقصة. هو الماوس-/- فاهراسخة tyrosinemia وراثية النوع الأول من طراز الماوس (HTI)، التي تؤوي جزء بلغة إدراج في إكسون 5 من الجينات فاه ، مما تسبب في حدوث طفرات فراميشيفت في التسلسل التالي23. للحفاظ على الفئران-/- فاه، نحن يعامل الفئران فاه-/- مع المانع من المنبع لمسار تيروزين تقويضي، 2-(2-nitro-4-trifluoromethylbenzoyl)-1,3-cyclohexanedione (نتبك)24. هنا حددنا لترى ما إذا كان تصحيح الجينات مميج وهميج-بوساطة يمكن إنقاذ فاه الطفرة في الماوس-/- فاه. ونحن هيدروديناميكالي حقن بناء Cas9 جنبا إلى جنب مع فاه-ميج أو فاهبنيات-هميج، ترمي إلى إدراج كدنا فاه من إكسون 5 إلى 14 في إنترون 4 جينات فاه ، فاه -/- الماوس (كبد الشكل 3 ج)-أسبوع واحد بعد الحقن، سحبت نتبك للحث على تلف الكبد (الشكل 3ج). وبعد انسحاب نتبك، فاه-خلايا الكبد المصوبة للفئران فاه-/- تلقي فاه-هميج و Cas9 بنيات أظهرت انتشار أكثر فعالية من الأسلوب القائم على ميج (الشكل 3د ).

الشكل 1 : بوساطة هميج تستهدف الاندماج في المختبر.
المخطط التجريبي (A) لاختيار سجرناس: ست سجرناس مختلفة (Cdx2-sgRNA1 ~Cdx2-sgRNA6) حول كودون التوقف لمحور Cdx2 مع إمكانيات أعلى رتبة وخارج الهدف المختار استندت على الإنترنت كريسبر التصميم أداة. التسلسل عزر المتاخمة (بام) بروتوسباسير باللون الأحمر. (ب) التصميم التجريبي: Cas9-CMV-بروتينات فلورية خضراء التعبير والبلازميدات الإعراب عن سجرنا، Cas9، والتجارة والنقل وأدخلت في الخلايا N2a. تم فرز الخلايا بروتينات فلورية خضراء+ في اليوم الثالث للمقايسة المساح. (ج) مساح الاعتداء لاستهداف Cdx2 : 6 سجرناس مختلفة صممت للمقايسة المساح. N2a عادي خلية الحمض النووي بمثابة عنصر التحكم. *، سجرنا المستخدمة ل Cdx2-2A-مشري تدق في التجربة. (د) نظرة عامة التخطيطي لبناء مانحين هميج استخدام جيبسون الجمعية. (ه) نظرة عامة التخطيطي للجينات هميج بوساطة تستهدف الاستراتيجية في محور Cdx2 . الذراع التماثل هال/هار، يسار/يمين. مثلثات، سجرنا المواقع المستهدفة؛ من/أو الخارجي إلى الأمام/عكس التمهيدي؛ إذا كان/الأشعة تحت الحمراء، الداخلية إلى الأمام/عكس التمهيدي. الرقم معدلة من التقرير السابق10. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 2 : تحرير الجينوم في الأجنة الماوس عبر وساطة هميج تستهدف إدماج
(A) المخطط التجريبي من microinjection: خليط مرناً Cas9 (100 نانوغرام/ميليلتر)، البلازميدات سجرنا (50 نانوغرام/ميليلتر)، والجهات المانحة (100 نانوغرام/ميليلتر) تم حقن زيجوتيس الماوس. (ب) الأسفار الممثل صور أجنة الفأر حرره هميج الاستراتيجية. بار، أوضحت 20 ميكرومتر. (ج) خبط في الكفاءة بالنسبة المئوية من مشري+ بلاستوسيستس. عدد فوق كل شريط، مجموع blastocysts عدها. (د) تسلسل تحليل الجينات في تحريره الفئران في محور Cdx2 . كانت متسلسلة منتجات PCR يضخم من مواقع تقاطع 5 'و 3'. العلوي، التماثل الذراع. p2A الأرجواني،؛ مشري أحمر،؛ هار أو هال، الذراع اليمنى أو اليسرى مثلى. الخطوط المتقطعة علامة المنطقة تم حذفها للوضوح. الرقم معدلة من التقرير السابق10. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 3 : بوساطة هميج تستهدف الاندماج في فيفو.
(أ) نظرة عامة التخطيطي لحقن الوريد هيدرودينامية الذيل. تم تسليم خليط والبلازميدات معربا عن تسلسل المانحين وسجرنا، ووالبلازميدات معربا عن spCas9 الكبد عن طريق حقن الوريد ذيل هيدرودينامية. (ب) الصور الفلورة الممثل لخلايا الكبد. أقسام الكبد تم جمعها 7 أيام بعد الحقن. مقياس بار، 50 ميكرومتر. بروتينات فلورية خضراء، transfected الخلايا. وقدم البلازميدات (ج) أما ميج أو هميج وساطة الجينات استبدال استراتيجية ترمي إلى إدراج كدنا فاه من إكسون 5 إلى 14 إنترون 4 جينات فاه في كبد الفأر فاه-/- حقن هيدرودينامية. نتبك على: الفئران فاه-/- أبقى على المياه نتبك؛ نتبك قبالة: سحب المياه نتبك (اليوم الأول من انسحاب نتبك كان يعرف اليوم 0، وهو اليوم السابع بعد الحقن). (د) فاه immunohistochemistry تلطيخ أقسام الكبد من فاه--/-- الفئران حقن البلازميدات ميج أو هميج. تعديل مقياس بار، 100 ميكرومتر. الشكل من التقارير السابقة5،10. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Subscription Required. Please recommend JoVE to your librarian.
Discussion
الخطوات الأكثر أهمية في بناء هميج المانحة والبلازميدات: (1) اختيار سجرنا مع الحمض النووي الانقسام وكفاءة عالية ومنخفضة المسافة بين موقع قطع سجرنا وكودون وقف البناء (2) السليم من المانحين هميج. كريسبر/Cas9-بوساطة الانقسام على كل ناقل المانحة التحوير (تحتوي على ~ 800 bp التماثل الأسلحة والمواقع المستهدفة سجرنا) والجينوم المستهدفة ضروري للتكامل المستهدفة كفاءة ودقة المجراة في. الخطوات الأكثر أهمية لجيل من تدق في الفئران باستخدام الأسلوب القائم على هميج: (1) إعداد جودة عالية Cas9 مرناً وسجرنا (لا انحطاط موجود في مرناً Cas9 وسجرنا)، و (2) إعداد بلازميد المانحة هميج عالية الجودة. ويظهر بلازميد أي آثار سامة على التطور الجنيني.
في الآونة الأخيرة، أبلغ أيضا أسلوب المستندة إلى نهيج للكفاءة في فيفو الجينوم التحرير8. ومع ذلك، أنواع مختلفة من الطفرات إينديل كانت عادة المستحث في الوصلات، كما هو موضح في السابق تقارير8، مما يجعل من الصعب تحقيق التكامل الدقيق. هنا، أظهرت الاستراتيجية المستندة إلى هميج التي وصفناها أعلاه دقيقة التكامل المستهدفة مع الطفرات إينديل لا يكاد أي. وهكذا، يمكن أن تكون استراتيجية تستند إلى هميج منصة مثالية لاستبدال تسلسل تحور (مثل طفرة نقطة) مع النوع الصحيح، الذي لا ينطبق على الأسلوب القائم على نج.
Mosaicism مشكلة رئيسية لتحرير الجينات في الأجنة. قد يحقق حقن البروتين Cas9 بدلاً من مرناً في مرحلة جنينية في وقت سابق التحوير تدق في مرحلة واحدة من مراحل الخلية دون mosaicism. للتطبيقات السريرية، وتسليم النظم كريسبر/Cas9 في أنسجة البالغين لا تزال صعبة.
وهناك العديد من الاستخدامات المحتملة مستقبلا من التحرير على أساس هميج الجينوم. ويمكن استخدامه لتوليد نماذج حيوانية معدلة وراثيا. نظراً لارتفاع تدق في كفاءتها في الأجنة، هذا الأسلوب يمكن خفض كبير في عدد الحيوانات اللازمة لتوليد نماذج حيوانية معدلة وراثيا، ولا سيما يفتح إمكانية توليد نماذج الرئيسيات غير البشرية الوراثية. يمكن تحرير الجينوم المستندة إلى هميج النسب تتبع أنواع الخلايا الفردية في أنسجة البالغين، وهي مفيدة بشكل خاص للنماذج الحيوانية، نظراً لوجود نقص في النماذج الحيوانية المتاحة، مثل المقدمات غير البشرية. يمكن استخدامه للعلاج الجيني المستهدف: تطبيق استراتيجية تستند إلى هميج الأكثر جاذبية هو العلاج الجيني لعيادة الاستخدامات. في هذه الدراسة، ونحن تصحيح الطفرة فاه tyrosinemia الوراثية النوع أنا الفئران بحقن هيدرودينامية موجهات المشار إليه. ومع ذلك، تسليم نظام كريسبر/Cas9 في أنسجة البالغين لا يزال التحدي التقني الرئيسي للاستخدام السريري، حقن هيدرودينامية من غير المحتمل أن يكون أداؤها في المرضى. حاليا، تحسين استراتيجية التنفيذ على نحو عاجل المزيد من قبل ترجمة هذا الأسلوب هميج المستندة إلى العيادة.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgments
هذا العمل كان يدعمها CAS أولوية البحث البرنامج الاستراتيجي (XDB02050007، XDA01010409)، وفي البحث والتطوير Hightech الوطنية د البرنامج (البرنامج 863؛ 2015AA020307)، مؤسسة العلوم الطبيعية الوطنية الصينية (المنح تشرف 31522037، 31500825، 31571509، 31522038)، الصين الشباب برنامج المواهب ألف (أن إتش وأي)، وكسر من خلال المشروع من الأكاديمية الصينية للعلوم، مشروع "لجنة مدينة شانغهاي" للعلوم والتكنولوجيا (16JC1420202 إلى إتش وأي)، وزارة العلوم والتكنولوجيا في الصين (معظم؛ 2016YFA0100500).
Materials
| Name | Company | Catalog Number | Comments |
| pX330 | Addgene | 42230 | |
| pAAV vector | Addgene | 37083 | |
| pX260 | Addgene | 42229 | |
| AAV_Efs_hSpCas9_NLS_FLAG-SV40 | Addgene | 97307 | AAV vector for encoding a human codon-optimized SpCas9 driven by EFs promoter |
| AAV_Actb HMEJ donor_U6_sgRNA_EF1a_GFP_polyA | Addgene | 97308 | HMEJ donor for fusing a p2A-mCherry reporter to mouse Actb. EGFP driven by EF1a promoter and U6-driven sgRNAs targeting Actb. AAV backbone. |
| AAV_Cdx2 HMEJ donor | Addgene | 97319 | HMEJ donor for fusing a p2A-mCherry reporter to mouse Cdx2. |
| Lipofectamine 3000 Transfection Reagent | Life Technology | L3000015 | |
| Nuclease-Free Water | Life Technologies | AM9930 | |
| Bbs I | New England Biolabs | R0539S | |
| NEB Buffer 2 | New England Biolabs | B7002S | |
| T7 endonuclease I | New England Biolabs | M0302L | |
| NEBuilder HiFi DNA Assembly Master Mix | New England Biolabs | E2621L | |
| Plasmid EndoFree-Midi Kit | Qiagen | 12143 | |
| MMESSAGE MMACHINE T7 ULTRA | Life Technologies | AM1345 | |
| MEGACLEAR KIT 20 RXNS | Life Technologies | AM1908 | |
| MEGASHORTSCRIPT T7 KIT 25 RXNS | Life Technologies | AM1354 | |
| Flaming/Brown Micropipette Puller | Sutter Instrument | P-97 | Micropipette Puller (parameters: heat, 74; pull, 60; velocity, 80; time/delay, 200; pressure, 300) |
| Borosilicate glass | Sutter Instrument | B100-78-10 | type of capillaries (outer diameter 1.0 mm, inner diameter 0.78 mm with filament) |
| FemtoJet microinjector | Eppendorf | ||
| Freezing microtome | Leica | CM1950-Cryostat | thickness of 40 μm for brain, 10 μm for liver |
| Rabbit anti-mCherry | GeneTex | ||
| Cy3-AffiniPure Goat Anti-Rabbit IgG | Jackson Immunoresearch | ||
| DMEM | Gibco | 11965092 | |
| FBS | Gibco | 10099141 | |
| NEAA | Gibco | 11140050 | |
| Pen,Strep,Glutamine | Gibco | 10378016 | |
| Gel Extraction Kit | Omega | D2500-02 | |
| FACS | BD AriaII | ||
| PMSG | Ningbo Sansheng Medicine | S141004 | |
| HCG | Ningbo Sansheng Medicine | B141002 | |
| Cytochalasin B | Sigma | CAT#C6762 | |
| KSOM+AA with D-Glucose and Phenol Red | Millipore | CAT#MR-106-D | |
| M2 Medium with Phenol Red | Millipore | CAT#MR-015-D | |
| Mineral oil | Sigma |
References
- Yang, H., et al. Generation of Mice Carrying Reporter and Conditional Alleles by CRISPR/Cas-Mediated Genome Engineering. Cell. 154 (6), 1370-1379 (2013).
- Hockemeyer, D., et al. Genetic engineering of human pluripotent cells using TALE nucleases. Nature Biotechnology. 29 (8), 731-734 (2011).
- Nakade, S., et al. Microhomology-mediated end-joining-dependent integration of donor DNA in cells and animals using TALENs and CRISPR/Cas9. Nature Communications. 5, 5560 (2014).
- Hisano, Y., et al. Precise in-frame integration of exogenous DNA mediated by CRISPR/Cas9 system in zebrafish. Scientific reports. 5, 8841 (2015).
- Yao, X., et al. Cas9 - Mediated Precise Targeted Integration In Vivo Using a Double Cut Donor with Short Homology Arms. EBioMedicine. , (2017).
- Auer, T. O., Duroure, K., De Cian, A., Concordet, J. P., Del Bene, F. Highly efficient CRISPR/Cas9-mediated knock-in in zebrafish by homology-independent DNA repair. Genome research. 24 (1), 142-153 (2014).
- Maresca, M., Lin, V. G., Guo, N., Yang, Y. Obligate ligation-gated recombination (ObLiGaRe): custom-designed nuclease-mediated targeted integration through nonhomologous end joining. Genome Research. 23 (3), 539-546 (2013).
- Suzuki, K., et al. In vivo genome editing via CRISPR/Cas9 mediated homology-independent targeted integration. Nature. 540 (7631), 144-149 (2016).
- Cong, L., et al. Multiplex genome engineering using CRISPR/Cas systems. Science. 339 (6121), 819-823 (2013).
- Yao, X., et al. Homology-mediated end joining-based targeted integration using CRISPR/Cas9. Cell Research. 27 (6), 801-814 (2017).
- Han, D. W., et al. Direct reprogramming of fibroblasts into epiblast stem cells. Nature Cell Biology. 13 (1), 66-71 (2011).
- Han, D. W., et al. Direct Reprogramming of Fibroblasts into Neural Stem Cells by Defined Factors. Cell Stem Cell. , (2012).
- Ambasudhan, R., et al. Direct reprogramming of adult human fibroblasts to functional neurons under defined conditions. Cell Stem Cell. 9 (2), 113-118 (2011).
- Sparman, M., et al. Epigenetic reprogramming by somatic cell nuclear transfer in primates. Stem Cells. 27 (6), 1255-1264 (2009).
- Schatten, G., Mitalipov, S. Developmental biology: Transgenic primate offspring. Nature. 459 (7246), 515-516 (2009).
- Hsu, P. D., et al. DNA targeting specificity of RNA-guided Cas9 nucleases. Nature Biotechnology. 31 (9), 827-832 (2013).
- Cong, L., et al. Multiplex Genome Engineering Using CRISPR/Cas Systems. Science. 339 (6121), 819-823 (2013).
- Quadros, R. M., et al. Easi-CRISPR: a robust method for one-step generation of mice carrying conditional and insertion alleles using long ssDNA donors and CRISPR ribonucleoproteins. Genome Biology. 18 (1), 92 (2017).
- Park, K. E., et al. Targeted Gene Knockin in Porcine Somatic Cells Using CRISPR/Cas Ribonucleoproteins. International journal of molecular sciences. 217 (6), (2016).
- Woo, J. W., et al. DNA-free genome editing in plants with preassembled CRISPR-Cas9 ribonucleoproteins. Nature biotechnology. 33 (11), 1162-1164 (2015).
- Harms, D. W., et al. Mouse Genome Editing Using the CRISPR/Cas System. Current protocols in human genetics. 83, 11-27 (2014).
- Yang, H., Wang, H., Jaenisch, R. Generating genetically modified mice using CRISPR/Cas-mediated genome engineering. Nature protocols. 9 (8), 1956-1968 (2014).
- Grompe, M., et al. Loss of Fumarylacetoacetate Hydrolase Is Responsible for the Neonatal Hepatic-Dysfunction Phenotype of Lethal Albino Mice. Genes & development. 7 (12), 2298-2307 (1993).
- Paulk, N. K., et al. Adeno-associated virus gene repair corrects a mouse model of hereditary tyrosinemia in vivo. Hepatology. 51 (4), 1200-1208 (2010).
Tags
علم الوراثة، العدد 133، كريسبر/Cas9، التكامل المستهدفة، ونهاية التماثل بوساطة الالتحاق بالعمل، في فيفو، الجنين، محوره وراثيا الفئران، حقن هيدروديناميةErratum
Formal Correction: Erratum: CRISPR/Cas9-mediated Targeted Integration In Vivo Using a Homology-mediated End Joining-based Strategy
Posted by JoVE Editors on 03/10/2021.
Citeable Link.
An erratum was issued for: Studying TGF-β Signaling and TGF-β-induced Epithelial-to-mesenchymal Transition in Breast Cancer and Normal Cells. The phrases "surveyor assay" and "Surveyor Nuclease" have been updated to "T7E1 assay" to " T7 endonuclease I" respectively.
Step 1.2 in the Protocol has been updated from:
- Surveyor nuclease assay of sgRNA
NOTE: The targeting efficiency of the sgRNA used for the knock-in experiment is evaluated by surveyor nuclease assay (also known as T7 endonuclease I (T7EI) assay)17. Select the sgRNA with high DNA cleavage efficiency and a low distance between the sgRNA cutting site and the stop codon.
to:
- T7 endonuclease assay of sgRNA
NOTE: The targeting efficiency of the sgRNA used for the knock-in experiment is evaluated by T7 endonuclease (T7EI) assay17. Select the sgRNA with high DNA cleavage efficiency and a low distance between the sgRNA cutting site and the stop codon.
Figure 1 in the Representative Results has been updated from:
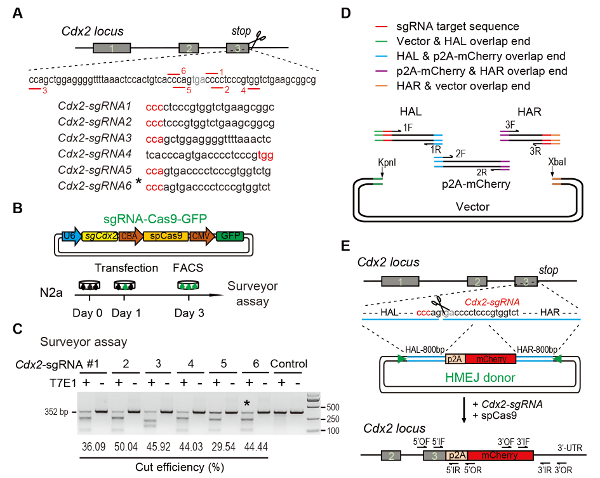
Figure 1: HMEJ-mediated targeted integration in vitro.
(A) Experimental scheme for selection of sgRNAs: Six different sgRNAs (Cdx2-sgRNA1~Cdx2-sgRNA6) around the stop codon of the Cdx2 locus with a higher rank and off-target potential were chosen based on online CRISPR design tool. The protospacer adjacent motif (PAM) sequence is in red. (B) Experimental design: The Cas9-CMV-GFP expression plasmids expressing sgRNA, Cas9, and GFP were introduced into N2a cells. GFP+ cells were sorted at day 3 for surveyor assay. (C) Surveyor assay for Cdx2 targeting: 6 different sgRNAs were designed for surveyor assay. Normal N2a cell genomic DNA serves as control. *, the sgRNA used for Cdx2-2A-mCherry knock-in experiment. (D) Schematic overview of construction of HMEJ donors using Gibson assembly. (E) Schematic overview of HMEJ-mediated gene targeting strategy at Cdx2 locus. HAL/HAR, left/right homology arm; triangles, sgRNA target sites; OF/OR, outer forward/reverse primer; IF/IR, inner forward/reverse primer. Figure modified from previous report10. Please click here to view a larger version of this figure.
to:
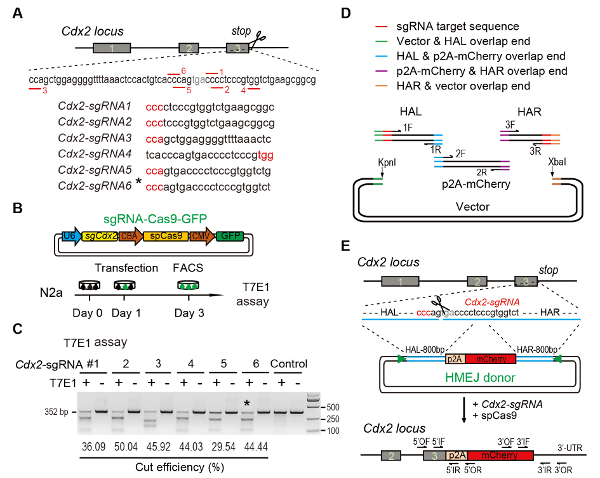
Figure 1: HMEJ-mediated targeted integration in vitro.
(A) Experimental scheme for selection of sgRNAs: Six different sgRNAs (Cdx2-sgRNA1~Cdx2-sgRNA6) around the stop codon of the Cdx2 locus with a higher rank and off-target potential were chosen based on online CRISPR design tool. The protospacer adjacent motif (PAM) sequence is in red. (B) Experimental design: The Cas9-CMV-GFP expression plasmids expressing sgRNA, Cas9, and GFP were introduced into N2a cells. GFP+ cells were sorted at day 3 for T7EI assay. (C) T7EI assay for Cdx2 targeting: 6 different sgRNAs were designed for T7EI assay. Normal N2a cell genomic DNA serves as control. *, the sgRNA used for Cdx2-2A-mCherry knock-in experiment. (D) Schematic overview of construction of HMEJ donors using Gibson assembly. (E) Schematic overview of HMEJ-mediated gene targeting strategy at Cdx2 locus. HAL/HAR, left/right homology arm; triangles, sgRNA target sites; OF/OR, outer forward/reverse primer; IF/IR, inner forward/reverse primer. Figure modified from previous report10. Please click here to view a larger version of this figure.



