Summary
In questo protocollo, la tecnologia di lavorazione dell'olio di montone di Epimedii folium (EF) è stata ottimizzata applicando una metodologia sperimentale di superficie di progettazione-risposta Box-Behnken ed è stato studiato preliminarmente l'effetto dell'EF grezzo e ottimizzato estratto dall'acqua sullo sviluppo embrionale del pesce zebra.
Abstract
Come medicina tradizionale cinese (MTC), Epimedii folium (EF) ha una storia in medicina e cibo che ha > 2.000 anni. Clinicamente, l'EF elaborato con olio di montone è spesso usato come medicinale. Negli ultimi anni, le segnalazioni di rischi per la sicurezza e reazioni avverse di prodotti che utilizzano EF come materia prima sono gradualmente aumentate. L'elaborazione può migliorare efficacemente la sicurezza della MTC. Secondo la teoria TCM, la lavorazione dell'olio di montone può ridurre la tossicità dell'EF e migliorare il suo effetto tonificante sui reni. Tuttavia, mancano ricerche e valutazioni sistematiche della tecnologia di trattamento dell'olio di montone EF. In questo studio, abbiamo utilizzato la metodologia sperimentale della superficie di progettazione-risposta Box-Behnken per ottimizzare i parametri chiave della tecnologia di lavorazione valutando il contenuto di più componenti. I risultati hanno mostrato che la tecnologia ottimale di lavorazione dell'olio di montone di EF era la seguente: riscaldare l'olio di montone a 120 °C ± 10 °C, aggiungere l'EF grezzo, saltarlo delicatamente a 189 °C ± 10 °C fino a quando non è uniformemente lucido, quindi rimuoverlo e raffreddarlo. Per ogni 100 kg di EF, devono essere utilizzati 15 kg di olio di montone. Le tossicità e le teratogenicità di un estratto acquoso di EF grezzo e olio di montone sono state confrontate in un modello di sviluppo dell'embrione di zebrafish. I risultati hanno mostrato che il gruppo di erbe grezze aveva maggiori probabilità di causare deformità del pesce zebra e la sua concentrazione EF letale semi-massima era inferiore. In conclusione, la tecnologia ottimizzata di lavorazione dell'olio di montone era stabile e affidabile, con una buona ripetibilità. Ad una certa dose, l'estratto acquoso di EF era tossico per lo sviluppo di embrioni di zebrafish e la tossicità era più forte per il farmaco grezzo che per il farmaco trasformato. I risultati hanno mostrato che la lavorazione dell'olio di montone ha ridotto la tossicità dell'EF grezzo. Questi risultati possono essere utilizzati per migliorare la qualità, l'uniformità e la sicurezza clinica dell'EF trattato con olio di montone.
Introduction
Epimedii folium (EF) è le foglie essiccate di Epimedium brevicornu Maxim., Epimedium sagittatum (Sieb. et Zucc.) Maxim., Epimedium pubescens Maxim., o Epimedium koreanum Nakai. EF può essere usato per trattare l'osteoporosi, la sindrome della menopausa, noduli al seno, ipertensione, malattia coronarica e altre malattie1. Come medicina tradizionale cinese (MTC), EF ha una storia in medicina e cibo di oltre 2.000 anni. Grazie al suo basso prezzo e al notevole effetto di tonificare i reni, è ampiamente usato in medicinali e alimenti salutari. L'EF viene lavorato saltando in padella con olio di montone, un processo descritto per la prima volta nella teoria dell'elaborazione del Lei Gong scritta da Lei Xiao nel periodo Liu Song2. L'efficacia dell'EF grezzo e dell'EF saltato in padella è molto diversa. L'EF grezzo dissipa principalmente i reumatismi, mentre l'EF saltato in padella riscalda i reni per rinforzare lo yang3. Allo stato attuale, l'EF è ampiamente utilizzato come materia prima nei farmaci e negli alimenti salutari; ci sono 399 farmaci brevettati cinesi elencati, nove alimenti salutari importati e 455 alimenti salutari domestici con EF come materia prima4. Questo medicinale ha grandi prospettive di applicazione. Tuttavia, negli ultimi anni, ci sono state crescenti segnalazioni di reazioni avverse e lesioni epatiche umane causate da alimenti salutari e medicinali brevettati cinesi che utilizzano EF come materia prima, e i relativi studi di tossicità 5,6,7 hanno riferito che l'EF come materia prima ha potenziali rischi per la sicurezza.
L'elaborazione medicinale cinese si riferisce a tecniche farmaceutiche che possono ridurre o eliminare efficacemente la tossicità e migliorare la sicurezza delle MTC. Il metodo di lavorazione tradizionale di EF è la frittura in padella con olio di montone, che riduce la tossicità dell'EF e migliora il suo effetto di riscaldamento dei reni e promozione dello yang8. Questo metodo di lavorazione è incluso nella farmacopea cinese e varie specifiche di lavorazione1. Il processo di EF è specificato solo come segue: per ogni 100 kg di EF, vengono aggiunti 20 kg di olio amniotico (raffinato) e viene cotto in modo delicato fino a quando uniforme e lucido1. Non ci sono parametri rigorosi del metodo di elaborazione EF negli standard di cui sopra, quindi le specifiche di elaborazione locali non sono state unificate per garantire la coerenza. Pertanto, sarebbe utile condurre uno studio sistematico del processo di impronta ambientale. In questo articolo, il metodo sperimentale Box-Behnken della superficie di progettazione-risposta è stato utilizzato per ottimizzare la tecnologia di elaborazione di EF.
Il progetto sperimentale Box-Behnken è un metodo tipicamente utilizzato per ottimizzare i fattori in un processo. I parametri di estrazione possono essere ottimizzati stabilendo la relazione funzionale tra più fattori di adattamento delle equazioni di regressione e valori di effetto. Recentemente, questo metodo è stato ampiamente utilizzato per studiare l'estrazione TCM 5,6,7 e l'elaborazione 9,10,11. Vari studi hanno riportato metodi di preparazione TCM che coinvolgono la lavorazione del sale, la lavorazione del vino e la frittura in padella seguendo un design Box-Behnken, come per Psoraleae fructus 12 trattato con sale, Cnidii fructus13 lavorato con vino e Cinnamomi ramulus14 arrostito. Questo metodo ha ridotto i tempi di test, un'elevata precisione del test ed è adatto per test multifattoriali e multilivello. Il metodo è più semplice del metodo di prova di progettazione ortogonale e più completo del metodo di progettazione uniforme15. Le relazioni ottenute possono determinare il valore previsto di qualsiasi punto di test all'interno dell'intervallo di test, il che rappresenta un grande vantaggio. Un modello di zebrafish può essere utilizzato per verificare se l'EF è meno tossico dopo la lavorazione.
Negli studi di tossicità TCM, il modello zebrafish presenta il duplice vantaggio dell'elevata produttività degli esperimenti sulle cellule e delle somiglianze con gli esperimenti sui roditori16. Questo modello è caratterizzato da piccole dimensioni, alto tasso di deposizione delle uova, breve ciclo di riproduzione e facilità di allevamento. Il modello può essere utilizzato in esperimenti sincroni su larga scala in piastre di coltura cellulare e il dosaggio del farmaco sperimentale è piccolo, il ciclo sperimentale è breve, il costo è basso e l'intero processo sperimentale è facile da osservare e utilizzare17. Gli embrioni di zebrafish sono trasparenti e si sviluppano rapidamente. Pertanto, la tossicità e gli effetti teratogeni dei farmaci sui tessuti viscerali in diversi stadi di sviluppo possono essere osservati direttamente al microscopio18. L'omologia genica tra zebrafish e umani raggiunge l'85%18. La via di trasduzione del segnale del pesce zebra è simile a quella degli esseri umani18. La struttura biologica e la funzione fisiologica del pesce zebra sono molto simili a quelle dei mammiferi18. Pertanto, un modello di zebrafish per test antidroga può fornire animali da esperimento affidabili e pienamente applicabili agli esseri umani19.
In questo studio, abbiamo utilizzato la metodologia della superficie di progettazione-risposta Box-Behnken per ottimizzare la quantità e la temperatura dell'olio di montone e la temperatura di frittura utilizzata nella tecnologia di lavorazione EF, con i contenuti di icariina, epimedina A, epimedina B, epimedina C e baohuoside I come indici di valutazione. Il modello di zebrafish è stato utilizzato per esplorare preliminarmente l'effetto di un estratto di acqua EF sullo sviluppo embrionale del pesce zebra prima e dopo la lavorazione per valutare l'effetto di attenuazione della lavorazione sull'EF.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Tutti gli esperimenti relativi agli animali sono stati condotti con l'approvazione del Comitato etico degli esperimenti dell'Istituto di MTC di Chongqing (numero di certificato di revisione etica degli animali da laboratorio: ZJS2022-03).
1. Determinazione dei componenti bioattivi
NOTA: La specie utilizzata in questa ricerca era Epimedium sagittatum, e i campioni sono stati raccolti nella contea di Fengdu, Chongqing. Il campione è stato identificato come una parte secca fuori terra di E. sagittatum (Sieb. et Zucc.) Massima. dai ricercatori dell'Istituto di Medicina Biologica, Istituto di Medicina Tradizionale Cinese di Chongqing.
- Preparare la soluzione del prodotto di controllo pesando accuratamente la quantità appropriata di ciascuna sostanza di riferimento, vale a dire icariina, epimedina A (EA), epimedina B (EB), epimedina C (EC) e baohuoside I (BI), utilizzando una bilancia analitica elettronica, e sciogliere in metanolo. Utilizzandoli, preparare una soluzione madre di riferimento mista contenente 381,61 μg/mL icariina, 124,14 μg/mL EA, 110,24 μg/mL EB, 1091,75 μg/mL EC e 184,98 μg/mL BI.
- Preparare la soluzione del prodotto di prova schiacciando EF attraverso un setaccio n. 3. Introdurre circa 0,2 g (utilizzando una bilancia analitica elettronica) di EF frantumato in un matraccio Erlenmeyer tappato, aggiungere 20 ml di etanolo diluito e quindi ultrasonicare a 400 W di potenza e frequenza di 50 kHz per 1 ora. Agitare bene e passare attraverso un filtro a membrana da 0,22 μm per ottenere la soluzione di prova.
- Eseguire la cromatografia come segue. Utilizzare cromatografia liquida ad alte prestazioni (HPLC) con una colonna C18 con dimensioni di 4,6 mm x 250 mm e un diametro interno di 5 μm. Utilizzare acetonitrile come fase mobile A e acqua ultrapura come fase mobile B. Utilizzare i seguenti parametri di eluizione del gradiente: 0-30 min, da 24% A a 26% A; 30-31 min, dal 26% A al 45% A; 31-45 min, da 45% A a 47% A. Utilizzare una lunghezza d'onda di rilevamento di 220 nm (per il rivelatore utilizzato, vedere Tabella dei materiali). Mantenere la temperatura della colonna a 30 °C e la velocità di corrente a 1,0 mL/min e utilizzare una dimensione del campione di 10 μL.
- Per studiare la relazione lineare, utilizzare la soluzione di riferimento mista come nel punto 1.1 diluito 2 volte, 4 volte, 8 volte, 16 volte e 32 volte, rispettivamente per icariin, EA, EB, EC e BI. Utilizzare acetonitrile come fase mobile A e acqua ultrapura come fase mobile B.
- Utilizzare i seguenti parametri di eluizione del gradiente: 0-30 min, da 24% A a 26% A; 30-31 min, dal 26% A al 45% A; 31-45 min, da 45% A a 47% A. Utilizzare una lunghezza d'onda di rilevamento di 220 nm (per il rivelatore utilizzato, vedere Tabella dei materiali). Mantenere la temperatura della colonna a 30 °C e la velocità di corrente a 1,0 mL/min e utilizzare una dimensione del campione di 10 μL. Infine, registra le aree di picco. Tracciare la regressione lineare con la concentrazione di riferimento (asse x, μg/mL) come ascissa e l'area del picco (asse y) come ordinata utilizzando un software professionale (vedi Tabella dei materiali).
- Eseguire la prova di precisione misurando la soluzione di controllo mista sei volte consecutive mediante HPLC utilizzando le condizioni cromatografiche indicate al punto 1.3. Registrare il tempo di rilevamento e le aree di picco di ciascuna composizione chimica e calcolare le deviazioni standard relative (RSD) delle aree di picco per valutare la precisione (riproducibilità) utilizzando la formula seguente:
RSD% = deviazione standard (SD)/media aritmetica dei risultati calcolati (X) x 100 % - Per eseguire il test di riproducibilità, pesare accuratamente la polvere EF e preparare sei parti della soluzione del prodotto di prova in parallelo secondo il metodo al punto 1.2. Sottoporre le soluzioni preparate all'HPLC nelle condizioni cromatografiche presentate al punto 1.3. Registrare i tempi di ritenzione e le aree di picco di ciascuna composizione chimica e calcolare le quantità di ciascun composto da una curva standard (aree di picco rispetto alle concentrazioni). Calcola l'RSD% come sopra.
- Per eseguire la prova di stabilità, conservare le soluzioni di prova a temperatura ambiente e misurarne il contenuto con il metodo HPLC descritto al punto 1.3 a 0 h, 2 h, 4 h, 8 h, 12 h e 24 h dopo la preparazione per valutare la stabilità. Registrare i tempi di ritenzione e le aree di picco di ciascuna composizione chimica e calcolare l'RSD% delle aree di picco come sopra.
- Per eseguire la prova di recupero del campione, pesare 0,2 g di polvere EF in un matraccio Erlenmeyer tappato per sei repliche. Aggiungere una quantità appropriata della soluzione di riferimento (la quantità di sostanza di riferimento aggiunta al campione è equivalente al 100% del contenuto noto del campione) e preparare la soluzione campione secondo il metodo presentato al punto 1.2.
- Iniettare i campioni nel cromatografo e analizzarli in base alle condizioni cromatografiche al punto 1.3. Registrare le aree di picco e calcolare i valori medi di recupero e RSD% come di seguito:
Velocità di recupero del campione con spike = (contenuto del campione con picchi − contenuto del campione)/quantità del campione x 100%
2. Ottimizzazione della tecnologia di lavorazione dell'olio di montone EF utilizzando la metodologia della superficie di progettazione-risposta Box-Behnken
- Selezionare i parametri chiave nella lavorazione EF, come la quantità di olio di montone (A; 15% -35%), la temperatura dell'olio di montone (B; 50-120 °C) e la temperatura di frittura (C; 80-300 °C), come fattori influenti. Utilizza i punteggi completi dei contenuti icariin, EA, EB, EC e BI come indici di valutazione. La percentuale di olio di montone qui è la percentuale di massa.
- Utilizzare il software di analisi della superficie di risposta (vedere Tabella dei materiali) per progettare gli esperimenti sulla superficie di risposta di Box-Behnken, esplorare la superficie di risposta quadratica e costruire un modello polinomiale del secondo ordine. Selezionare il nuovo design Box-Behnken e impostare l'opzione Fattori numerici su 3; impostare i fattori A, B e C. Fare clic su Continua. Imposta l'opzione Risposte su 1 (che era il punteggio completo). Fare clic su Continua per completare il progetto. Sono stati pianificati in totale 17 esperimenti (cfr . tabella 1).
NOTA: per le variabili indipendenti e dipendenti, insieme ai relativi livelli basso, medio e alto, vedere la Tabella 2. - Elaborare l'impronta ambientale secondo i parametri specifici della Tabella 1; ad esempio, per il numero d'ordine 1, pesare l'olio di montone raffinato al 15% V / V e quindi riscaldare a 50 ° C per fonderlo. Aggiungere l'EF grezzo al montone fuso, saltare in padella a fuoco delicato (190 °C) fino a quando non è uniformemente lucido, quindi rimuovere e raffreddare. Eseguito 17 interventi sperimentali. In questo lavoro sono stati ottenuti in totale 17 gruppi di prodotti trasformati EF.
NOTA: L'olio di montone è solido a temperatura ambiente (25 °C) e si scioglie in liquido quando riscaldato. L'olio di montone allo stato liquido può essere usato come eccipiente. - Preparare le soluzioni di prova dei prodotti trasformati secondo il metodo descritto al punto 1.2. Quindi, analizzarli utilizzando HPLC in base alle condizioni cromatografiche descritte nel passaggio 1.3. Registrare i tempi di ritenzione e le aree di picco di ciascuna composizione chimica e calcolare il contenuto di icariina, EA, EB, EC e BI in ciascuna soluzione di prova rispetto a una curva standard esterna. Utilizza la formula di calcolo del punteggio completo qui sotto per calcolare i punteggi completi dei 17 gruppi sperimentali:
Punteggio completo = Z/Z max × 0,5 + BI/BImax × 0,5
dove Z è la somma dei contenuti di icariina, EA, EB e CE; Zmax è il valore massimo della somma dei contenuti di icariina, EA, EB e EC nei 17 gruppi sperimentali; BI è il contenuto BI; e BImax è il valore massimo del contenuto di BI nei 17 gruppi sperimentali. - Importare i risultati completi del punteggio per i 17 gruppi di esperimenti nel software di analisi dei dati (vedi Tabella dei materiali) per analizzare i dati sperimentali. Sotto gli elementi di valutazione, selezionare l'opzione di ordine del processo quadratico e l'opzione del tipo di modello polinomiale.
3. Testare l'effetto della lavorazione sullo sviluppo embrionale del pesce zebra
- Preparazione del campione
- Schiacciare l'EF grezzo e lavorato attraverso un setaccio n. 3 (vedi Tabella dei materiali). A 100 g di ciascun campione EF, aggiungere 1.000 ml di acqua ultrapura. Immergere l'EF per 0,5 ore, far bollire l'acqua due volte per 30 minuti ciascuna, quindi filtrare con carta da filtro.
- Unire i filtrati e concentrare il campione riscaldandolo. Aggiungere acqua ultrapura a un volume finale di 100 ml per ottenere le soluzioni EF (PEF, 1 g/mL) e EF grezze (CEF,1 g/mL). Misurare la quantità di farmaco grezzo in ciascuna soluzione madre.
- Introdurre aliquote da 1 mL, 1,5 mL, 2,5 mL, 5 mL e 7,5 mL di soluzioni madre in matraccio volumetrici da 10 ml, quindi aggiungere acqua ultrapura al volume per preparare le soluzioni di prova con concentrazioni di 100 mg/mL, 150 mg/mL, 200 mg/mL, 250 mg/mL, 500 mg/mL e 750 mg/mL per lo studio sull'embriotossicità del pesce zebra.
NOTA: Le concentrazioni delle soluzioni campione sono state preparate facendo riferimento alla letteratura pertinente 20,21 ed eseguendo esperimenti preliminari per ottenere il gradiente di concentrazione di10 volte utilizzato nella tossicologia normale. L'MCE era un campione non trasformato e il PEF era un campione preparato con la migliore tecnologia di trattamento descritta nella sezione 2.
- Allevamento di pesci zebra e trattamento degli embrioni21
- Adattare i pesci zebra selvatici (vedi Tabella dei materiali) a temperatura controllata per 2 giorni, tenerli in un acquario a flusso continuo a pH 7,0-7,4 e nutrirli due volte al giorno.
NOTA: L'inibizione della formazione di melanina nel pesce zebra è stata ottenuta aggiungendo 1-fenil-2-tiourea in una concentrazione dello 0,003% (massa / volume) al terreno di coltura, che ha mantenuto i loro corpi trasparenti per l'osservazione morfologica. - Seleziona il pesce zebra selvatico fertile adulto la sera e separali usando deflettori nelle scatole di accoppiamento. Rimuovere i deflettori la mattina seguente e lasciare che il pesce deponga le uova per 30 minuti. Raccolte le uova fecondate con un contagocce ogni 15 min. In totale, sono stati raccolti 520 embrioni selvatici sani. Conservare gli embrioni di zebrafish in un'incubatrice a 28,5 °C per 24 ore.
- Assegnare in modo casuale gli embrioni sani a 24 ore dopo la fecondazione (hpf) a 13 gruppi e, insieme a un gruppo di controllo, immergere separatamente in 10 ml di ciascuna delle seguenti soluzioni in un piatto di coltura: PEF: 100 μg / mL, 150 μg / mL, 200 μg / mL, 250 μg / mL, 500 μg / mL, 750 μg / mL; CEF: 100 μg/mL, 150 μg/mL, 200 μg/mL, 250 μg/mL, 500 μg/mL, 750 μg/mL. Trattare il gruppo di controllo vuoto con il mezzo come soluzione. Ogni gruppo conteneva 40 embrioni in questo studio.
NOTA: La composizione media è 0,15 M NaCl, 5 mM KCl, 0,25 mM Na 2 HPO 4, 0,45 mM KH 2 PO 4, 1,3 mM CaCl2, 1,0 mM MgSO 4 e 4 mM NaHCO3. - Coltiva il pesce zebra in un'incubatrice a temperatura costante fino a 120 hpf. Contare il numero di larve morte ogni giorno, osservare la morfologia degli organi principali delle larve in ciascun gruppo sperimentale sotto uno stereomicroscopio (barra di scala = 500 μm, vedi Tabella dei materiali) e calcolare la concentrazione di mezza morte (LC50) del pesce zebra a 72 hpf utilizzando un software di analisi dei dati (vedi Tabella dei materiali).
- Adattare i pesci zebra selvatici (vedi Tabella dei materiali) a temperatura controllata per 2 giorni, tenerli in un acquario a flusso continuo a pH 7,0-7,4 e nutrirli due volte al giorno.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Risultati dell'indagine metodologica
È stata osservata una relazione lineare tra la concentrazione di icariina, EA, EB, EC, BI e le aree di picco cromatografiche (vedere Tabella 3). I valori RSD% (n = 6) delle aree di picco cromatografiche di icariina, EA, EB, EC e BI erano rispettivamente 0,28%, 1,22%, 0,65%, 1,67% e 1,06%, indicando che la precisione delle misurazioni HPLC era buona. I valori RSD% (n = 6) dei contenuti di icariina, EA, EB, EC e BI erano rispettivamente 1,59%, 1,46%, 1,86%, 2,29% e 0,98%, indicando che il metodo aveva una buona ripetibilità. I valori RSD% (n = 6) delle aree di picco di icariin, EA, EB, EC e BI nei campioni erano rispettivamente 1,49%, 1,96%, 1,42%, 0,96% e 0,81%, indicando che la soluzione del campione era stabile entro 24 ore. I tassi medi di recupero di icariina, EA, EB, EC e BI sono stati rispettivamente del 99,98%, 100,14%, 100,09%, 100,75% e 100,94% e i valori RSD% sono stati rispettivamente 0,56%, 0,78%, 0,84%, 1,10% e 1,47% (vedere Tabella 4). Questi risultati mostrano che l'accuratezza del metodo ha soddisfatto i requisiti.
I risultati sperimentali di cui sopra hanno mostrato che il metodo analitico ha fornito risultati che avevano un'eccellente precisione, riproducibilità e accuratezza ed erano accettabili per l'analisi della qualità dei prodotti trasformati EF.
Ottimizzazione della tecnologia di lavorazione dell'olio di montone di EF applicando la metodologia della superficie di progettazione-risposta Box-Behnken
Abbiamo eseguito il fitting di regressione polinomiale quadratica dei dati di cui sopra per ottenere il seguente modello: Y = 0,86 − 0,11 x A + 0,025 x B − 0,078 x C − 0,023 x A x B − 0,037 x A x C + 0,037 x B x C − 0,045 x A 2 + 2,5 x 10-3 x B 2 − 0,14 x C 2. L'analisi della varianza ha dato un valore di P < 0,01, indicando che il modello era significativo. Il valore P della mancanza di adattamento era P > 0,05, indicando che la mancanza di adattamento non era significativa. Il valore R2 era 0,9300, indicando che l'adattamento del modello era buono e l'errore era piccolo. È stato possibile utilizzare questo modello per analizzare e prevedere l'effetto del contenuto di composizione chimica dell'EF saltato in padella con olio di montone. Inoltre, A 2 e D2 hanno avuto un effetto sul contenuto dei prodotti trasformati e la differenza è stata statisticamente significativa (P < 0,01). Gli effetti di A e C del termine di un grado e C2 del termine di secondo ordine sul punteggio complessivo sono stati significativi. Il termine di un grado B, il secondo ordine A 2, B2 e tutti gli elementi di interazione non hanno avuto alcun effetto significativo sul punteggio complessivo. L'analisi dei valori P ha mostrato che, tra i parametri sperimentali, la quantità di olio di montone (A) ha avuto il maggiore effetto sul punteggio complessivo, seguita dalla temperatura di frittura (C) e quindi dalla temperatura dell'olio di montone (B). I risultati di cui sopra sono mostrati nella Tabella 5.
Il software è stato utilizzato per impostare la quantità di olio di montone, la temperatura dell'olio di montone e la temperatura di frittura sulle mediane e per utilizzare il punteggio completo come indice per disegnare un diagramma di influenza a fattore singolo di un fattore (Figura 1). L'aumento della temperatura di frittura ha prima aumentato il punteggio complessivo e poi lo ha diminuito (Figura 1). La temperatura dell'olio di montone ha avuto un effetto trascurabile sul punteggio complessivo. La quantità di olio di montone è stato il principale fattore significativo che ha influenzato il cambiamento nel punteggio complessivo e, con l'aumentare della quantità, il contenuto tendeva al ribasso.
Per aiutare a comprendere meglio i risultati, i modelli previsti sono presentati nella Figura 2 come grafici della superficie di risposta 3D. In termini di pendenza della superficie di risposta, maggiore è il significato dell'effetto di interazione tra i fattori, più delicata è la pendenza e meno significativo è l'effetto. Un'ellisse a forma di linea di contorno indica una forte interazione tra i fattori, mentre un cerchio indica il contrario. La superficie di risposta della quantità di olio di montone e la temperatura di frittura erano più ripide rispetto agli altri fattori testati e le linee di contorno tendevano ad essere più ellittiche (vedi Figura 2C,D), indicando che l'interazione tra questi due fattori era più significativa; al contrario, le interazioni tra altri fattori non erano significative (vedi Figura 2A,B,E,F).
La tecnologia ottimale di lavorazione dell'olio di montone di EF è stata selezionata come segue: una quantità di olio di montone del 15%; una temperatura dell'olio di montone di 120 °C; e una temperatura di frittura di 189 °C. Considerando che la temperatura non può essere controllata con molta precisione durante il funzionamento effettivo, il valore della temperatura è specificato come variabile ±10 °C. Pertanto, i parametri finali erano i seguenti: una quantità di olio di montone del 15%; una temperatura dell'olio di montone di 120 °C ± 10 °C; e una temperatura di frittura di 189 °C ± 10 °C. Il processo ottimale era il seguente: riscaldare l'olio di montone a 120 °C ± 10 °C, aggiungere l'EF grezzo, friggerlo a fuoco delicato (189 °C ± 10 °C) fino a quando non è uniformemente lucido, rimuovere e raffreddare. Per ogni 100 kg di EF, devono essere utilizzati 15 kg di olio di montone (olio raffinato). Utilizzando queste condizioni, sono stati condotti tre esperimenti paralleli e i punteggi ottenuti sono stati 0,96, 0,97 e 0,94 (RSD% = 1,60%), indicando condizioni stabili e fattibili. I cromatogrammi HPLC tipici delle sostanze di riferimento grezze, trasformate e miste dell'impronta ambientale sono mostrati nella figura 3.
Test dell'effetto della lavorazione sullo sviluppo embrionale del pesce zebra
Il pesce zebra si è schiuso in giovani a 72 hpf. Lo sviluppo di ogni organo era sostanzialmente completo. I corpi dei pesci sono rimasti trasparenti ed è stato facile posarli su un fianco sul vetrino. Le forme degli organi erano facili da osservare e identificare se viste al microscopio. Il gruppo di controllo in bianco non ha manifestato alcuna morte o tossicità d'organo durante il periodo di somministrazione. Rispetto al gruppo di controllo, a una concentrazione di farmaco di 100 μg / ml, non sono state riscontrate anomalie evidenti nel gruppo EF grezzo (S) e nel gruppo elaborato (P) a 72 hpf. A 96 hpf e successivi, l'incompletezza della vescica natatoria e la perdita della vescica natatoria erano più comuni nei pesci giovani nel gruppo grezzo, ma erano rari nei pesci giovani nel gruppo trasformato. A una concentrazione di farmaco di 150 μg/ml, evidenti deformità spinali, deformità della curvatura corporea, edema pericardico e deformazione epatica sono stati osservati nel pesce giovane nel gruppo grezzo a 72 hpf, ma questi cambiamenti erano rari nel pesce giovane nel gruppo trattato e il grado di teratogenicità era più debole di quello del gruppo grezzo. A una concentrazione di farmaco di 200 μg / ml, tutti i pesci giovani nel gruppo grezzo sono morti e l'evidente teratogenicità è apparsa nel pesce giovane nel gruppo trasformato. A una concentrazione di farmaco di 250 μg / ml, un piccolo numero di zebrafish è sopravvissuto nel gruppo trasformato. I risultati dell'esame microscopico del pesce zebra sono mostrati nella Figura 4.
I tassi di mortalità del pesce zebra nei gruppi di erbe Epimedium grezze e trasformate dipendevano dalla concentrazione e dal tempo di somministrazione. La relazione tempo-dose-mortalità è mostrata nella Figura 5. I risultati della mortalità del pesce zebra hanno mostrato che 24 ore dopo la somministrazione (48 hpf), a una concentrazione di farmaco di 200 μg / ml, tutti i pesci zebra nel gruppo di farmaci grezzi sono morti, mentre la mortalità nel gruppo trattato è stata solo del 6,67%. A 48 ore dopo la somministrazione di EF (72 hpf), la concentrazione che ha causato la morte di tutti i pesci zebra nel gruppo di farmaci grezzi era di 200 μg / ml e la concentrazione che ha causato la morte di tutti i pesci zebra nel gruppo trattato era di 500 μg / ml. È stata calcolata la concentrazione letale mediana dei due gruppi sperimentali a 72 hpf. I risultati hanno mostrato che la LC50 (vedi Figura 6) era di 151,3 μg/ml nel gruppo grezzo (S) e di 219,8 μg/ml nel gruppo trattato (P).

Figura 1: Analisi univariata. La figura mostra il diagramma di influenza a fattore singolo. A è il risultato a fattore singolo della quantità di olio di montone (sugna); B è il risultato a fattore singolo della temperatura dell'olio di montone (sugna); e C è il risultato a fattore singolo della temperatura di frittura. Con l'aumentare della temperatura di frittura, il punteggio complessivo prima aumenta e poi diminuisce. La temperatura dell'olio di montone ha scarso effetto sul punteggio. La quantità di olio di montone è stato il principale fattore significativo che ha influenzato il cambiamento nel punteggio complessivo e il contenuto ha mostrato una tendenza al ribasso con una quantità crescente di olio di montone. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 2: Superficie di risposta e diagramma di contorno dell'influenza delle diverse interazioni fattoriali sul punteggio complessivo. (A) Questa figura mostra un grafico della superficie di risposta 3D dell'interazione tra la quantità di olio di montone e la temperatura. (B) Questa figura mostra un grafico di contorno dell'interazione tra la quantità di olio di montone e la temperatura. (C) Questa figura mostra un grafico della superficie di risposta 3D dell'interazione tra la quantità di olio di montone e la temperatura di lavorazione. (D) Questa figura mostra un grafico di contorno dell'interazione tra dosaggio dell'olio di montone e temperatura di lavorazione. (E) Questa figura mostra un grafico della superficie di risposta 3D dell'interazione tra la quantità di olio di montone e la temperatura di lavorazione. (F) Questa figura mostra un grafico di contorno dell'interazione tra la quantità di olio di montone e la temperatura di lavorazione. Il risultato mostra che la superficie di risposta della quantità di olio di montone e la temperatura di frittura erano ripide, rispetto agli altri parametri testati e le linee di contorno tendevano ad essere ellittiche (vedi C,D), indicando che l'interazione tra questi due fattori era significativa, mentre le interazioni tra altri fattori non erano significative (vedi A,B,E, F). Il termine olio di sugna usato nella figura si riferisce all'olio di montone. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 3: Cromatogrammi HPLC delle sostanze di riferimento grezze, trasformate e miste dell'EF . (A) Questa figura mostra il cromatogramma HPLC della sostanza di riferimento mista. (B) Questa figura mostra il cromatogramma HPLC di Epimedii folium grezzo. C) Questa figura mostra il cromatogramma HPLC dei prodotti trasformati in folium Epimedii. Queste tre immagini dimostrano che il contenuto di BI in EF raw è basso, mentre aumenta dopo l'elaborazione. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 4: Micrografie di zebrafish. Questa figura mostra le micrografie del pesce zebra. (A) Questa figura mostra i risultati dell'osservazione del pesce zebra al microscopio nel gruppo bianco. (B) Questa figura mostra i risultati dell'osservazione del pesce zebra al microscopio nel gruppo grezzo. (C) Questa figura mostra i risultati dell'osservazione del pesce zebra al microscopio nel gruppo trasformato. Il gruppo di controllo in bianco non ha manifestato alcuna morte o tossicità d'organo durante il periodo di somministrazione. A una concentrazione del farmaco EF di 150 μg/ml, evidenti deformità spinali, curvatura del corpo, edema pericardico e deformazione epatica sono stati osservati nel novellame nel gruppo grezzo a 72 hpf, mentre tali cambiamenti erano rari nei pesci giovani nel gruppo trattato e il grado di teratogenicità era più debole di quello nel gruppo grezzo. A una concentrazione di farmaco di 200 μg / ml, tutti i pesci giovani nel gruppo grezzo sono morti e l'evidente teratogenicità è apparsa nel gruppo trasformato. A una concentrazione di farmaco di 250 μg/ml, solo un piccolo numero di pesci zebra è sopravvissuto nel gruppo trasformato. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 5: La relazione tempo di dosaggio-dose-mortalità. Questa figura mostra la relazione tempo di dosaggio-dose-mortalità. (A) Questa figura mostra il rapporto tempo di somministrazione-dose-mortalità del gruppo grezzo. (B) Questa figura mostra il rapporto tempo di somministrazione-dose-mortalità del gruppo elaborato. n = 40. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 6: Diagramma LC50 dell'impronta ambientale grezza e trasformata. Viene mostrato il diagramma LC50 dell'impronta ambientale grezza e lavorata. Sono state calcolate le concentrazioni letali mediane dei due gruppi sperimentali a 72 hpf. La LC50 era di 151,3 μg/ml nel gruppo grezzo (S) e di 219,8 μg/ml nel gruppo di lavorazione (P). n = 40. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Tabella 1: Progettazione sperimentale e risultati del metodo della superficie di risposta Box-Behnken dei 17 gruppi di esperimenti. La tabella 1 mostra i 17 gruppi di esperimenti progettati con il metodo della superficie di progettazione-risposta Box-Behnken e i loro risultati di punteggio completi. Clicca qui per scaricare questa tabella.
Tabella 2: Variabili utilizzate nel progetto Box-Behnken. Le variabili indipendenti e dipendenti sono elencate qui insieme ai loro livelli basso, medio e alto. Il design Box-Behnken ha permesso di identificare i fattori più influenti nella lavorazione EF, con la quantità di olio di montone (A) (15% -35%), la temperatura dell'olio di montone (B) (50 ° C-120 ° C) e la temperatura di frittura (C) (80 ° C-300 ° C) come fattori di influenza. Clicca qui per scaricare questa tabella.
Tabella 3: Equazioni di regressione e intervalli lineari dei costituenti chimici di EF. I risultati dell'equazione di regressione e dell'intervallo lineare della composizione chimica EF mostrano che c'era una buona linearità tra ciascuna delle concentrazioni di icariina, EA, EB, EC e BI e le loro aree di picco cromatografiche. Clicca qui per scaricare questa tabella.
Tabella 4: Tassi di test di recupero del campione. I tassi medi di recupero di icariin, EA, EB, EC e BI sono stati rispettivamente del 99,98%, 100,14%, 100,09%, 100,75% e 100,94% e i valori RSD% sono stati rispettivamente dello 0,56%, 0,78%, 0,84%, 1,10% e 1,47%. I risultati mostrano che l'accuratezza del metodo era adatta. Clicca qui per scaricare questa tabella.
Tabella 5: Coefficienti di regressione del modello quadratico previsto. Il valore P del modello era P < 0,01, indicando che il modello era significativo. Il valore P della mancanza di adattamento era P > 0,05, indicando che la mancanza di adattamento non era significativa. Il valore R2 era 0,9300, indicando che l'adattamento del modello era buono e l'errore era piccolo, quindi il modello era adatto per analizzare e prevedere l'effetto del contenuto di composizione chimica dell'EF saltato in padella con olio di montone. Inoltre, A 2 e D2 hanno avuto effetti significativi sul contenuto dei prodotti trasformati (P < 0,01). Le influenze di A e C del termine di un grado e C2 del termine di secondo ordine sul punteggio complessivo erano significative. Il termine di un grado B, il secondo ordine A 2, B2 e tutti gli elementi di interazione non hanno avuto effetti significativi sul punteggio complessivo. L'analisi del valore P ha mostrato che, tra i parametri sperimentali, la quantità di olio di montone (A) ha avuto la maggiore influenza sul punteggio complessivo, seguita dalla temperatura di frittura (C) e quindi dalla temperatura dell'olio di montone (B). Clicca qui per scaricare questa tabella.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Variabili indipendenti e determinazione dei loro livelli
La tecnologia di elaborazione EF è descritta solo nell'edizione 2020 della Farmacopea cinese e nelle specifiche locali di elaborazione della medicina cinese pubblicate da 26 province, comuni e regioni autonome in tutto il paese1. La descrizione prevede i seguenti passaggi: prendere l'olio di montone e riscaldarlo per scioglierlo, aggiungere brandelli EF, saltare in padella a fuoco lento fino a quando non è uniforme e lucido, estrarlo e lasciarlo raffreddare. Inoltre, 20 kg (abbreviato in 20%) di olio di montone (raffinato) vengono utilizzati per ogni 100 kg di Epimedium. Tuttavia, i parametri del processo di elaborazione di EF non sono specificati. Tra le variabili indipendenti in questo esperimento, tre fattori chiave potrebbero essere quantificati nel processo di produzione: il dosaggio dell'olio di montone, la temperatura dell'olio di montone e la temperatura di frittura. L'intervallo di valori deve essere impostato in base alla descrizione di cui sopra. Dai risultati del test preliminare, si può vedere che quando la quantità di olio di montone è del 15%, le foglie EF possono essere uniformemente rivestite con olio di montone. Quando il dosaggio supera il 35%, c'è troppo olio di montone. Infine, la gamma della quantità di olio di montone dovrebbe essere del 15% -35%. Quando la temperatura raggiunge i 50 °C, l'olio di montone si scioglie. Quando la temperatura raggiunge >120 °C, l'olio di montone inizia a fumare e la temperatura è troppo alta. Pertanto, l'intervallo di temperatura dell'olio di montone dovrebbe essere 50 ° C -120 ° C. L'edizione 2020 della Farmacopea cinese stabilisce che l'EF deve essere saltato in padella a fuoco lento. Il fuoco lento non deve superare i 200 °C e la temperatura di frittura deve variare tra 80 °C e 300 °C.
Punteggio completo
Durante la lavorazione di Epimedium, i legami glicosidici vengono rotti e i componenti glicosidici vengono trasformati in componenti glicosidici inferiori. La determinazione del contenuto di prodotti trattati EF nell'edizione 2020 della farmacopea cinese si basa sulla determinazione del contenuto totale di icariina, EA, EB e EC nei medicinali originali e un componente monoglicosidico, BI, è elencato separatamente come indicatore. In questo esperimento, il peso totale di icariin, EA, EB ed EC nell'EF elaborato era del 50%, il peso della BI era del 50% e il punteggio complessivo è stato impostato in base a questi valori.
La metodologia della superficie di risposta (RSM) è una tecnica statistica per identificare i parametri di processo ottimali e risolvere problemi multivariati. In questa tecnica, un disegno sperimentale ragionevole viene utilizzato per ottenere determinati dati attraverso esperimenti e un'equazione di regressione quadratica multivariata viene utilizzata per derivare una relazione funzionale tra i fattori e le risposte22. La progettazione uniforme e l'ottimizzazione del processo di progettazione ortogonale sono comunemente utilizzate, ma la loro accuratezza del test non è elevata e il modello matematico non è molto prevedibile. Il modello matematico alla base di RSM è altamente prevedibile. RSM richiede meno esperimenti e cicli più brevi, che non solo possono eliminare i problemi associati alla statistica matematica tradizionale, ma possono anche chiarire le relazioni tra fattori e risposte23. RSM concettualizza la risposta del sistema in funzione di uno o più fattori e utilizza tecniche grafiche per visualizzare questa relazione funzionale per aiutare l'utente a selezionare le condizioni ottimali nel progetto sperimentale mediante un'osservazione visiva intuitiva. Questi vantaggi hanno portato all'ampio uso di questo metodo nell'industria chimica24, nell'ingegneria biologica, nell'industria alimentare25, nell'industria farmaceutica e nei preparati TCM.
Sebbene l'RSM possa identificare la relazione funzionale tra risposte (indici da indagare) e fattori (variabili indipendenti), non tutti gli esperimenti sono adatti per l'ottimizzazione della superficie di risposta perché non esiste sempre una forte relazione funzionale tra la risposta e i fattori. RSM ottiene spesso relazioni di funzione continue, che richiedono che tutti i fattori siano variabili continue. Tuttavia, non tutti i fattori da indagare sono variabili continue o hanno effetti significativi sui valori di risposta all'inizio del disegno sperimentale. Per ridurre il numero di esperimenti e migliorare l'accuratezza della modellazione della superficie di risposta, è necessario lo screening per selezionare i fattori significativi e determinarne i livelli attraverso la progettazione fattoriale, la progettazione uniforme o la progettazione ortogonale prima di condurre la metodologia di progettazione della superficie di risposta. Il più grande vantaggio della metodologia della superficie di risposta è che una volta stabilito correttamente il modello, è possibile prevedere il valore di risposta in qualsiasi combinazione di condizioni e la relazione funzionale può essere vista in modo più intuitivo e visivo attraverso la superficie di risposta 3D. Questa visualizzazione è di grande aiuto per i ricercatori nel trovare le condizioni ottimali di elaborazione26.
Questo studio ha utilizzato il principio di progettazione Box-Behnken di RSM per progettare 17 esperimenti combinati utilizzando il punteggio completo del contenuto chimico di EF come valore di risposta. Infine, i migliori risultati di ottimizzazione del processo sono stati ottenuti mediante analisi di regressione. La tecnologia di lavorazione è stata ottimizzata come segue: riscaldare l'olio di montone a 120 °C ± 10 °C, aggiungere l'EF grezzo, friggerlo a fuoco delicato (189 °C ± 10 °C) fino a quando non è uniformemente lucido, quindi rimuoverlo e raffreddarlo. Per ogni 100 kg di EF, devono essere utilizzati 15 kg di olio di montone (olio raffinato). I nostri risultati hanno mostrato che il processo EF era stabile, affidabile e ripetibile. Inoltre, sono state analizzate le interazioni fattoriali e l'interazione tra la quantità di olio di montone e la temperatura di frittura, ma non le interazioni tra altri fattori, è stata significativa. Questo studio ha dimostrato che la progettazione della superficie di risposta, come metodo per analizzare le interazioni tra i fattori e le relazioni tra i fattori e i loro valori della superficie di risposta, ha permesso l'ottimizzazione delle condizioni di elaborazione in un breve periodo con un numero minimo di esperimenti. I fattori selezionati in questo studio erano i fattori chiave identificati nell'esperimento di screening a fattore singolo e i loro livelli sono stati determinati in un esperimento preliminare. I campioni di prova erano conformi alle caratteristiche del metodo della superficie di risposta, quindi lo studio è stato in grado di utilizzare la metodologia della superficie di risposta per stabilire un modello predittivo. I risultati sperimentali possono fornire un riferimento per migliorare la qualità e l'uniformità dell'EF elaborata.
Gli embrioni di zebrafish sono utilizzati come organismi modello nel campo della genetica dello sviluppo perché sono trasparenti, si sviluppano in vitro e sono facili da osservare27. Gli indicatori di tossicità del pesce zebra comunemente usati negli studi di tossicità per lo sviluppo includono mortalità embrionale, tasso di malformazione embrionale, edema del sacco vitellino, formazione di pigmento, condensazione delle uova, estensione della coda, morfologia della testa e formazione del segmento corporeo, tra gli altri28. Rispetto alle tecniche di valutazione della tossicità dei mammiferi, la specificità degli embrioni di zebrafish per il rilevamento della tossicità composta è del 70%-80% e la sensibilità supera l'80%18. Ton et al.29 hanno scoperto che l'accuratezza della valutazione della tossicità dello sviluppo di composti non teratogeni con embrioni di zebrafish era del 75%. I composti teratogeni sono stati valutati con una precisione del 100%. Sebbene la MTC abbia le caratteristiche di componenti complessi e organi bersaglio di tossicità poco chiari, gli embrioni di zebrafish possono ancora essere utilizzati come modello animale sperimentale per la valutazione accurata e rapida della tossicità dello sviluppo. He et al.30 hanno scoperto che l'emodina ha influenzato i tassi di sopravvivenza e schiusa degli embrioni di zebrafish, causando la flessione del tronco e l'edema del sacco vitellino. Chen et al.31 hanno scoperto che il muscone causava edema pericardico dell'embrione di zebrafish, curvatura spinale ed edema del sacco vitellino. He et al.32 hanno scoperto che Arnebiae Radix ha avuto effetti letali sul pesce zebra in tutte le fasi dello sviluppo, e 1,0 mg / L Arnebiae Radix ha inibito lo sviluppo embrionale, con conseguente riduzione del numero di somiti, deformità della coda, flessione del corpo e melanina ridotta negli embrioni di zebrafish.
Per studiare gli effetti dell'EF grezzo e trasformato sullo sviluppo embrionale del pesce zebra, in questo studio è stato condotto un esperimento di tossicità sullo sviluppo dell'embrione di zebrafish. I dati hanno mostrato che i valori di LC50 erano 151,3 μg/mL per il gruppo grezzo (S) e 219,8 μg/mL per il gruppo trattato (P). L'osservazione dei corpi dei pesci zebra in ciascun gruppo sperimentale attraverso un microscopio ha mostrato un evidente grado di teratogenicità del pesce zebra nel gruppo grezzo. La maggior parte dei pesci ha mostrato vari gradi di teratogenicità, tra cui deformità spinale, deformità della curvatura del corpo, edema pericardico, incompletezza della vescica natatoria o deformazione del fegato, e queste osservazioni erano rare nel gruppo elaborato. Questi esperimenti hanno dimostrato che la tossicità dell'EF è stata significativamente ridotta dopo l'elaborazione, suggerendo che l'elaborazione potrebbe ridurre la tossicità dei farmaci negli esseri umani. I risultati sperimentali forniscono un riferimento per migliorare la sicurezza clinica dei farmaci dell'EF trattato con olio di montone.
La medicina tradizionale cinese suggerisce che la funzione del rene è strettamente correlata alla crescita, allo sviluppo e alla riproduzione del corpo umano33. Gli antichi libri della medicina tradizionale cinese registrano che il rene è il midollo osseo del corpo. Il rene immagazzina l'essenza e il midollo risiede nella cavità ossea per nutrire l'osso. Quando l'essenza renale è carente, il midollo osseo si riduce34. La medicina tradizionale cinese di tonificare il rene yang può trattare la debolezza lombare, l'osteoporosi, l'impotenza, l'eiaculazione precoce e l'infertilità uterina fredda35. EF è uno dei materiali medicinali rappresentativi per tonificare il rene yang. I moderni studi farmacologici hanno dimostrato che l'EF ha effetti evidenti sul sistema scheletrico, sul sistema immunitario, sul sistema riproduttivo, sul sistema cardiovascolare e sul sistema nervoso, oltre ad avere effetti antitumorali36. In termini di attività sul sistema scheletrico, icariina37 può migliorare il livello sierico di E2 nei ratti ovariectomizzati e sovraregolare l'espressione di mRNA ERβ nel tessuto osseo dei ratti ovariectomizzati. La sintesi di ERβ è aumentata, migliorando così l'effetto biologico di ER, indebolendo l'attività di riassorbimento osseo degli osteoclasti e migliorando la formazione ossea degli osteoblasti. I cambiamenti nel riassorbimento osseo sono maggiori del bilancio negativo del metabolismo osseo. Epimedin A può migliorare la microstruttura ossea e i marcatori di turnover osseo sierico nei topi modello di osteoporosi inibendo la formazione, la differenziazione e il riassorbimento osseo degli osteoclasti e svolgendo un ruolo nella protezione ossea38. Epimedin C ha un'evidente attività anti-osteoporosi, principalmente in termini di aumento della massa ossea e miglioramento della microstruttura trabecolare per aumentare la resistenza ossea39. Altri studi hanno dimostrato che epimedin B40 e baohuoside I41 hanno attività anti-osteoporosi.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Gli autori non dichiarano conflitti di interesse.
Acknowledgments
Questo lavoro è supportato dal Basic Scientific Research Business Project della Chongqing Academy of Traditional Chinese Medicine (numero di progetto: jbky20200013), dal Performance Incentive Guidance Project degli istituti di ricerca scientifica di Chongqing (numero di progetto: cstc2021jxjl 130025) e dal progetto di costruzione della disciplina chiave della Commissione sanitaria municipale di Chongqing di Chinese Materia Medica Processing.
Materials
| Name | Company | Catalog Number | Comments |
| Acetonitrile | Fisher | 197164 | |
Baohuoside 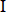 (B (B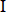 ) ) |
Chengdu Manst Biotechnology Co., Ltd. | MUST-20042402 | |
| Chromatographic column | Waters Corporation | Symmetry C18 | |
| Design Expert software | Stat- Ease Inc., Minneapolis, MN | Trial Version8.0.6.1 | |
| Detector | Waters Corporation | 2998 | |
| Disintegrator | Hefei Rongshida Small Household Appliance Co., Ltd. | S-FS553 | |
| Electronic analytical balance | Mettler-Toledo International Inc. | MS205DU | |
| Epimedin A (EA) | Chengdu Manst Biotechnology Co., Ltd. | MUST-21112118 | |
| Epimedin B (EB) | Chengdu Manst Biotechnology Co., Ltd. | MUST-20080403 | |
| Epimedin C (EC) | Chengdu Manst Biotechnology Co., Ltd. | MUST-20080310 | |
| Ethanol | Chongqing Chuandong Chemical ( Group ) Co., Ltd. | 20180801 | |
| Graphpad software | GraphPad Software Inc., San Diego, CA, USA | 6.02 | |
| High Performance Liquid Chromatography (HPLC) | Waters Corporation | 2695 | |
| Icariin | Chengdu Glip Biotechnology Co., Ltd. | 21091401 | |
| Methanol | Chongqing Chuandong Chemical (Group) Co., Ltd. | 20171101 | |
| Microporous membrane | Tianjin Jinteng Experimental Equipment Co., Ltd. | 0.22μm | |
| Mutton oil | Kuoshan Zhiniu Fresh Food Store | 20211106 | |
| Office Excel office software | Microsoft | Office Excel 2021 | |
| Pharmacopoeia sieve | Shaoxing Shangyu Huafeng Hardware Instrument Co., Ltd. | R40/3 | |
| Pure water machine | Chongqing Andersen Environmental Protection Equipment Co., Ltd. | AT Sro 10A | |
| Qualitative filter paper | Shanghai Leigu Instrument Co., Ltd. | 18cm | |
| Stereomicroscope | Carl Zeiss, Oberkochen, Germany | Stemi 2000 | |
| Ultrasonic cleaner | Branson Ultrasonics (Shanghai) Co.,Ltd. | BUG25-12 | |
| Zebrafish | China Zebrafish Resource Center (CZRC) | The AB strain |
References
- Chinese Pharmacopoeia Commission. Chinese Pharmacopoeia. Volume I. , China Medical Science and Technology Press. Beijing, China. (2020).
- Wang, X. T. Collection of Traditional Chinese Medicine Processing Methods. , Nanchang Science and Technology Press. Jiangxi, China. (1998).
- Chen, L. L., Jia, X. B., Jia, D. S. Advances in studies on processing mechanism of Epimedii Folium. Chinese Traditional and Herbal Drugs. 12 (12), 2108-2111 (2010).
- Zhao, W., et al. Optimized extraction of polysaccharides from corn silk by pulsed electric field and response surface quadratic design. Journal of The Science of Food and Agriculture. 91 (12), 2201-2209 (2011).
- Zhao, L. C., et al. The use of response surface methodology to optimize the ultrasound-assisted extraction of five anthraquinones from Rheum palmatum L. Molecules. 16 (7), 5928-5937 (2011).
- Mao, W. H., Han, L. J., Shi, B. Optimization of microwave assisted extraction of flavonoid from Radix Astragali using response surface methodology. Separation Science and Technology. 43 (12), 671-681 (2008).
- Liu, W., et al. Optimization of total flavonoid compound extraction from Gynura medica leaf using response surface methodology and chemical composition analysis. International Journal of Molecular Sciences. 11 (11), 4750-4763 (2010).
- Guo, G. L., et al. Research progress on processing mechanism of Epimedium fried with sheep fat oil based on warming kidney and promoting yang. Journal of Liaoning University of TCM. 22 (07), 1-5 (2020).
- Shen, X. J., Zhou, Q., Sun, L. -L., Dai, Y. -P., Yan, X. -S. Optimization for cutting procedure of astragali radix with Box-Behnken design and response surface method. China Journal of Chinese Materia Medica. 39 (13), 2498-2503 (2014).
- Wang, L. H., et al. Optimization of processing technology of honey wheat bran based on Box-Behnken response surface methodology. Chinese Traditional and Herbal Drugs. 52 (12), 3538-3543 (2021).
- Zhang, J. B., et al. Study on integrated process of producing area and processing production for Paeoniae Radix Alba based on Box-Behnken response surface methodology. Chinese Traditional and Herbal Drugs. 53 (18), 5657-5662 (2022).
- Li, N., Zhang, X. M., Yao, Y. Y., Chen, Y. L., Fan, Q. Optimization of processing technology for Psoraleae Fructus by D-optimal response surface methodology with UHPLC. Chinese Traditional and Herbal Drugs. 39 (05), 42-44 (2022).
- Jia, Y. Q., et al. Optimization of processing technology with wine of Cnidii Fructus by AHP-entropy weight method combined with response surface method. Journal of Chinese Medicinal Materials. 10, 2338-2343 (2022).
- Chen, F. G., et al. Optimization of the baked drying technology of Cinnamomi Ramulus based on CRITIC combined with Box-Behnken response surface method. Journal of Chinese Medicinal Materials. 2022 (08), 1838-1842 (2022).
- Wang, W. D., et al. Optimization extraction of effective constituents from Epimedii Herba based on central composite design-response surface methodology and orthogonal experimental design. Lishizhen Medicine and Materia Medica. 21 (11), 2766-2768 (2010).
- Yang, L., et al. Zebrafish embryos as models for embryotoxic and teratological effects of chemicals. Reproductive Toxicology. 28 (2), 245-253 (2009).
- Kanungo, J., Cuevas, E., Ali, S. F., Paule, M. G. Zebrafish model in drug safety assessment. Current Pharmaceutical Design. 20 (34), 5416-5429 (2014).
- Jayasinghe, C. D., Jayawardena, U. A. Toxicity assessment of herbal medicine using zebrafish embryos: A systematic review. Evidence-Based Complementary and Alternative Medicine. 2019, 7272808 (2019).
- Scholz, S. Zebrafish embryos as an alternative model for screening of drug induced organ toxicity. Archives of Toxicology. 87 (5), 767-769 (2013).
- Ling, J., et al. Analysis of Folium Epimedium toxicity in combination with Radix Morindae Officinalis based on zebrafish toxicity/metabolism synchronization. Acta Pharmaceutica Sinica. 53 (1), 74 (2018).
- Wang, Y., et al. Tri-n-butyl phosphate delays tissue repair by dysregulating neutrophil function in zebrafish. Toxicology and Applied Pharmacology. 449, 116114 (2022).
- Sheng, Z. L., Li, J. C., Li, Y. H. Optimization of forsythoside extraction from Forsythia suspensa by Box-Behnken design. African Journal of Biotechnology. 10 (55), 11728-11737 (2011).
- Pang, X., et al. Prenylated flavonoids and dihydrophenanthrenes from the leaves of Epimedium brevicornu and their cytotoxicity against HepG2 cells. Natural Product Research. 32 (19), 2253-2259 (2018).
- Zhong, R., et al. The toxicity and metabolism properties of Herba Epimedii flavonoids on laval and adult zebrafish. Evidence-Based Complementary and Alternative Medicine. 2019, 3745051 (2019).
- Zhang, L., et al. Effect of 2" -O-rhamnosyl icariside II, baohuoside I and baohuoside II in Herba Epimedii on cytotoxicity indices in HL-7702 and HepG2 cells. Molecules. 24 (7), 1263 (2019).
- Chen, Y., Yang, R. J., Yu, M., Ding, S. L., Chen, R. Q. Application of response surface methodology in modern production process optimization. Science & Technology Vision. 2016 (19), 36-39 (2016).
- Zhang, Y., et al. Progress in using zebrafish as a toxicological model for traditional Chinese medicine. Journal of Ethnopharmacology. 282, 114638 (2022).
- Oliveira, R., Domingues, I., Grisolia, C. K., Soares, A. M. V. M. Effects of triclosan on zebrafish early-life stages and adults. Environmental Science and Pollution Research. 16 (6), 679-688 (2009).
- Ton, C., Lin, Y., Willett, C. Zebrafish as a model for developmental neurotoxicity testing. Birth Defects Research. Part A, Clinical and Molecular Teratology. 76 (7), 553-567 (2006).
- He, Q., et al. Toxicity induced by emodin on zebrafish embryos. Drug and Chemical Toxicology. 35 (2), 149-154 (2012).
- Chen, Y., et al. Developmental toxicity of muscone on zebrafish embryos. Chinese Journal of Pharmacology and Toxicology. (6), 267-273 (2014).
- He, Y. L., et al. Effects of shikonin on zebrafish's embryo and angiogenesis. Chinese Traditional Patent Medicine. 38 (2), 241-245 (2016).
- Zhou, Y. The transformation research on the chemical compositions in the processing of Epimedium. , Kunming University of Science and Technology. Kunming, China. (2016).
- Xiao, Y. P., Zeng, J., Jiao, L. -N., Xu, X. -Y. Review for treatment effect and signaling pathway regulation of kidney-tonifying traditional Chinese medicine on osteoporosis. China Journal of Chinese Materia Medica. 43 (1), 21-30 (2018).
- Wang, R. H. Study on modern pharmacological effects of traditional Chinese medicine for tonifying kidney yang. Journal of Hubei University of Chinese Medicine. 13 (04), 63-66 (2011).
- Luo, L., et al. Advances in the chemical constituents and pharmacological studies of Epimedium. Asia-Pacific Traditional Medicine. 15 (6), 190-194 (2019).
- Liu, S., et al. Effects of icariin on ERβ gene expression and serum estradiol level in ovariectomized rats. Hunan Journal of Traditional Chinese Medicine. 32 (1), 150-152 (2016).
- Liu, Y., et al. Effects of epimedin A on osteoclasts and osteoporotic male mice. Chinese Journal of Veterinary Science. 41 (07), 1359-1364 (2021).
- Liu, Y. L., et al. Effects of icariin and epimedium C on microstructure of bone tissue in glucocorticoid osteoporosis model mice based on Micro-CT technique. Drug Evaluation Research. 43 (09), 1733-1739 (2020).
- Zhan, Y. Evaluation of antiosteoporotic activity for micro amount icariin and epimedin B based on the osteoporosis model using zebrafish. Chinese Pharmaceutical Journal. (24), 30-35 (2014).
- Zhan, Y., Wei, Y. -J., Sun, E., Xu, F. -J., Jia, X. -B. Two-dimensional zebrafish model combined with hyphenated chromatographic techniques for evaluation anti-osteoporosis activity of epimendin A and its metabolite baohuoside I. Acta Pharmaceutica Sinica. 49 (06), 932-937 (2014).



