8.4:
이온화 에너지
8.4:
이온화 에너지
지상 상태에서 기체 원자에서 가장 느슨하게 결합된 전자를 제거하는 데 필요한 에너지의 양은 첫 번째 이온화에너지(IE1)라고합니다. 요소X의 첫 번째 이온화 에너지는 1+ 충전으로 양이온을 형성하는 데 필요한 에너지입니다.
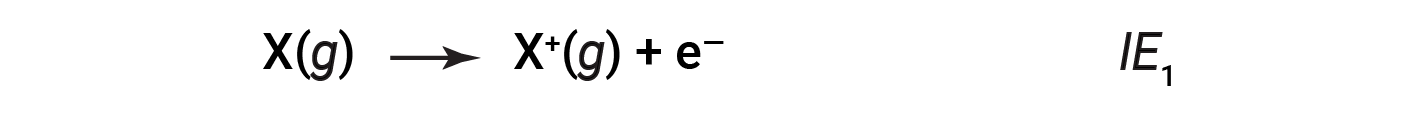
두 번째로 느슨하게 결합된 전자를 제거하는 데 필요한 에너지는 제2 이온화에너지(IE2)라고합니다.
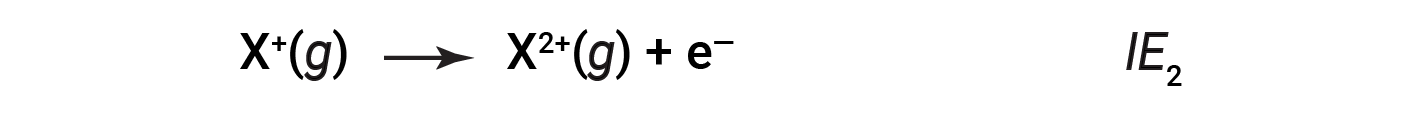
세 번째 전자를 제거하는 데 필요한 에너지는 세 번째 이온화 에너지 등입니다. 원자 나 이온에서 전자를 제거하는 데 에너지는 항상 필요하므로 이온화 과정은 내독적이며 IE 값은 항상 긍정적입니다. 더 큰 원자의 경우 가장 느슨하게 결합된 전자는 핵에서 멀리 떨어져 있으므로 제거하기가 더 쉽습니다. 따라서 크기(원자 반경)가 증가함에 따라 이온화 에너지가 감소해야 합니다.
기간 내에 IE1은 일반적으로 Z가증가함에 따라 증가합니다. 그룹 아래로, IE1 값은 일반적으로 증가 Z와함께 감소 . 그러나 이러한 추세에는 몇 가지 체계적인 편차가 있습니다. 붕소의 핵 충전이 양성자 1개에 의해 더 크더라도 붕소(원자번호 5)의 이온화 에너지는 베릴륨(원자번호 4)보다 적습니다. 이는 침투 및 차폐로 인해 l이 증가함에 따라 서브쉘의 에너지가 증가하기 때문에 설명할 수 있다. 어떤 껍질 안에든, s 전자는 p 전자 보다는 에너지에서 더 낮습니다. 이것은 s 전자가 동일한 껍질에 있는 p 전자 보다는 원자에서 제거하기 어렵다는 것을 의미합니다. 베릴륨([He]2s2)의이온화 중에 제거된 전자는 전자이며, 붕소의 이온화 중에 제거된 전자는 p 전자입니다. 이로 인해 핵충전이 양성자 1명이 더 크더라도 붕소에 대한 첫 번째 이온화 에너지가 낮아집니다. 따라서 새 서브쉘이 시작될 때마다 예측된 추세와 작은 편차가 발생하는 것을 볼 수 있습니다.
또 다른 편차는 궤도가 절반 이상 채워지면 발생합니다. 산소에 대한 첫 번째 이온화 에너지는 기간 동안 IE1 값을 증가시키는 추세에도 불구하고 질소에 대한 에너지보다 약간 적습니다. 산소의 경우, 전자를 제거하면 2p 궤도에서 전자를 페어링하여 발생하는 전자 전자 반발을 제거하고 반으로 채워진 궤도 (이는 활력으로 유리합니다)를 초래할 것입니다. 유사 변경은 후속 기간에 발생합니다.
양이온에 대한 정전기의 매력이 커서 중성 원자에서 전자를 제거하는 것보다 는 양이온에서 전자를 제거하는 것이 더 어렵습니다. 마찬가지로, 더 높은 양전하로 양이온에서 전자를 제거하는 것은 더 낮은 전하로 이온에서 전자를 제거하는 것보다 더 어렵습니다. 따라서, 한 요소에 대한 연속 이온화 에너지는 항상 증가한다. 표 1에서 볼 수 있듯이, 각 요소에 대한 이온화 에너지가 크게 증가합니다. 이 점프는 원자 전자보다 제거하기 어려운 핵심 전자의 제거에 해당합니다. 예를 들어, Sc와 Ga는 모두 3개의 발렌스 전자를 가지고 있으므로 이온화 에너지의 급속한 증가는 제3이온화 후에 발생합니다.
표 1: 선택한 요소에 대한 연속이온화 에너지(kJ/mol)
| 요소 | IE1 | IE2 | IE3 | IE4 | IE5 | IE6 | IE7 |
| K | 418.8 | 3051.8 | 4419.6 | 5876.9 | 7975.5 | 9590.6 | 11343 |
| Ca | 589.8 | 1145.4 | 4912.4 | 6490.6 | 8153.0 | 10495.7 | 12272.9 |
| 사우스 캐롤라이나 | 633.1 | 1235.0 | 2388.7 | 7090.6 | 8842.9 | 10679.0 | 13315.0 |
| 조지아 | 578.8 | 1979.4 | 2964.6 | 6180 | 8298.7 | 10873.9 | 13594.8 |
| Ge | 762.2 | 1537.5 | 3302.1 | 4410.6 | 9021.4 | 사용할 수 없음 | 사용할 수 없음 |
| 944.5 | 1793.6 | 2735.5 | 4836.8 | 6042.9 | 12311.5 | 사용할 수 없음 |
