8.4:
Energia ionizzata
8.4:
Energia ionizzata
La quantità di energia necessaria per rimuovere l’elettrone più liberamente legato da un atomo gassoso nel suo stato suolo è chiamata la sua prima energia di ionizzazione (IE1). La prima energia di ionizzazione per un elemento, X, è l’energia necessaria per formare una catione con 1+ carica:
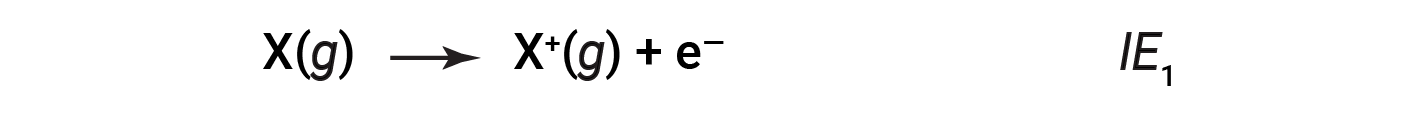
L’energia necessaria per rimuovere il secondo elettrone più legato è chiamata seconda energia di ionizzazione (IE2).
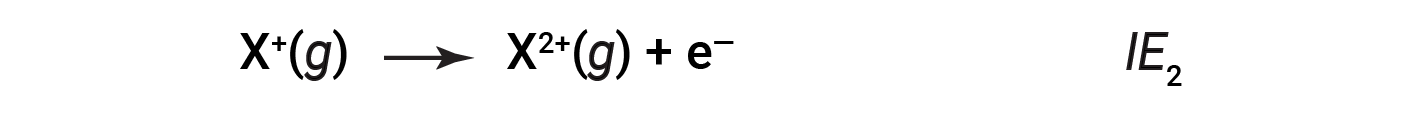
L’energia necessaria per rimuovere il terzo elettrone è la terza energia di ionizzazione, e così via. L’energia è sempre necessaria per rimuovere elettroni da atomi o ioni, quindi i processi di ionizzazione sono endotermici e i valori di IE sono sempre positivi. Per gli atomi più grandi, l’elettrone più legato si trova più lontano dal nucleo e quindi è più facile da rimuovere. Pertanto, con l’aumentare delle dimensioni (raggio atomico), l’energia di ionizzazione dovrebbe diminuire.
Entro un certo periodo, l’IE1 aumenta generalmente con l’aumento della Z. Verso il basso di un gruppo, il valore di IE1 diminuisce generalmente con l’aumento di Z. Vi sono tuttavia alcune deviazioni sistematiche da questa tendenza. Si noti che l’energia di ionizzazione del boro (numero atomico 5) è inferiore a quella del berillio (numero atomico 4) anche se la carica nucleare di boro è maggiore di un protone. Questo può essere spiegato perché l’energia dei subshell aumenta con l’aumentare, a causa della penetrazione e della schermatura. All’interno di ogni guscio, gli elettroni s sono più bassi in energia rispetto agli elettroni p. Ciò significa che un elettrone s è più difficile da rimuovere da un atomo di un elettrone p nello stesso guscio. L’elettrone rimosso durante la ionizzazione del berillio ([He]2s2) è un elettrone s, mentre l’elettrone rimosso durante la ionizzazione del boro ([He]2s22 p1) è un elettrone p; ciò si traduce in una prima energia di ionizzazione inferiore per il boro, anche se la sua carica nucleare è maggiore di un protone. Pertanto, vediamo una piccola deviazione dalla tendenza prevista che si verifica ogni volta che inizia una nuova sottoshell.
Un’altra deviazione si verifica quando gli orbitali diventano più della metà riempiti. La prima energia di ionizzazione per l’ossigeno è leggermente inferiore a quella dell’azoto, nonostante la tendenza all’aumento dei valori di IE1 in un periodo. Per l’ossigeno, la rimozione di un elettrone eliminerà la repulsione elettrone-elettrone causata dall’accoppiamento degli elettroni nell’orbitale 2p e si tradurrà in un orbitale semi-riempito (che è energeticamente favorevole). Cambiamenti analoghi si verificano nei periodi successivi.
Rimuovere un elettrone da un catione è più difficile che rimuovere un elettrone da un atomo neutro a causa della maggiore attrazione elettrostatica per il catione. Allo stesso modo, rimuovere un elettrone da un catione con una carica positiva più alta è più difficile che rimuovere un elettrone da uno ione con una carica inferiore. Pertanto, le energie di ionizzazione successive per un elemento aumentano sempre. Come si è visto nella tabella 1, vi è un forte aumento delle energie di ionizzazione per ogni elemento. Questo salto corrisponde alla rimozione degli elettroni del nucleo, che sono più difficili da rimuovere rispetto agli elettroni di valenza. Per esempio, Sc e Ga hanno entrambi tre elettroni di valenza, quindi il rapido aumento dell’energia di ionizzazione avviene dopo la terza ionizzazione.
Tabella 1: Energie di ionizzazione successive per elementi selezionati (kJ/mol)
| Elemento | IE1 | IE2 | IE3 | IE4 | IE5 | IE6 | IE7 |
| K | 418.8 | 3051.8 | 4419.6 | 5876.9 | 7975.5 | 9590.6 | 11343 |
| Ca | 589.8 | 1145.4 | 4912.4 | 6490.6 | 8153.0 | 10495.7 | 12272.9 |
| M.b | 633.1 | 1235.0 | 2388.7 | 7090.6 | 8842.9 | 10679.0 | 13315.0 |
| Ga | 578.8 | 1979.4 | 2964.6 | 6180 | 8298.7 | 10873.9 | 13594.8 |
| Ge | 762.2 | 1537.5 | 3302.1 | 4410.6 | 9021.4 | Non disponibile | Non disponibile |
| Come | 944.5 | 1793.6 | 2735.5 | 4836.8 | 6042.9 | 12311.5 | Non disponibile |
Questo testo è adattato da OpenStax Chemistry 2e, Sezione 6.5: Variazioni periodiche nelle proprietà degli elementi.
