11.14:
Estructuras de los Sólidos
11.14:
Estructuras de los Sólidos
Los sólidos en los que los átomos, iones o moléculas están dispuestos en un patrón repetitivo definido se conocen como sólidos cristalinos. Los metales y los compuestos iónicos suelen formar sólidos cristalinos ordenados. Un sólido cristalino tiene una temperatura de fusión precisa porque cada átomo o molécula del mismo tipo se mantiene en su lugar con las mismas fuerzas o energía. Sólidos amorfos o sólidos no cristalinos (o, a veces, cristales) que carecen de una estructura interna ordenada y están dispuestos aleatoriamente. Las sustancias que consisten en moléculas grandes, o una mezcla de moléculas cuyos movimientos son más restringidos, a menudo forman sólidos amorfos. El material amorfo sufre un ablandamiento gradual, en un rango de temperaturas, debido a la no equivalencia estructural de las moléculas. Cuando se calienta un material amorfo, las atracciones intermoleculares más débiles se rompen primero. A medida que la temperatura aumenta aún más, las atracciones más fuertes se rompen.
Celda unitaria
La estructura de un sólido cristalino se describe mejor por su unidad repetitiva más simple, conocida como su celda unitaria. La celda unitaria consiste en puntos de celosia que representan las ubicaciones de los átomos o iones. La estructura completa consiste entonces en esta celda unitaria que se repite en tres dimensiones, como se ilustra en la Figura 1.
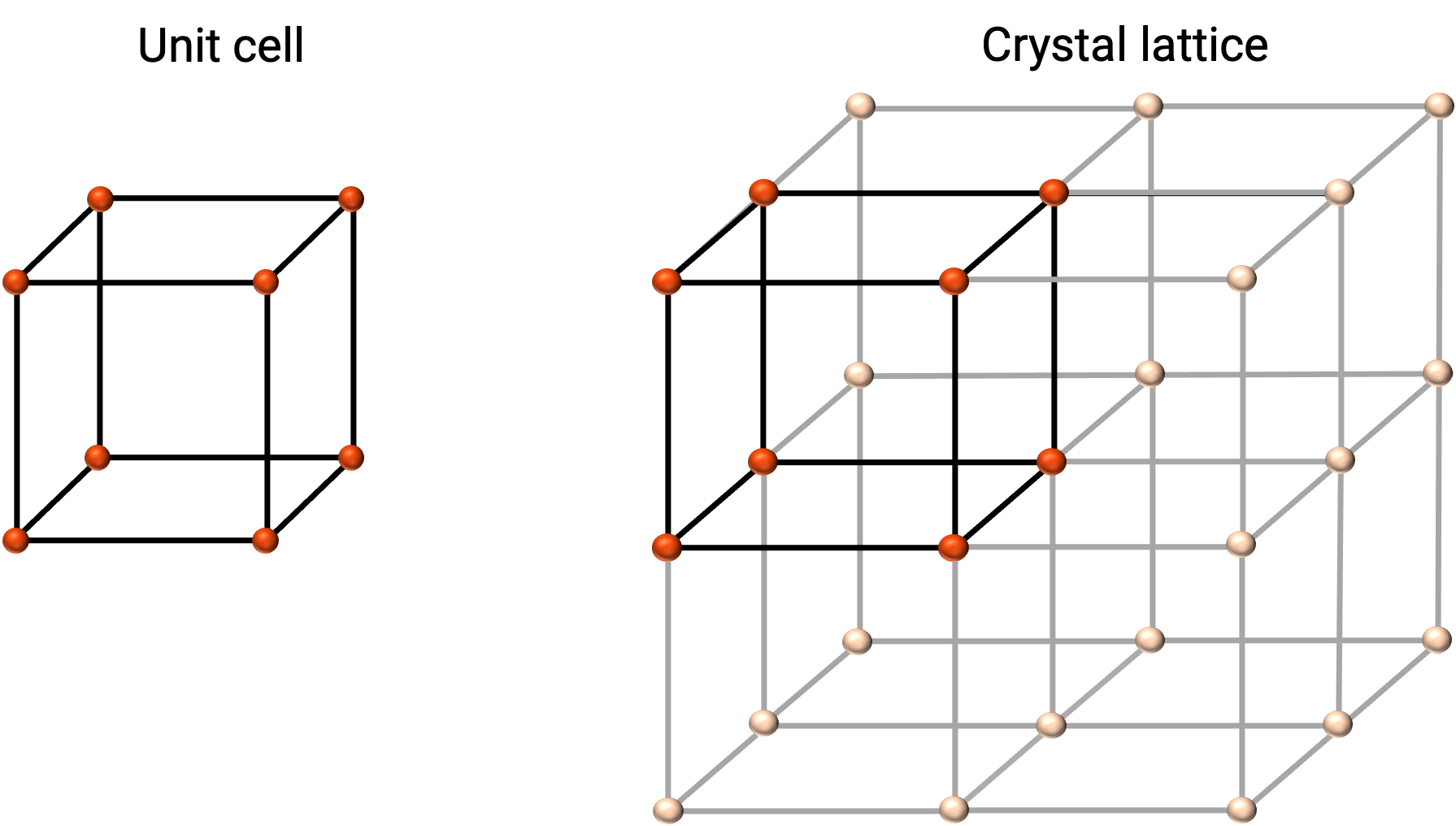
Figura 1.Célula unitaria y celosía cristalina con puntos de celosía indicados en rojo.
En general, una celda unitaria se define por las longitudes de tres ejes (a, b y c) y los ángulos (α, β y γ) entre ellos, como se muestra en la Figura 2. Los ejes se definen como las longitudes entre los puntos en la celosía espacial.
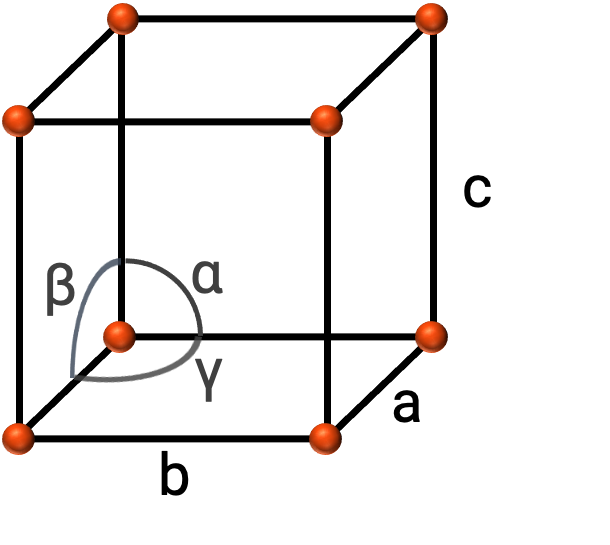
Figura 2. La celda unitaria se define por sus ejes (a, b y c) y ángulos (α, β, y γ)
Hay siete sistemas de celosía diferentes, algunos de los cuales tienen más de un tipo de celosía, para un total de catorce celdas unitarias diferentes.
| Sistemas | Ángulos | Ejes |
| Cúbico | α = β = γ = 90° | a = b = c |
| Tetragonal | α = β = γ = 90° | a = b ≠ c |
| Ortorrómbico | α = β = γ = 90° | a ≠ b ≠ c |
| Monoclínica | α = γ = 90°; β ≠ 90° | a ≠ b ≠ c |
| Triclínico | α ≠ β ≠ γ ≠ 90° | a ≠ b ≠ c |
Este texto es adaptado deOpenstax, Química 2e, Sección 10.6: Estructuras de Celosía en Sólidos Cristalinos.
