13.10:
Étape cinétiquement déterminantes
13.10:
Étape cinétiquement déterminantes
Relier les mécanismes de réaction
Dans un mécanisme de réaction en plusieurs étapes, l’une des étapes élémentaires progresse significativement plus lentement que les autres. Cette étape la plus lente est appelée l’étape limitante de la vitesse (ou l’étape déterminante de la vitesse). Une réaction ne peut pas se poursuivre plus rapidement que son étape la plus lente et, par conséquent, l’étape déterminante de la vitesse limite la vitesse de la réaction globale.
Le concept d’étape déterminante de la vitesse peut être expliquée à partir de l’analogie d’une autoroute à 4 voies avec une courte section d’embouteillage causé par la fermeture de voie. Tout comme l’embouteillage qui impacte la vitesse globale à laquelle les véhicules pourraient se déplacer, l’étape élémentaire la plus lente influence la vitesse nette de la réaction.
Les lois de vitesse peuvent être déduites directement à partir des équations chimiques équilibrées des réactions élémentaires. Toutefois, ce n’est pas le cas pour la plupart des réactions chimiques, où les équations équilibrées représentent souvent la transformation globale du système chimique, résultant de mécanismes de réaction en plusieurs étapes. Par conséquent, la loi de vitesse doit être déterminée à partir de données expérimentales et le mécanisme réactionnel doit être ensuite déduit à partir de la loi de vitesse.
Prenons par exemple la réaction de NO2 et de CO :
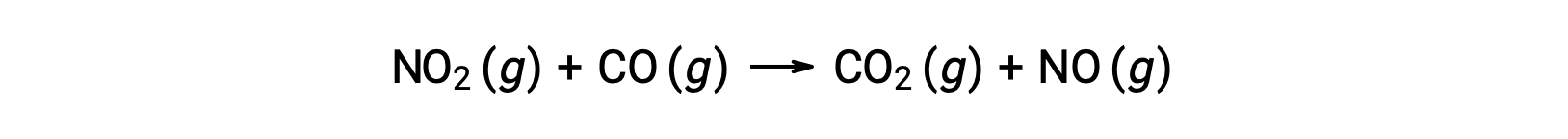
La loi de vitesse expérimentale pour cette réaction à des températures supérieures à 225 °C est :
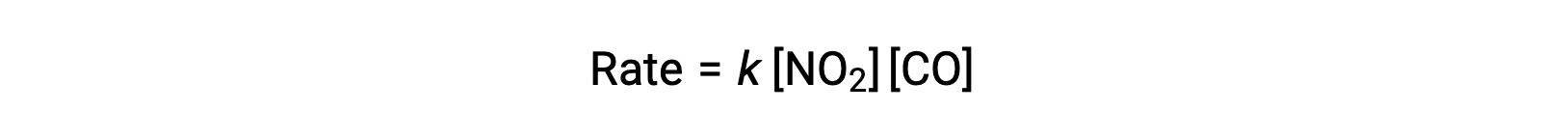
Selon la loi de vitesse, la réaction est du premier ordre par rapport à NO2 et du premier ordre par rapport à CO. Ceci est cohérent avec un mécanisme bimoléculaire en une seule étape, et il est possible que ce mécanisme réactionnel soit valable pour ce procédé chimique à des températures élevées.
Toutefois, à des températures inférieures à 225 °C, la réaction est décrite par une loi de vitesse différente qui est du deuxième ordre par rapport à NO2 :
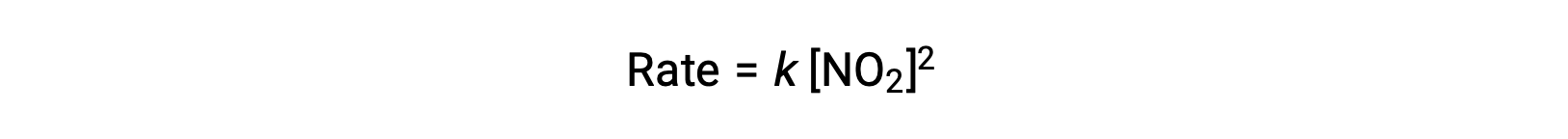
Cette loi de vitesse n’est pas cohérente avec le mécanisme en une seule étape, mais elle est cohérente avec le mécanisme suivant en deux étapes :
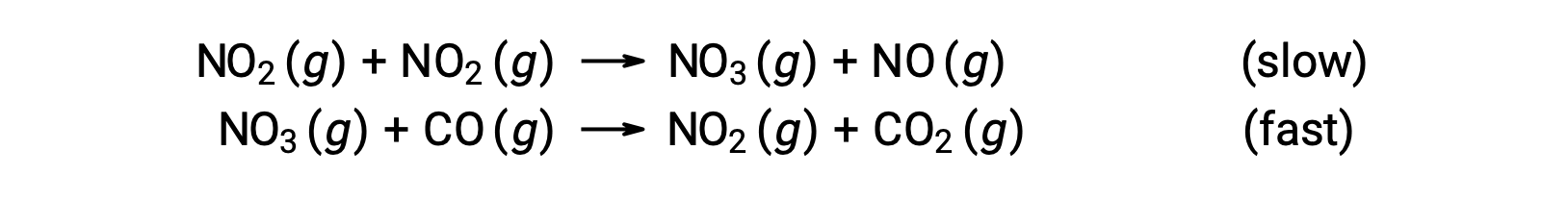
L’étape déterminante de la vitesse (plus lente) donne une loi de vitesse montrant une dépendance du deuxième ordre à la concentration de NO2, et la somme des deux équations élémentaires donne la réaction nette globale.
En général, lorsque l’étape déterminante de la vitesse (plus lente) est la première étape du mécanisme réactionnel, la loi de vitesse de la réaction globale est la même que la loi de vitesse de cette étape. Cependant, lorsque l’étape déterminante de la vitesse est précédée d’une étape élémentaire impliquant une réaction rapidement réversible, la loi de vitesse de la réaction globale peut être plus difficile à déduire, souvent en raison de la présence d’intermédiaires réactionnels.
Dans de tels cas, on peut utiliser le concept selon lequel une réaction réversible est à l’équilibre lorsque les vitesses des processus direct et inverse sont égales.
Prenons, par exemple, la réaction élémentaire réversible dans laquelle NO se dimérise pour produire une espèce intermédiaire N2O2. Lorsque cette réaction est à l’équilibre :
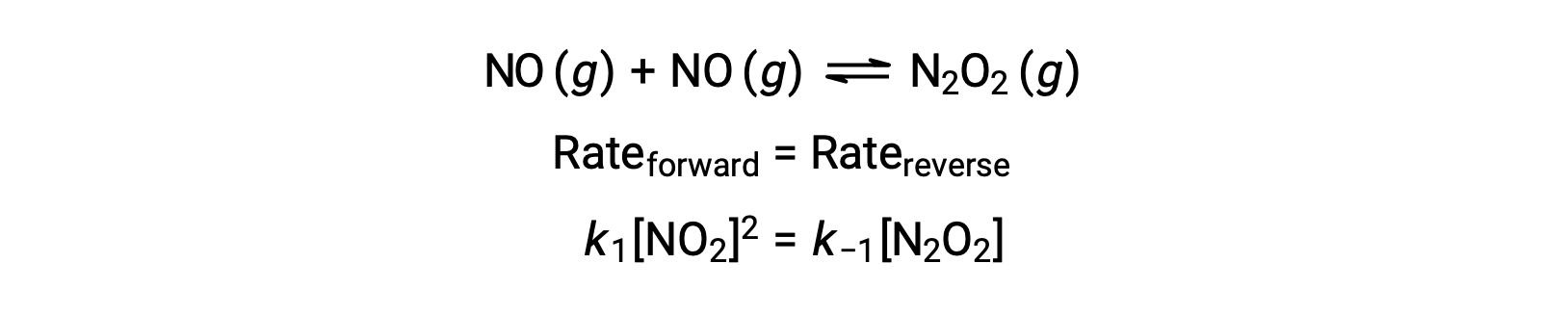
Cette expression peut être réorganisée pour exprimer la concentration de l’intermédiaire en termes du réactif NO :
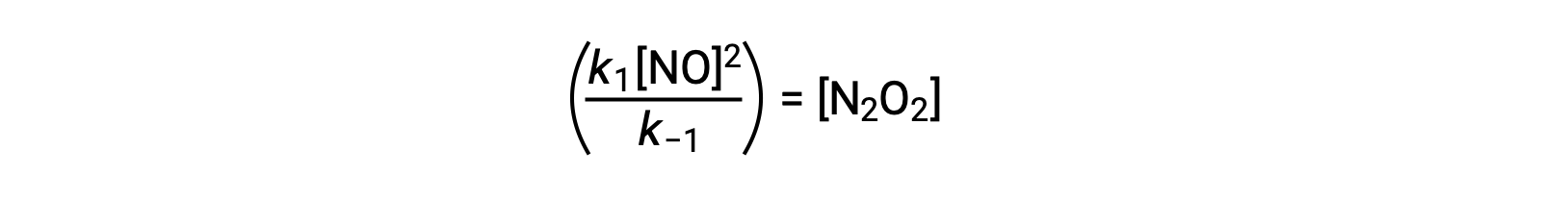
Cette approche peut être utilisée dans la formulation des lois de vitesse pour les réactions globales lorsque des intermédiaires réactionnels sont présents.
Exemple de déduction d’une loi de vitesse à partir d’un mécanisme réactionnel
Considérons une réaction entre le monoxyde d’azote et le chlore moléculaire, pour laquelle un mécanisme en deux étapes est proposé comme indiqué :
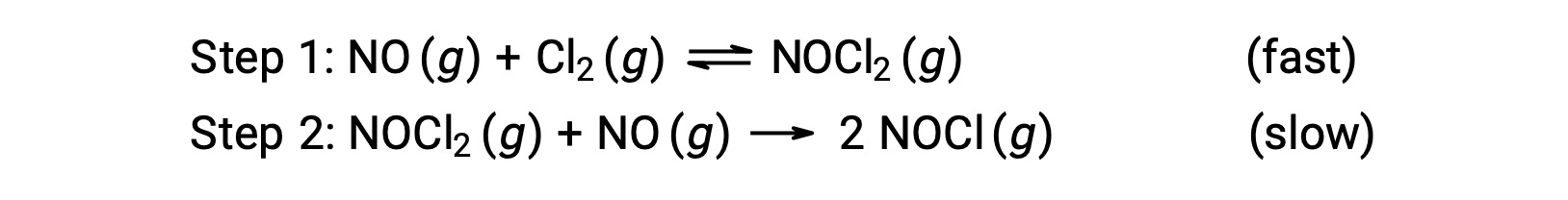
Ce mécanisme peut être utilisé pour déduire l’équation et prédire la loi de vitesse pour la réaction globale. Au départ, en additionnant les deux réactions élémentaires, on obtient l’équation de la réaction globale.
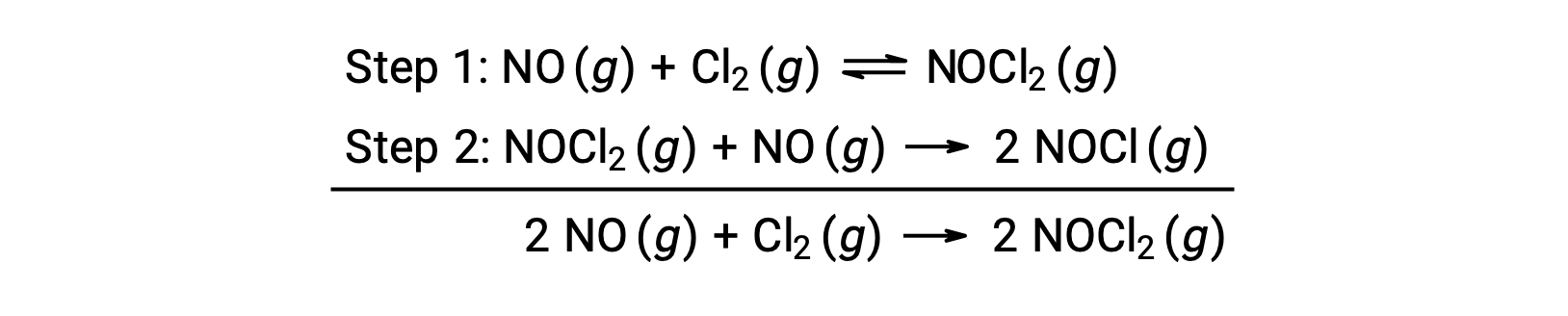
Pour déduire une loi de vitesse à partir de ce mécanisme, les lois de vitesses pour chacune des deux étapes élémentaires sont écrites :
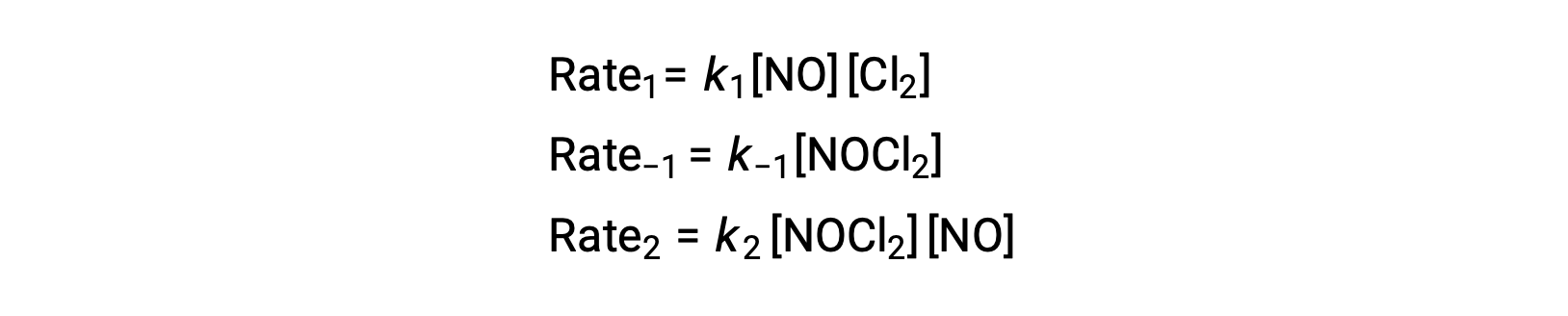
Selon le mécanisme réactionnel proposé, l’étape 2 est l’étape déterminante de la vitesse. Par conséquent, la loi de vitesse de la réaction globale devrait être la même que la loi de vitesse pour cette étape élémentaire. Cependant, la loi de vitesse de l’étape 2 contient une concentration d’espèces intermédiaires, [NOCl2]. Pour modifier cela, la loi de vitesse de la première étape élémentaire est utilisée pour déduire une expression de la concentration intermédiaire en termes de concentrations de réactifs.
En supposant que l’étape 1 est à l’équilibre ;
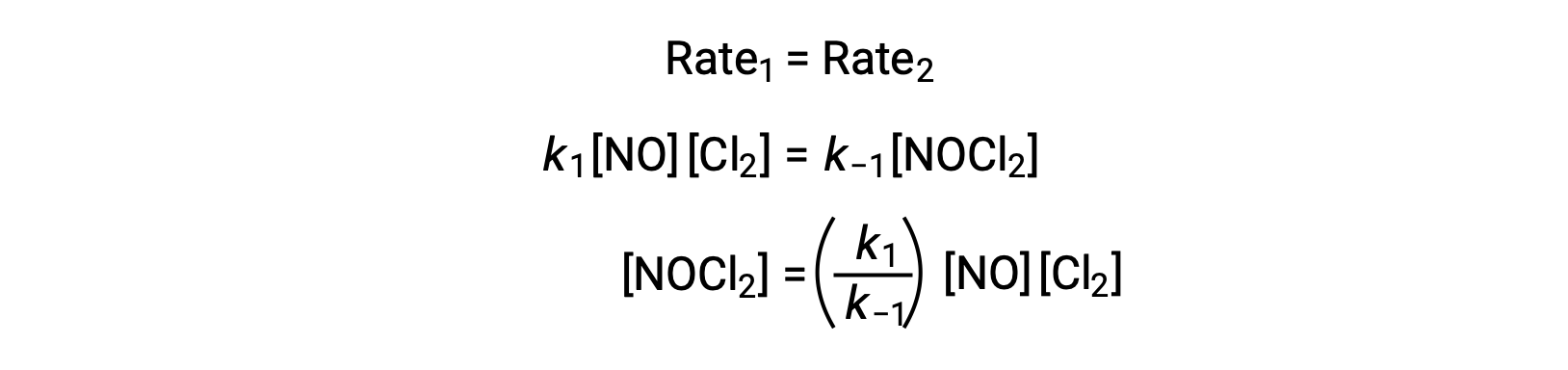
La substitution de cette expression dans la loi de vitesse pour l’étape 2 donne :
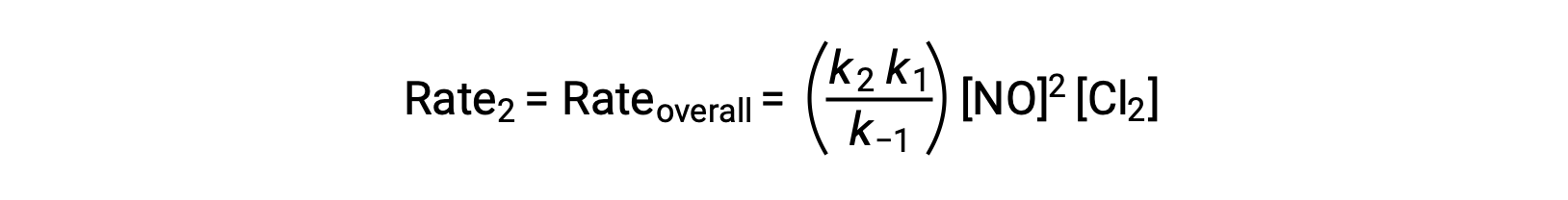
Ce texte est adapté de Openstax, Chimie 2e, Section 12.6 : Mécanismes de réaction.
