13.10:
Шаги, определяющие скорость
13.10:
Шаги, определяющие скорость
Связанные механизмы реакции
В многошаговом механизме реакции один из элементарных шагов продвигается значительно медленнее, чем другие. Этот самый медленный шаг называется шагом ограничения скорости (или шагом определения скорости). Реакция не может быть более быстрой, чем ее самый медленный шаг, и, следовательно, шаг определения скорости ограничивает общую скорость реакции.
Концепция шага, определяющего скорость, может быть понятна по аналогии с 4-полосной автомагистраью с коротким узким местом движения, вызвенным закрытием полосы движения. Как и узкое место, влияющее на общую скорость движения транспортных средств, самый медленный элементарный шаг влияет на чистую скорость реакции.
Законы о норме могут быть получены непосредственно из сбалансированных химических уравнений для элементарных реакций. Однако это не относится к большинству химических реакций, где сбалансированные уравнения часто представляют собой общее изменение в химической системе, возникающее в результате многошаговых механизмов реакции. Таким образом, закон о ставке должен определяться на основе экспериментальных данных, а механизм реакции впоследствии должен быть выведен из закона о ставке.
Например, рассмотрим реакцию NО2 и CO:
Экспериментальный закон скорости для этой реакции при температурах выше 225 °C:
Согласно закону о норме, реакция является первой по отношению к NО2 и первой по отношению к ко. Это согласуется с одношаговым биметолеккулярным механизмом, и возможно, что этот механизм реакции действителен для этого химического процесса при высоких температурах.
Однако при температурах ниже 225 °C реакция описывается другим законом о норме, который является вторым по отношению к NО2:
Этот закон о норме не соответствует одношаговному механизму, но он соответствует следующему двухшаговному механизму:
На более медленном этапе определения скорости дается закон скорости, показывающий зависимость второго порядка от концентрации No2, а сумма двух элементарных уравнений дает общую чистую реакцию.
В целом, когда шаг, определяющий скорость (медленнее), является первым шагом в механизме реакции, закон скорости для общей реакции такой же, как закон скорости для этого шага. Однако, когда этапу определения скорости предшествует элементарный шаг, сопряженных с быстро обратимой реакцией, закон о скорости общей реакции может быть более сложным для получения, часто из-за наличия промежуточных средств реакции.
В таких случаях можно использовать концепцию, согласно которой обратимая реакция находится в равновесии, когда скорости процессов переднего и заднего хода равны.
Например, рассмотрим обратимую элементарную реакцию, в которой НЕТ меризов для получения промежуточного вида N2O2. Когда эта реакция находится в равновесии:
Это выражение можно изменить, чтобы выразить концентрацию промежуточного вещества в терминах реагент NO:
Этот подход может быть использован при разработке норм для общих реакций, когда присутствуют промежуточные реакции.
Пример получения закона о ставке из механизма реакции
Рассмотрим реакцию между оксидом азота и молекулярным хлором, для которого предлагается двухступенчатый механизм, как показано на рисунке:
Этот механизм можно использовать для вычисления уравнения и прогнозирования закона ставок для общей реакции. Первоначально, добавив две элементарные реакции, получается уравнение для общей реакции.
Для получения закона о ставках из этого механизма составлены законы о ставках для каждого из двух элементарных шагов:
Согласно предложенному механизму реакции, шаг 2 является этапом определения скорости. Таким образом, закон ставок для общей реакции должен быть таким же, как закон ставок для этого элементарного шага. Тем не менее, закон скорости для шага 2 содержит среднюю концентрацию видов, [NOCl2]. Чтобы изменить это, закон нормы первого элементарного шага используется для получения выражения для средней концентрации в концентрациях реагент.
Предполагая, что этап 1 находится в равновесии;
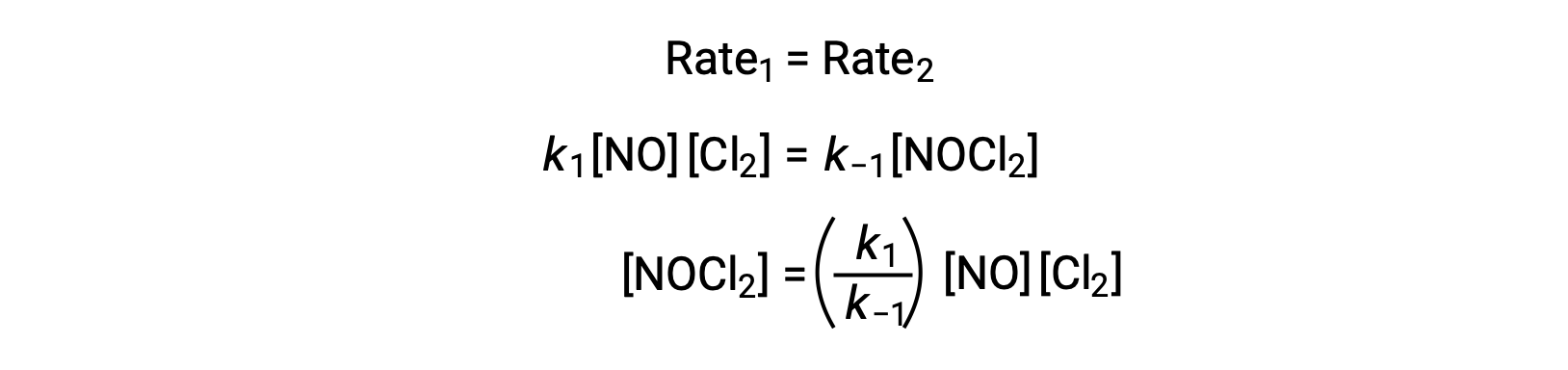
Подстановка этого выражения в закон ставок для шага 2 дает:
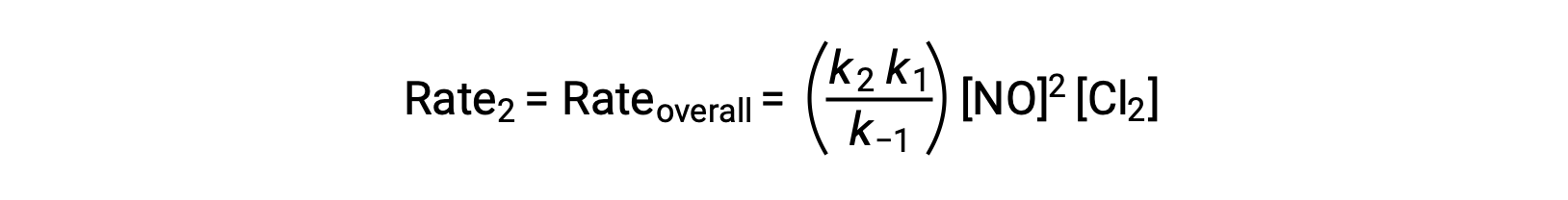
Этот текст адаптирован из Openstax, Химия 2е изд., раздел 12.6: Механизмы реакции.
