13.10:
Fasi di determinazione della velocità
13.10:
Fasi di determinazione della velocità
Meccanismi di reazione relativi
In un meccanismo di reazione multistep, uno dei passaggi elementari progredisce significativamente più lentamente degli altri. Questo passaggio più lento è chiamato passaggio di limitazione della velocità (o passaggio che determina la velocità). Una reazione non può procedere più velocemente del suo passo più lento, e quindi il passo che determina la velocità limita la velocità di reazione complessiva.
Il concetto di gradino di determinazione della velocità può essere compreso dall’analogia di un’autostrada a 4 corsie con un breve tratto di collo di bottiglia del traffico causato dalla chiusura della corsia. Come il collo di bottiglia che influisce sulla velocità complessiva con cui i veicoli potevano viaggiare, il passo elementare più lento influenza la velocità di reazione netta.
Le leggi sui tassi possono essere derivate direttamente dalle equazioni chimiche bilanciate per le reazioni elementari. Tuttavia, questo non è il caso della maggior parte delle reazioni chimiche, dove le equazioni bilanciate spesso rappresentano il cambiamento complessivo nel sistema chimico, derivante da meccanismi di reazione multistep. Pertanto, la legge sui tassi deve essere determinata da dati sperimentali e il meccanismo di reazione successivamente dedotto dalla legge sui tassi.
Ad esempio, si consideri la reazione di NO2 e CO:
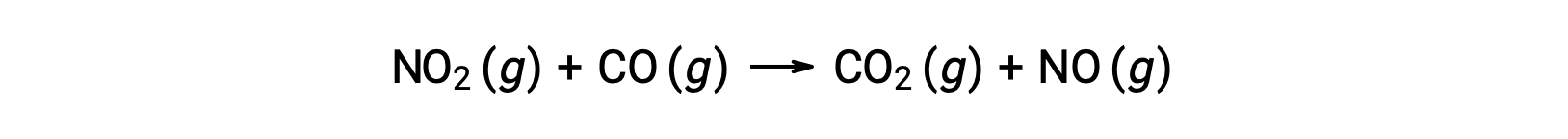
La legge sperimentale sul tasso per questa reazione a temperature superiori a 225 °C è:
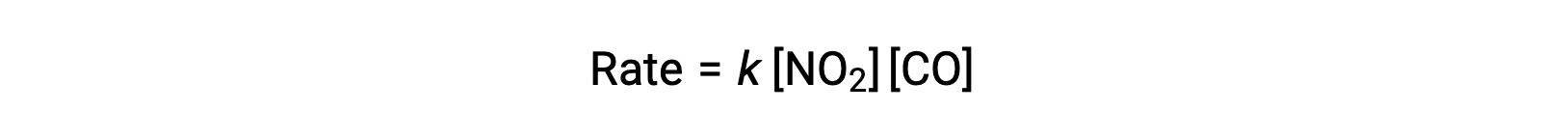
Secondo la legge sui tassi, la reazione è di primo ordine per quanto riguarda IL2 e il primo ordine per quanto riguarda le emissioni di CO. Questo è coerente con un meccanismo bimolecolare a passo singolo, ed è possibile che questo meccanismo di reazione sia valido per questo processo chimico ad alte temperature.
Tuttavia, a temperature inferiori a 225 °C, la reazione è descritta da una diversa legge di tasso che è di secondo ordine rispetto a NO2:
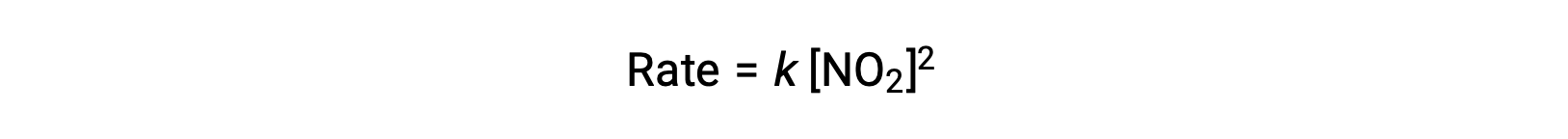
Questa legge sui tassi non è coerente con il meccanismo in un’unica fase, ma è coerente con il seguente meccanismo in due passaggi:
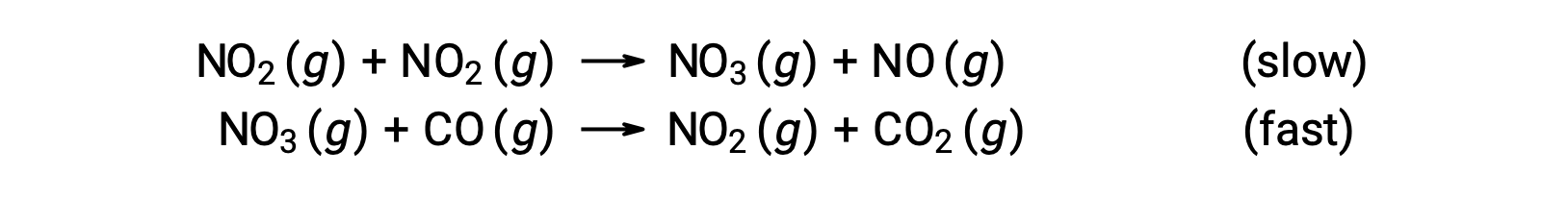
Il passo che determina il tasso (più lento) dà una legge dei tassi che mostra la dipendenza del secondo ordine dalla concentrazione di NO2, e la somma delle due equazioni elementari dà la reazione netta complessiva.
In generale, quando il passaggio di determinazione del tasso (più lento) è il primo passo nel meccanismo di reazione, la legge del tasso per la reazione complessiva è la stessa della legge sui tassi per questo passaggio. Tuttavia, quando il passo che determina la velocità è preceduto da un passo elementare che comporta una reazione rapidamente reversibile, la legge del tasso per la reazione complessiva può essere più difficile da ricavare, spesso a causa della presenza di intermedi di reazione.
In questi casi, il concetto che una reazione reversibile è all’equilibrio quando i tassi dei processi avanti e indietro sono uguali può essere utilizzato.
Si consideri, ad esempio, la reazione elementare reversibile in cui il NO si dimerizza per produrre una specie intermedia N2O2. Quando questa reazione è in equilibrio:
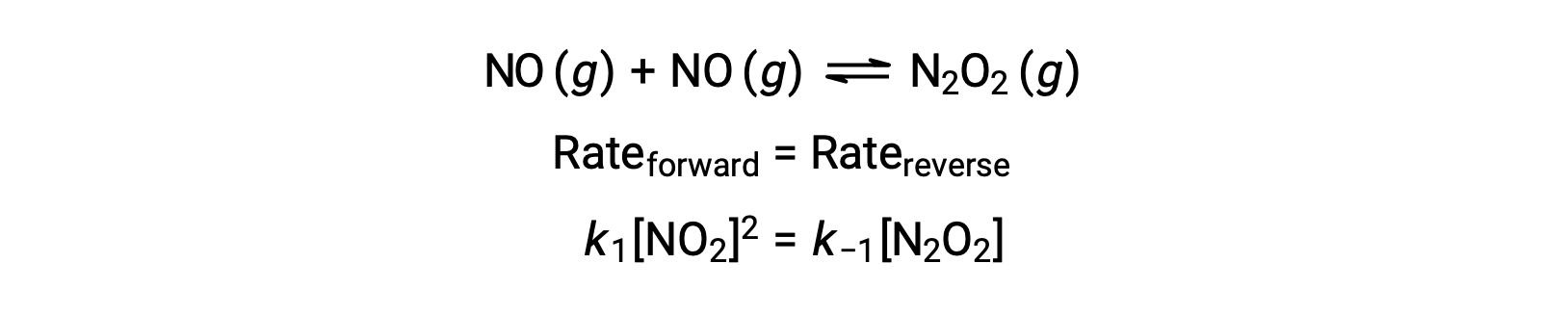
Questa espressione può essere riorganizzata per esprimere la concentrazione dell’intermedio in termini di NO reagente:
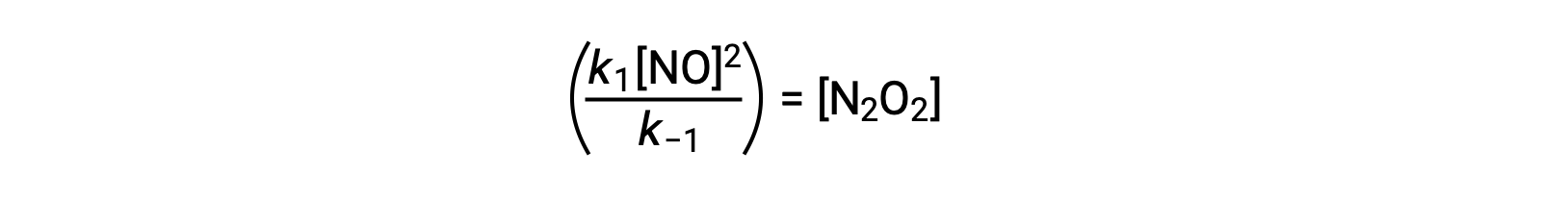
Questo approccio può essere utilizzato nella formulazione di leggi sui tassi per reazioni generali quando sono presenti intermedi di reazione.
Esempio di derivazione della legge sul tasso da un meccanismo di reazione
Si consideri una reazione tra monossido di azoto e cloro molecolare, per la quale viene proposto un meccanismo in due fase come mostrato:
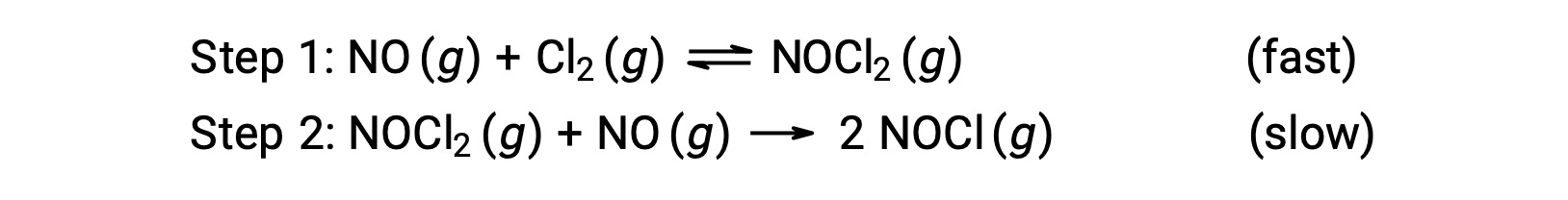
Questo meccanismo può essere usato per derivare l’equazione e prevedere la legge dei tassi per la reazione complessiva. Inizialmente, aggiungendo le due reazioni elementari, si ottiene l’equazione per la reazione complessiva.
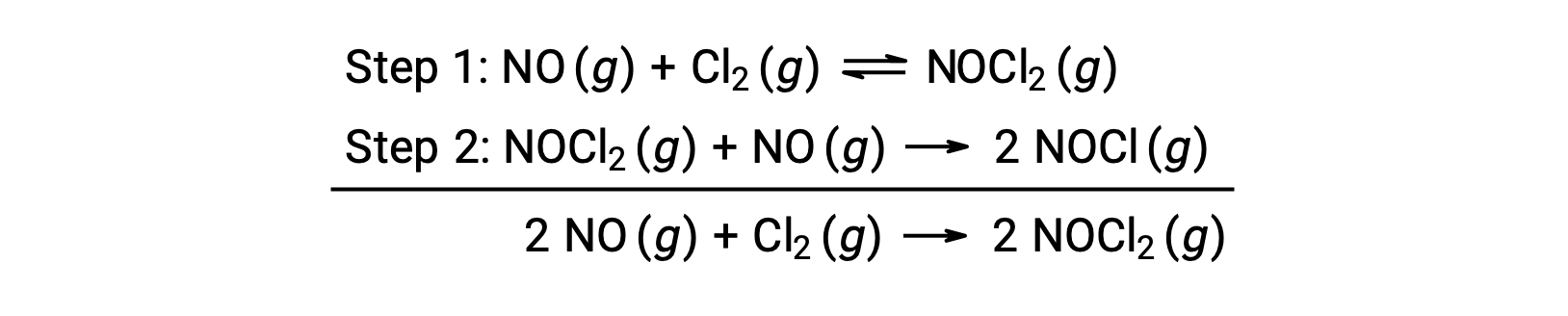
Per ricavare una legge sui tassi da questo meccanismo, le leggi sui tassi per ciascuno dei due passaggi elementari sono scritte:
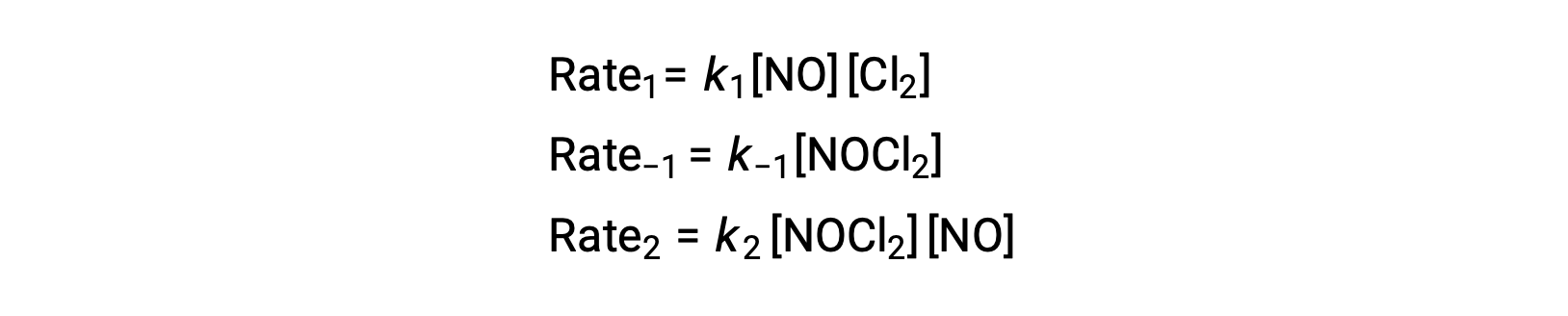
Secondo il meccanismo di reazione proposto, la fase 2 è la fase di determinazione della velocità. Pertanto, la legge sui tassi per la reazione complessiva dovrebbe essere la stessa della legge sui tassi per questo passaggio elementare. Tuttavia, la legge sui tassi per la fase 2 contiene una concentrazione intermedia di specie[NOCl2]. Per modificare questo, la legge dei tassi del primo passo elementare viene utilizzata per ricavare un’espressione per la concentrazione intermedia in termini di concentrazioni reagenti.
Supponendo che il passaggio 1 sia all’equilibrio;
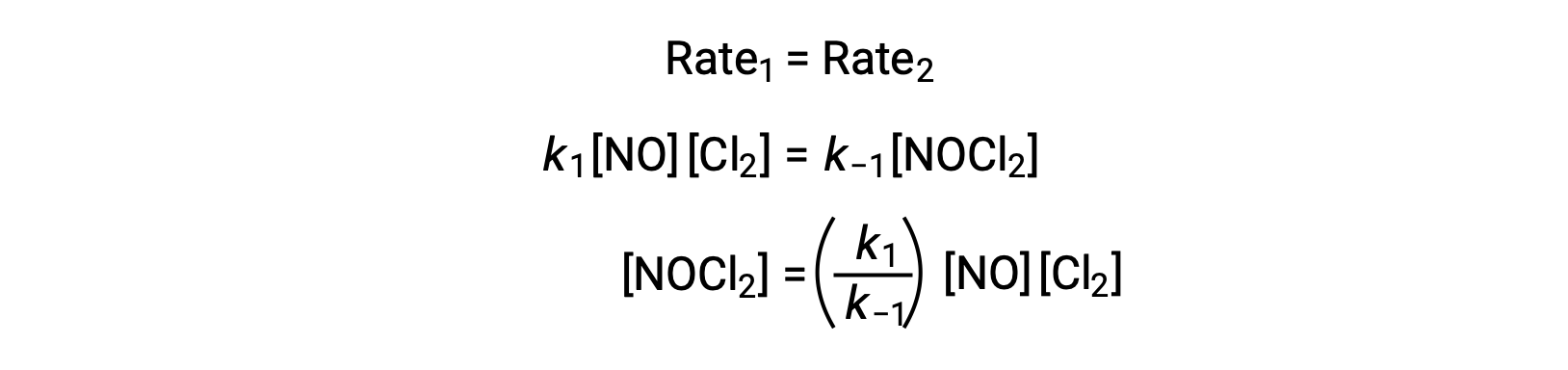
Sostituendo questa espressione nella legge sui tassi con i rendimenti della fase 2:
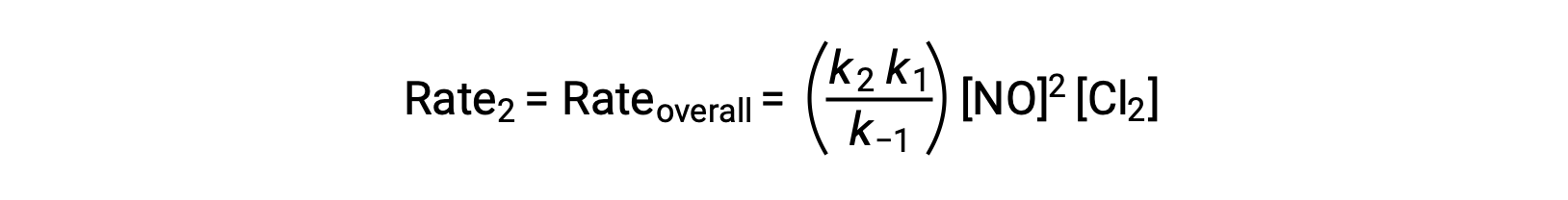
Questo testo è adattato da Openstax, Chemistry 2e, Section 12.6: Reaction Mechanisms.
