13.10:
خطوات تحديد المعدّل
13.10:
خطوات تحديد المعدّل
العلاقة بين آليات التفاعل
في آلية التفاعل متعددة الخطوات، تتقدم إحدى الخطوات الأولية بشكل أبطأ بكثير من الخطوات الأخرى. هذه الخطوة الأبطأ تسمى خطوة تحديد المعدل (أو خطوة تحديد المعدل). لا يمكن أن يستمر التفاعل أسرع من أبطأ خطواته، وبالتالي، فإن خطوة تحديد المعدل تحدّ من معدل التفاعل الإجمالي.
يمكن فهم مفهوم خطوة تحديد المعدل من تشبيه طريق سريع مكون من 4 مسارات مع امتداد قصير لاختناق حركة المرور بسبب إغلاق الممر. مثلما يؤثر هذا الاختناق على المعدل الإجمالي الذي يمكن أن تسير به المركبات، فإن أبطأ خطوة أساسية تؤثر على معدل التفاعل الإجمالي.
يمكن اشتقاق قوانين المعدل مباشرة من المعادلات الكيميائية المتوازنة للتفاعلات الأولية. ومع ذلك، ليس هذا هو الحال بالنسبة لمعظم التفاعلات الكيميائية، حيث تمثل المعادلات المتوازنة غالباً التغيير العام في النظام الكيميائي، الناتج عن آليات التفاعل متعددة الخطوات. لذلك، يجب تحديد قانون المعدل من البيانات التجريبية، واستنتاج آلية التفاعل لاحقاً من قانون المعدل.
على سبيل المثال، ضع في اعتبارك تفاعل NO2 and CO:
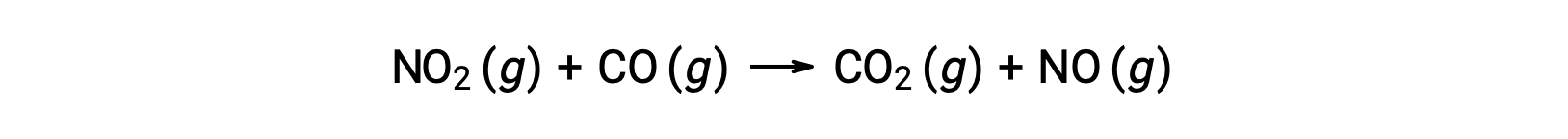
قانون المعدل التجريبي لهذا التفاعل عند درجات حرارة أعلى من 225 °C هو:
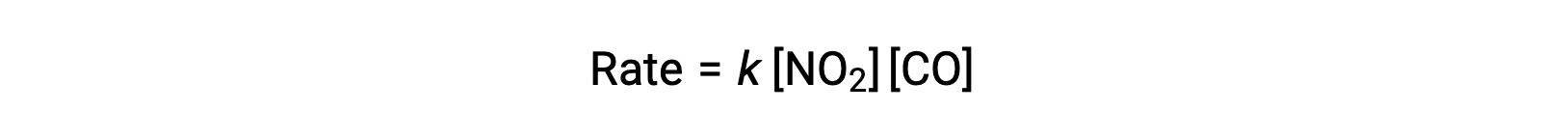
وفقاً لقانون المعدل، يكون التفاعل من الدرجة الأولى فيما يتعلق بـ NO2 ومن الدرجة الأولى فيما يتعلق بـ CO. يتوافق هذا مع آلية ثنائية الجزيئات أحادية الخطوة، ومن الممكن أن آلية التفاعل هذه صالحة لهذه العملية الكيميائية عند درجات حرارة عالية.
مع ذلك، عند درجات حرارة أقل من 225 °C, يتم وصف التفاعل بواسطة قانون معدل مختلف يكون من الدرجة الثانية فيما يتعلق بـ NO2:
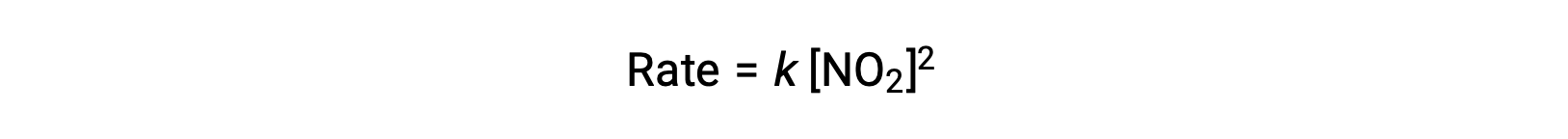
لا يتوافق قانون المعدل هذا مع آلية الخطوة الواحدة، ولكنه يتوافق مع الآلية التالية المكونة من خطوتين:
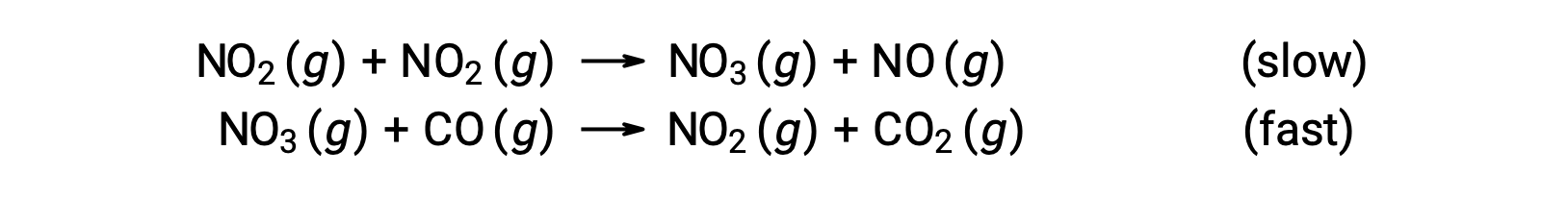
تعطي خطوة تحديد المعدل (الأبطأ) قانون معدل يوضح الاعتماد من الدرجة الثانية على تركيز NO2، ويعطي مجموع المعادلتين الأوليتين صافي التفاعل الإجمالي.
بشكل عام، عندما تكون خطوة تحديد المعدل (أبطأ) هي الخطوة الأولى في آلية التفاعل، فإن قانون المعدل للتفاعل الكلي هو نفسه قانون المعدل لهذه الخطوة. ومع ذلك، عندما تكون خطوة تحديد المعدل مسبوقة بخطوة أولية تتضمن تفاعل سريع الانعكاس، فقد يكون اشتقاق قانون معدل التفاعل الكلي أكثر صعوبة، غالباً بسبب وجود مواد وسيطة للتفاعل.
في مثل هذه الحالات، يمكن استخدام المفهوم الذي يعتبر أن التفاعل القابل للعكس يكون في حالة توازن عندما تكون معدلات العمليات الأمامية والعكسية متساوية.
على سبيل المثال، ضع في اعتبارك التفاعل الأولي القابل للانعكاس حيث يتضاءل أكسيد النيتروجين لإنتاج نوع وسيطN2O2. عندما يكون هذا التفاعل في حالة توازن:
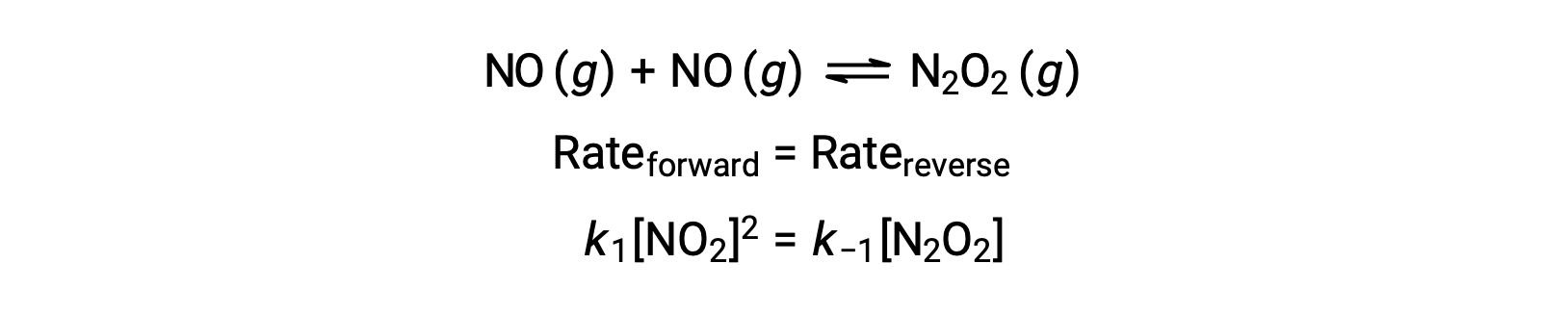
يمكن إعادة ترتيب هذا التعبير لوصف تركيز الوسيط بدلالة المتفاعل NO :
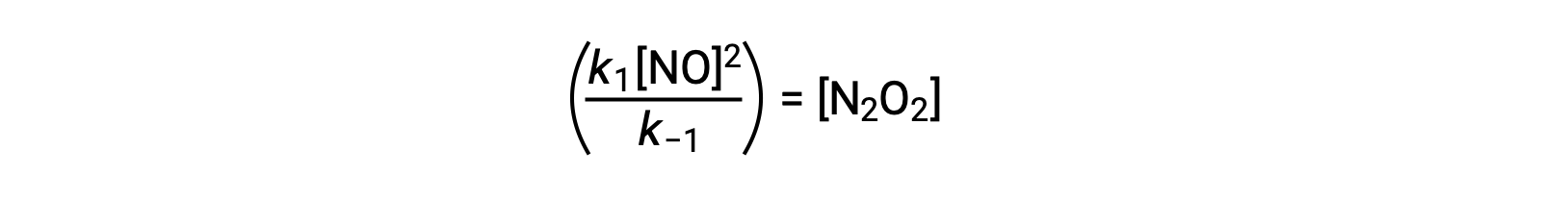
يمكن استخدام هذا الأسلوب في صياغة قوانين المعدل للتفاعلات الكلية عند وجود وسيط للتفاعل.
مثال على اشتقاق قانون الأسعار من آلية رد فعل
ضع في اعتبارك تفاعلاً بين أول أكسيد النيتروجين والكلور الجزيئي، حيث يتم اقتراح آلية من خطوتين كما هو موضح:
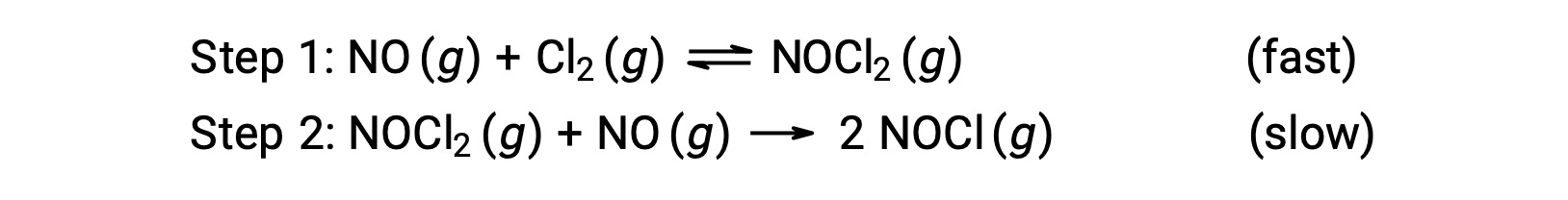
يمكن استخدام هذه الآلية لاشتقاق المعادلة والتنبؤ بقانون معدل التفاعل الكلي. في البداية، بإضافة التفاعلين الأوليين، يتم الحصول على معادلة التفاعل الكلي.
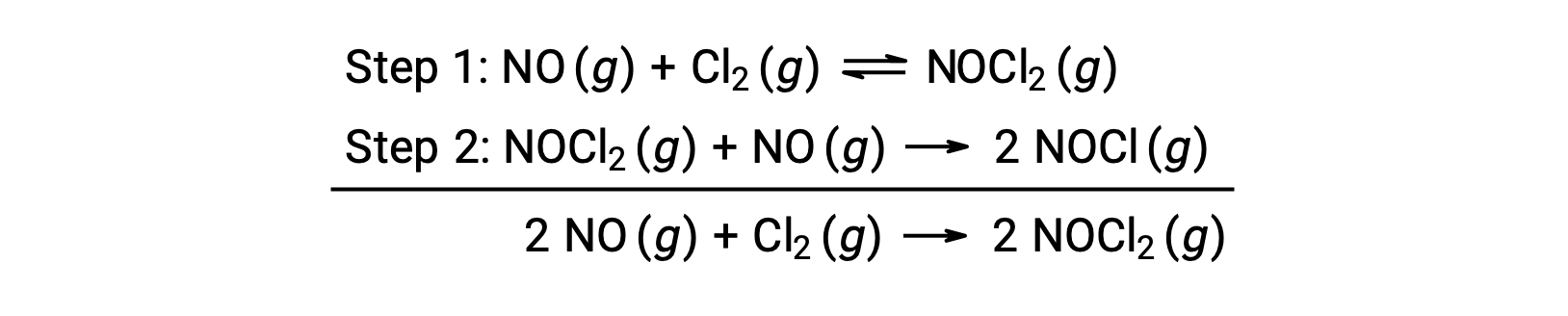
لاشتقاق قانون معدل من هذه الآلية، تتم كتابة قوانين المعدّلات لكل من الخطوتين الأوّليتين:
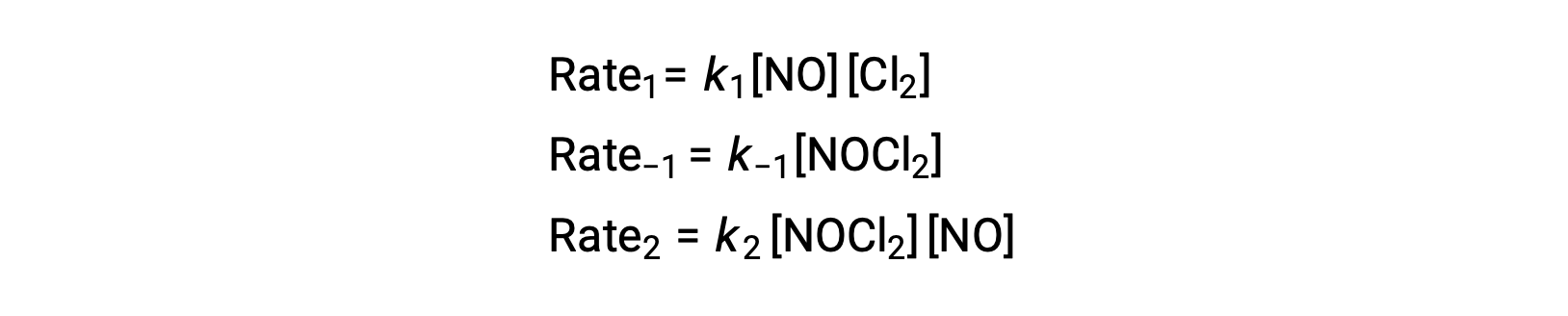
وفقاً لآلية التفاعل المقترحة، فإن الخطوة 2 هي خطوة تحديد المعدّل. ومن ثم، يجب أن يكون قانون المعدّل للتفاعل الكلي هو نفسه قانون المعدل لهذه الخطوة الأوّلية. ومع ذلك، فإن قانون المعدّل للخطوة 2 يحتوي على تركيز متوسط للأنواع، [NOCl2]. لتعديل هذا، يتم استخدام قانون المعدل لأول خطوة ابتدائية لاشتقاق تعبير للتركيز الوسيط من حيث تركيزات المادة المتفاعلة.
بافتراض أن الخطوة 1 هي في حالة توازن ؛
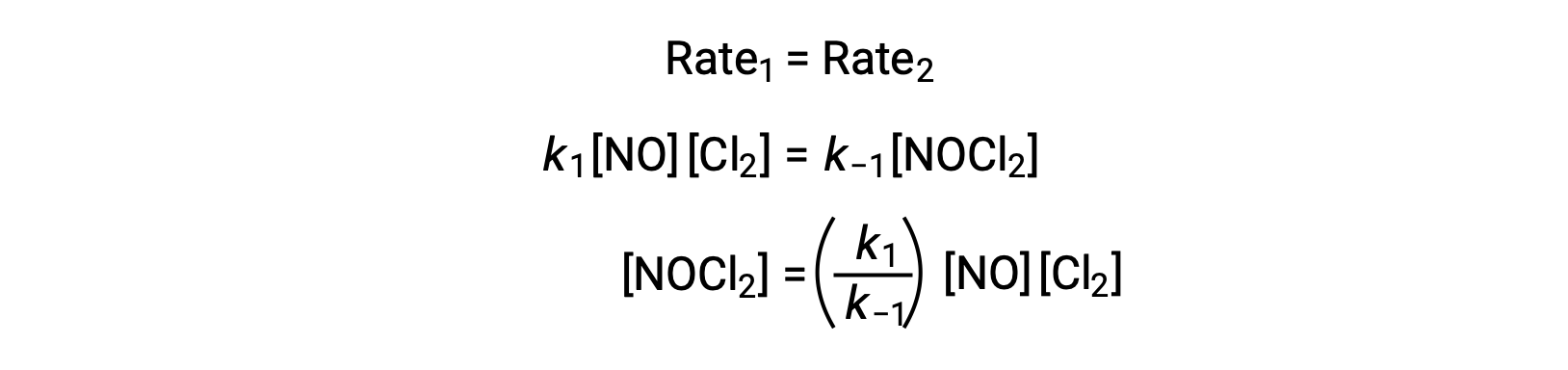
ينتج عن استبدال هذا التعبير في قانون المعدل للخطوة 2:
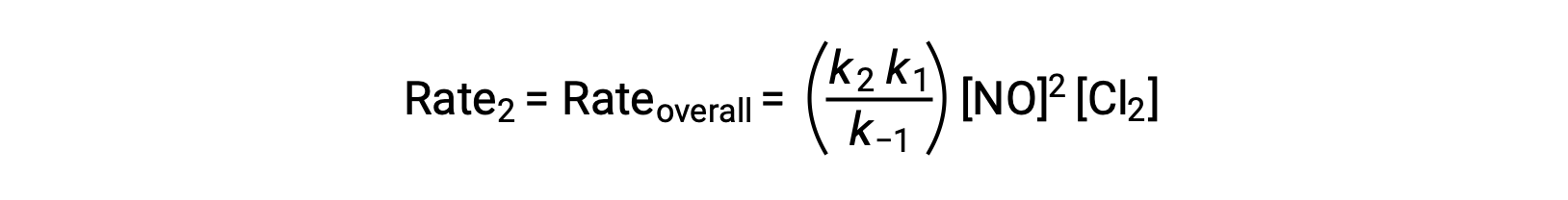
تم اقتباس هذا النص من Openstax, Chemistry 2e, Section 12.6: Reaction Mechanisms.
