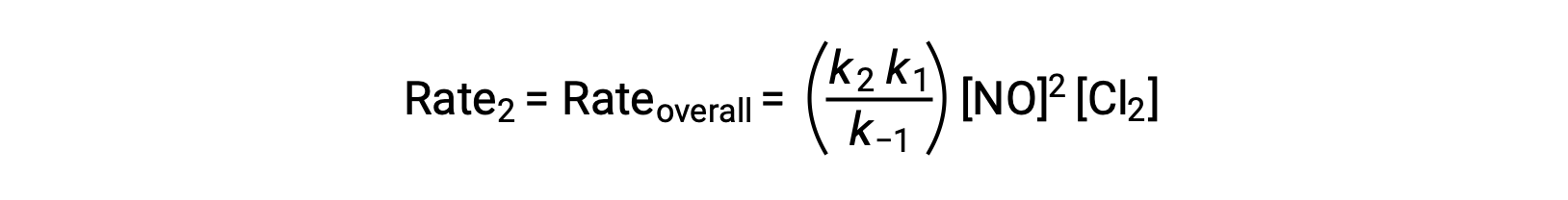13.10:
速率确定步骤
13.10:
速率确定步骤
与反应机理相关
在多步反应机理中,其中一个基本步骤的执行速度比其他步骤慢得多。 此最慢步骤称为速率限制步骤 (或速率确定步骤)。 反应的速度不能超过其最慢的步骤,因此,速率确定步骤限制了整体反应率值。
速率确定步骤的概念可以从 4 车道高速公路与车道关闭造成的短暂交通瓶颈的类比中理解。 与影响车辆行驶的整个率值的瓶颈一样,最慢的基本步骤也会影响净反作用力率值。
速率定律可以直接从平衡的化学方程中获得基本反应。 但是,大多数化学反应的情况并非如此,其中平衡方程式通常代表化学系统的整体变化,这是由多步反应机理引起的。 因此,必须根据实验数据确定速率定律,随后,反应机理从速率定律中推断出来。
例如,考虑 NO2 和 CO 的反应:
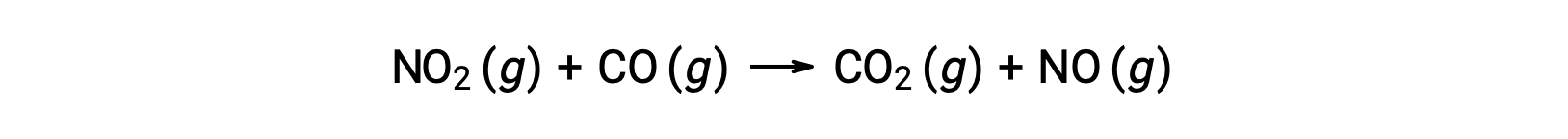
在温度高于 225 °C 时,该反应的实验速率定律为:
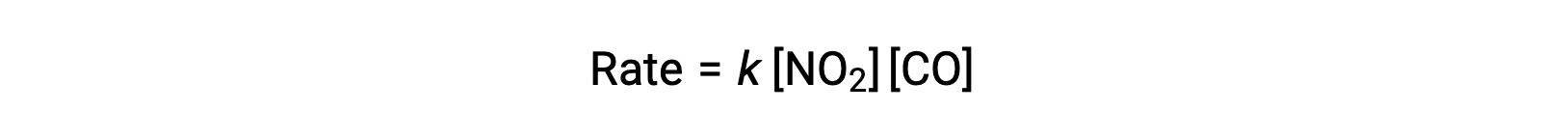
据速率定律称,反应是 NO2 的第一级反应,是对 CO 的第一级反应,这与单步双分子的机理一致,并且该反应机理可能在高温下对该化学过程有效。
但是,在温度低于 225 °C 的情况下,反应由另一个速率定律描述,该 是 NO2 的第二次序:
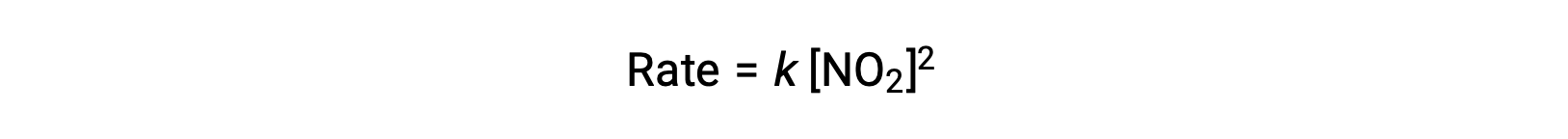
此速率定律与单步机理不一致,但与以下两步机理一致:
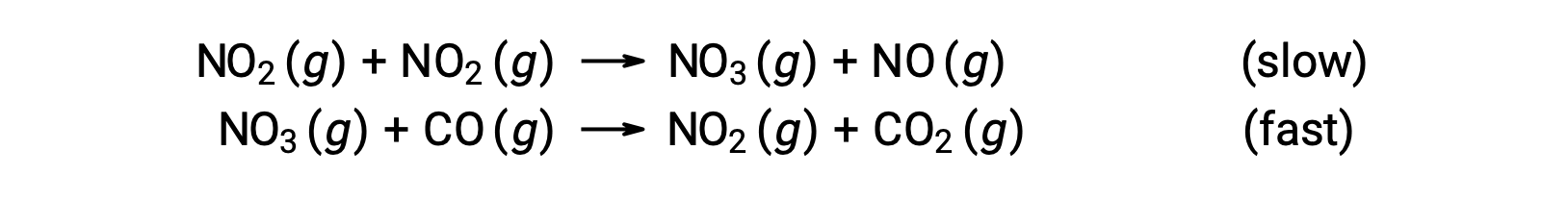
速率确定 (较慢) 步骤给出了一个速率定律,显示了对 NO2 浓度的二次序依赖,两个基本方程式的总和给出了总体净反应。
通常,当速率确定 (较慢) 步骤是反应机理的第一步时,整体反应的速率定律与此步骤的速率定律相同。 然而,当速率确定步骤之前有一个涉及快速可逆反应的基本步骤时,通常由于存在反应中间体,因此总体反应的速率定律可能更难推导。
在这种情况下,可以采用一种概念,即当正向和反向过程的速率相等时,可反向反应是平衡的。
例如,考虑不会对产率中间物种 N2O2 进行二聚物化的可反转基本反应。 当这种反应处于平衡状态时:
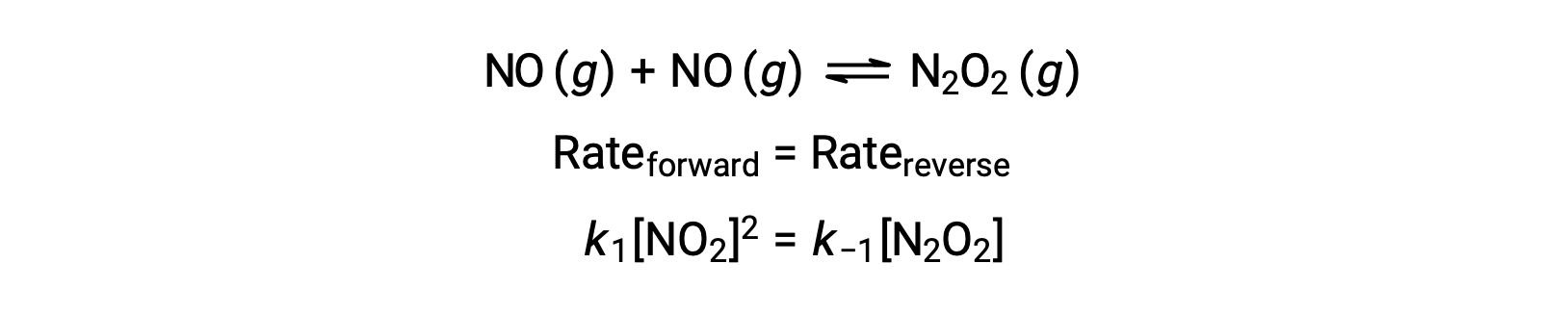
可以重新排列此表达式,以反应物 no 表示中间体的浓度:
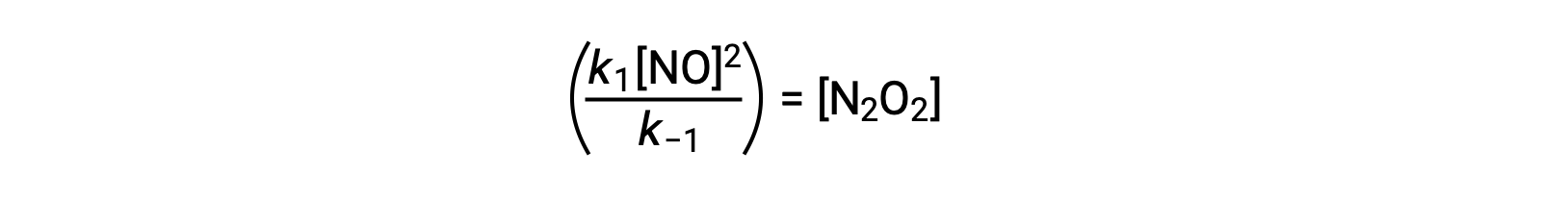
当存在反应中间体时,可以使用这种方法来为整体反应制定速率定律。
从反应机理派生速率定律的示例
考虑一氧化氮和分子氯之间的反应,建议使用两步机理,如下所示:
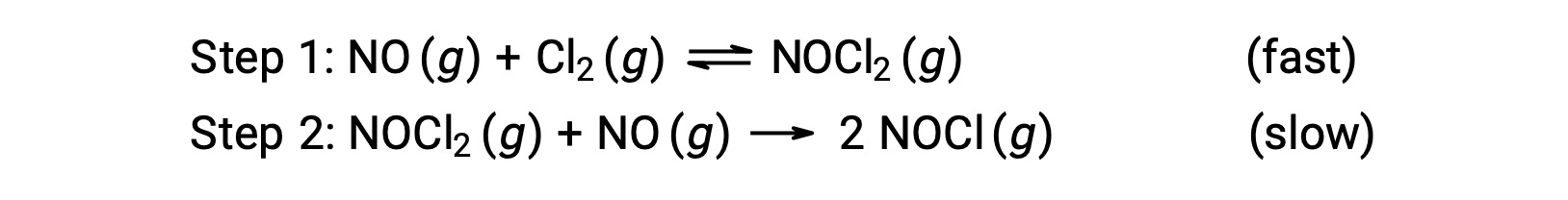
此机理可用于派生方程并预测总体反应的速率定律。 最初,通过添加两个基本反应,获得了总体反应的方程。
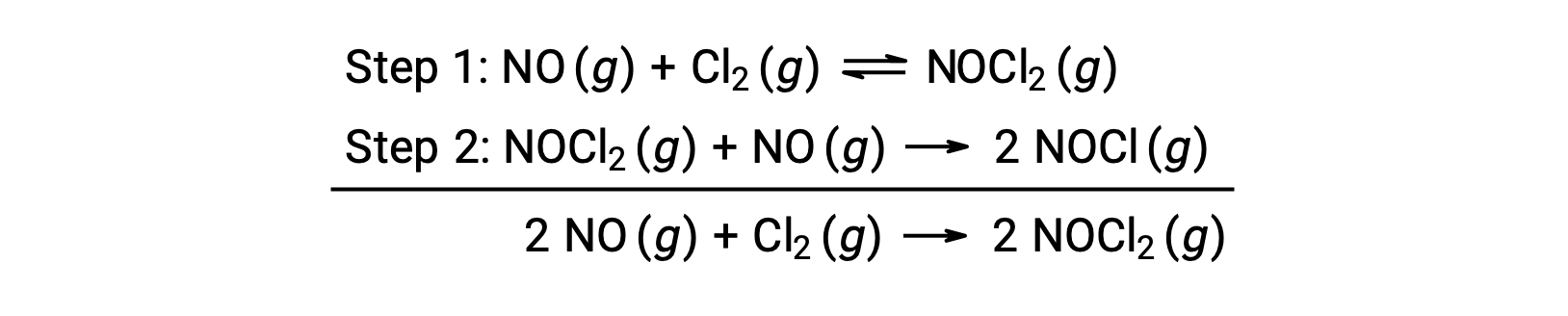
要从该机理中获取速率定律,请编写两个基本步骤中每一个步骤的费率法:
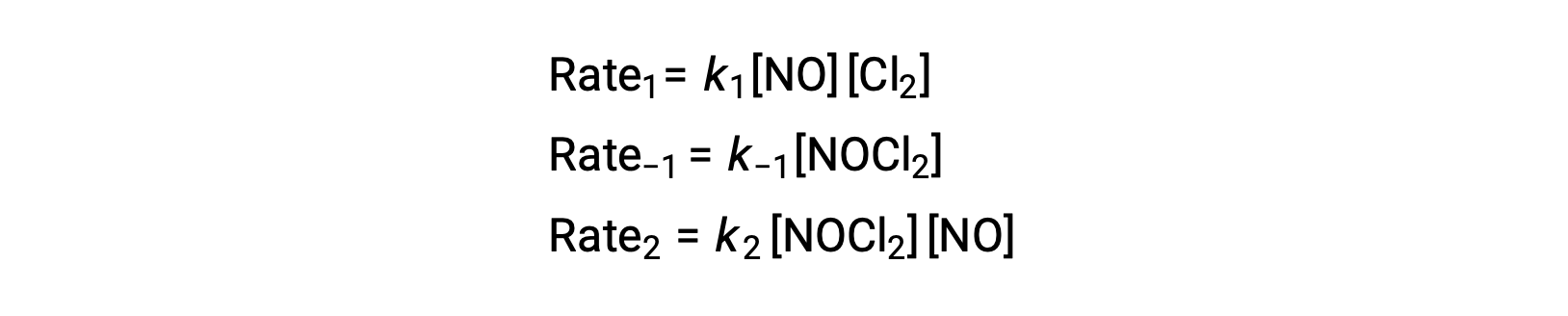
根据提议的反应机理第 2 步是确定利率的步骤。 因此,整体反应的速率定律应该与这一基本步骤的速率定律相同。 但是,步骤 2 的速率定律包含一个中间物种浓度 [NOCl2]。 要修改此值,第一个基本步骤的速率定律用于从反应物浓度的角度为中间浓度派生表达式。
假设步骤 1 处于平衡状态;
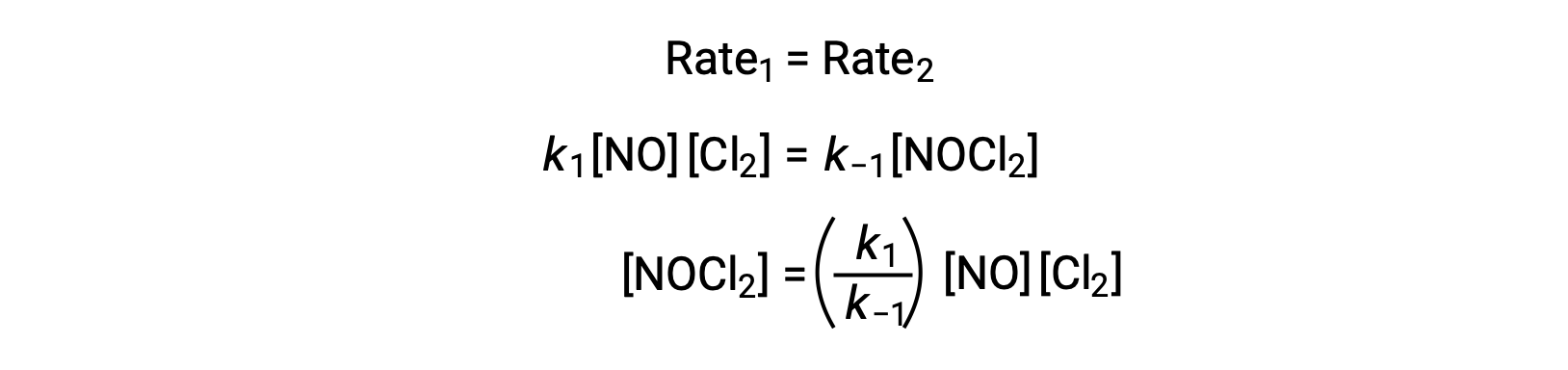
将该表达式代入速率定律第2部得出: