16.1:
공통이온효과
16.1:
공통이온효과
순수한 물과 비교하여, 이온 화합물의 용해도는 일반적인 이온을 포함하는 수성 용액에서 적다(또한 이온 화합물의 용해에 의해 생성되는 것). 이것은 르 샤텔리에의 원리를 사용하여 설명 될 수있는 대량 행동의 법칙의 결과입니다 일반적인 이온 효과로 알려진 현상의 예입니다. 실버 요오드의 용해를 고려하십시오.
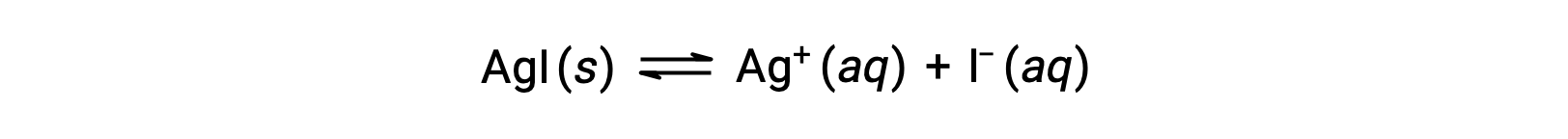
이러한 용해도 평형은 은(I) 또는 요오드 이온의 첨가에 의해 왼쪽으로 이동하여 AgI의 침전과 용존 Ag+및 I의농도를 낮출 수 있다. 이미 이러한 이온 중 하나를 포함하는 솔루션에서 AgI는 이러한 이온이없는 용액보다 용해 될 수 있습니다.
이 효과는 용해도 제품 표현식에 표시되는 질량 작용 측면에서도 설명될 수 있습니다.
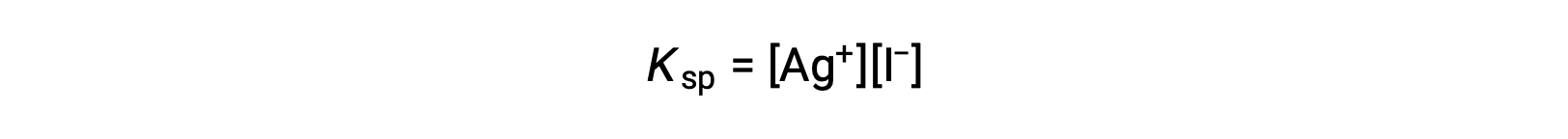
은(I)과 요오드 이온 어어니언의 수학적 제품은 이온의 공급원에 관계없이평형 혼합물에서 일정하므로 한 이온의 농도의 증가는 다른 쪽의 비례감소에 의해 균형을 이루어야 한다.
용해도에 대한 일반적인 이온 효과
일반적인 이온은 용액에서 화합물의 용해도에 영향을 미칩니다. 예를 들어, 고체 Mg (OH)2 Mg으로 해리2+ 및 OH– 이온은 다음과 같이;
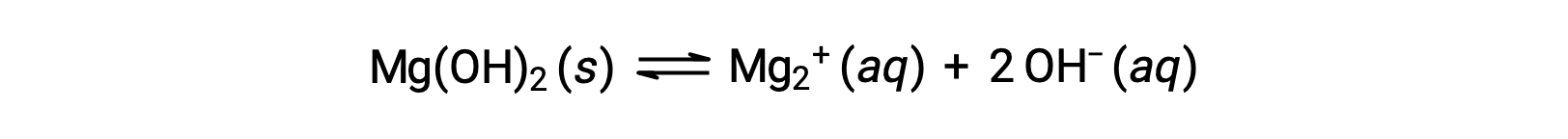
MgCl2가 Mg(OH)2의포화 용액에 첨가되면, 반응은 Le Châtelier의 원칙에 따라 추가 Mg2+ 이온에 의해 생성된 응력을 완화하기 위해 왼쪽으로 이동한다. 정량적 측면에서, 추가된Mg2+는 반응 지수가 용해도제품(Q> Ksp)및 Mg(OH)2 형태보다 더 큰 것으로 반응 지수가 다시 Ksp와 같을 때까지발생시킨다. 새로운 평형에서 [OH–]덜 [Mg2+]순수한 물에 Mg (OH)2의 용액보다 큽니다.
KOH가 Mg(OH)2의포화 용액에 첨가되면, 반응은 추가 OH –이온의 스트레스를 완화하기 위해 왼쪽으로 이동한다. Mg(OH)2는 반응 지수가 다시 KSp와 같을 때까지형성한다. 새로운 평형에서 [OH–] 더 크고 [Mg2+]순수한 물에 있는 Mg(OH)2의 용액보다 적습니다.
