11.21:
El Centrado de Celosía y el Número de Coordinación
11.21:
El Centrado de Celosía y el Número de Coordinación
La estructura de un sólido cristalino, sea o no un metal, se describe mejor considerando su unidad repetitiva más simple, que se conoce como su celda unitaria. La celda unitaria consiste en puntos de celosía que representan las ubicaciones de los átomos o iones. La estructura completa consiste entonces en esta celda unitaria que se repite en tres dimensiones. Los tres tipos diferentes de celdas unitarias presentes en la celosía cúbica se ilustran en la Figura 1.
Tipos de celdas unitarias
Imagine tomar un gran número de esferas idénticas y organizarlas uniformemente en un recipiente de tal manera que una capa esté directamente encima de las esferas en la capa de abajo. Esta disposición se llama una estructura cúbica simple, y la celda unitaria se llama celda unitaria cúbica simple o celda unitaria cúbica primitiva. En una estructura cúbica simple, las esferas no están tan cerca como podrían, y sólo “llenan” alrededor del 52% del volumen del contenedor.
Un átomo en este tipo de arreglo sólo entra en contacto con los cuatro vecinos más cercanos en su capa; con un átomo directamente encima de él en la capa superior; y con un átomo directamente debajo de él en la capa inferior. El número de partículas adicionales con las que cada partícula entra en contacto en un sólido cristalino se conoce como su número de coordinación. Para un átomo de polonio en una matriz cúbica simple, el número de coordinación es, por lo tanto, seis.
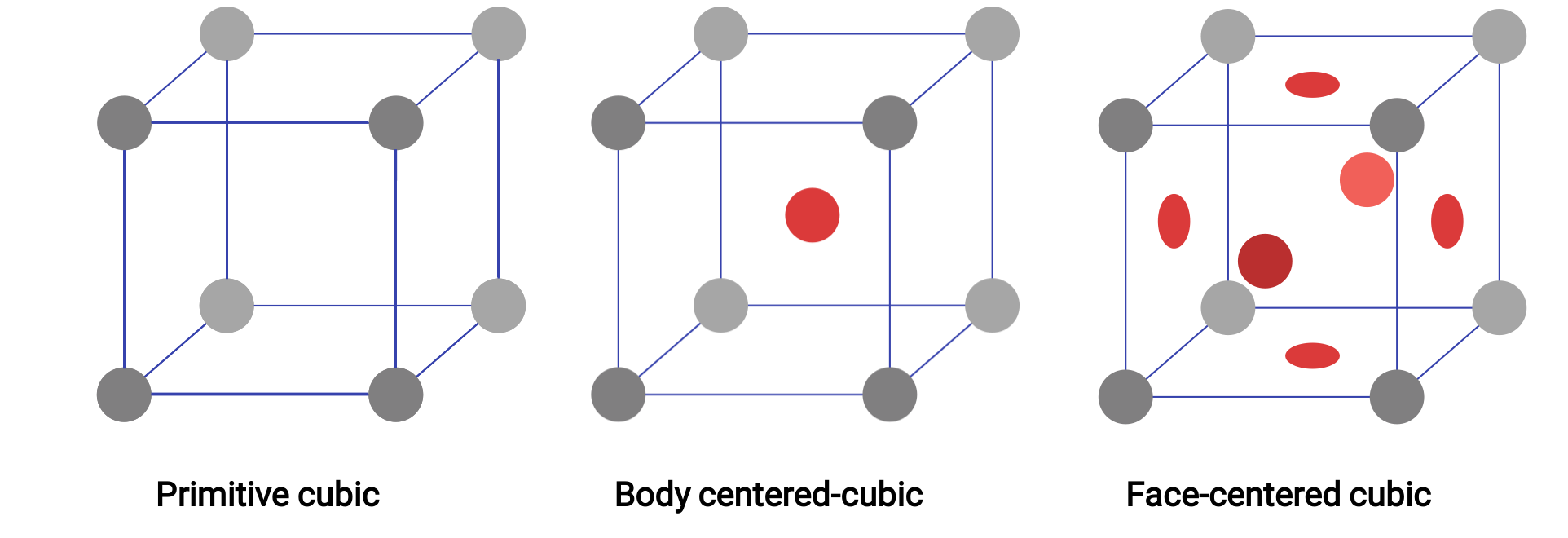
Figura 1.Tres estructuras diferentes de celosía cristalina diferentes expuestas por los sistemas de celosía cúbica.
En una celosía cúbica primitiva, la celda unitaria que se repite en todas las direcciones es un cubo definido por los centros de ocho átomos. Los átomos en las esquinas adyacentes de esta celda unitaria entran en contacto entre sí, por lo que una celda unitaria cúbica contiene sólo las partes de estos átomos que están dentro de ella. Dado que un átomo en una esquina de una celda unitaria cúbica simple está contenido por un total de ocho celdas unitarias, sólo un octavo de ese átomo está dentro de una celda unitaria específica. Y puesto que cada celda unitaria cúbica simple tiene un átomo en cada una de sus ocho “esquinas”, hay 8 × 1/8 = 1 átomo dentro de una celda unitaria cúbica simple.
Algunos metales cristalizan en un arreglo que tiene una celda unitaria cúbica con átomos en todas las esquinas y un átomo en el centro. Esto se denomina un sólido cúbico centrado en el cuerpo (BCC por sus siglas en inglés). Los átomos en las esquinas de una celda unitaria BCC no entran en contacto entre sí, sino con el átomo ubicado en el centro. Una celda unitaria BCC contiene dos átomos: Un octavo de un átomo en cada una de las ocho esquinas (8 × 1/8= 1 átomo de las esquinas) más un átomo del centro. Cualquier átomo en esta estructura toca cuatro átomos de la capa que tiene po encima y cuatro átomos en la capa que tiene por debajo. Así, un átomo en una estructura BCC tiene un número de coordinación de ocho. Los átomos en los arreglos BCC están empaquetados de manera mucho más eficiente que en una estructura cúbica simple, ocupando alrededor del 68% del volumen total.
Muchos otros metales cristalizan en un arreglo que tiene una celda unitaria cúbica con átomos en todas las esquinas y en los centros de cada cara. Esta disposición se denomina sólido cúbico centrado en la cara (FCC por sus siglas en inglés). Una celda unitaria FCC contiene cuatro átomos: Un octavo de un átomo en cada una de las ocho esquinas (8 × 1/8= 1 átomo de las esquinas) y la mitad de un átomo en cada una de las seis caras (6 × 1/2= 3 átomos de las caras). Los átomos en las esquinas tocan los átomos en los centros de las caras adyacentes a lo largo de las diagonales de la cara del cubo. Debido a que los átomos están en puntos de celosía idénticos, tienen entornos idénticos. Los átomos en un arreglo FCC están empaquetados lo más cerca posible, con los átomos ocupando el 74% del volumen. Cada átomo entra en contacto con seis átomos en su propia capa, tres en la capa superior y tres en la capa inferior. En este arreglo, cada átomo toca 12 vecinos cercanos y por lo tanto tiene un número de coordinación de 12.
Este texto ha sido adaptado de Openstax, Química 2e, Secciones 10.5 El Estado Sólido de la Materia, y 10,6 Estructuras de Celosía en Sólidos Cristalinos.
