10.1:
遷移金属の性質
10.1:
遷移金属の性質
遷移金属は、部分的に満たされたd軌道を持つ元素として定義されます。Figure 1に示すように、3族–12族のdブロックの元素が遷移元素です。また、fブロックの元素は、f軌道よりも先にd軌道が部分的に占有されているため、内部遷移元素(ランタノイドやアクチノイド)とも呼ばれます。
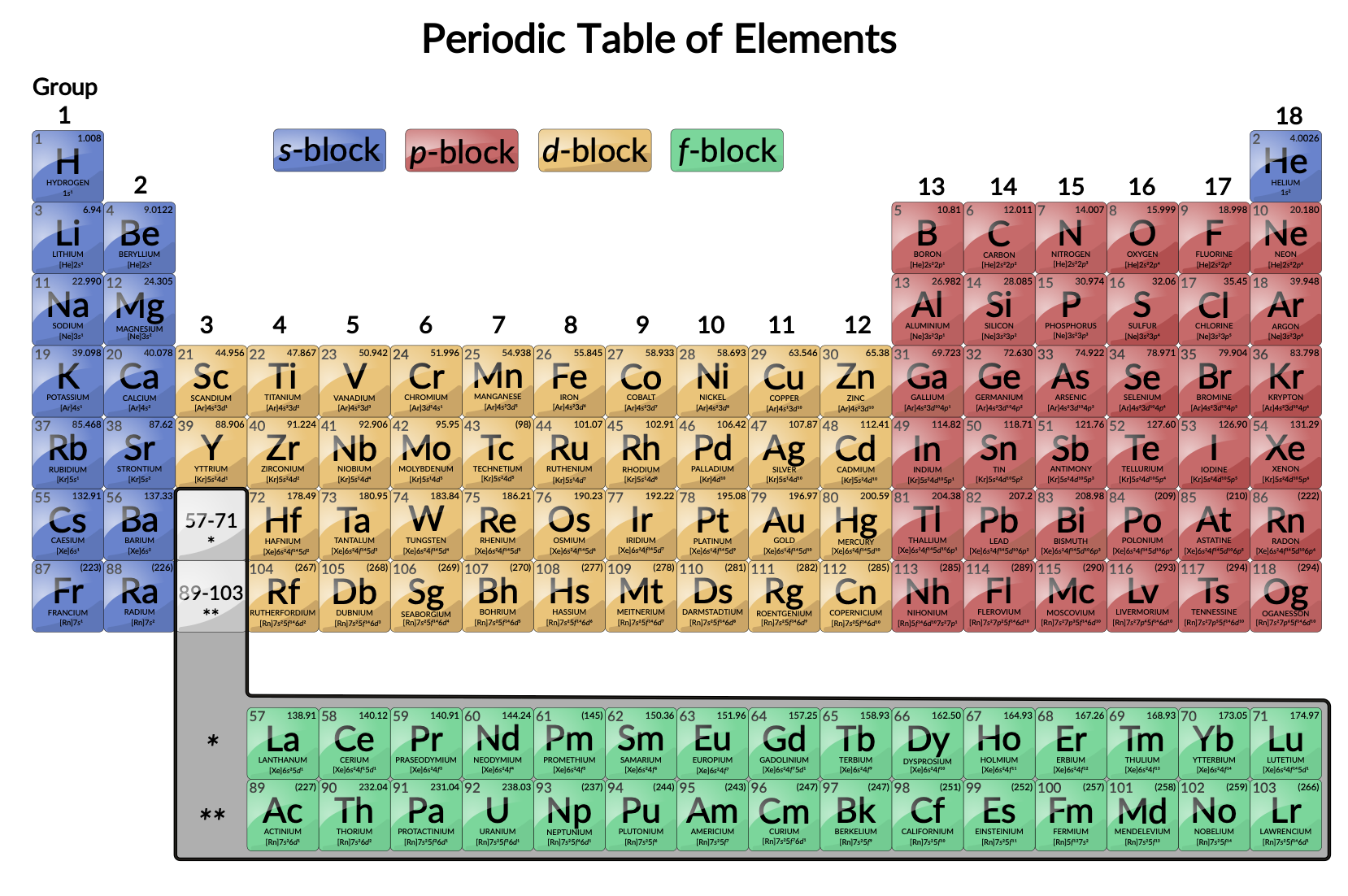
Figure 1: 周期表 遷移金属は、周期表の第3–11族に位置します。内部遷移金属は、周期表の第6、7周期です。
dブロックの元素は、第1遷移系列(Sc~Cuの元素)、第2遷移系列(Y~Agの元素)、第3遷移系列(LaとHf~Auの元素)に分けられます。アクチニウム(Ac)は、RfからRgまでを含む第4遷移系列の最初の元素です。
fブロック元素とは、ランタノイド系列(またはランタノイド系列)を構成するCeからLuまでの元素と、アクチノイド系列(またはアクチノイド系列)を構成するThからLrまでの元素のことです。ランタンは、その電子配置が第3遷移系列の第1族ですが、ランタノイド元素と非常によく似た振る舞いをするため、ランタノイド元素とみなされています。同様に、アクチニウムは、その電子配置が第4遷移系列の第1族ですが、アクチノイド系列に属しています。
遷移元素は、他の金属と共通する多くの性質を持っています。ほとんどの場合、硬くて高融点の固体であり、熱や電気をよく通す。遷移元素は容易に合金を形成し、電子を失って安定な陽イオンとなります。さらに、遷移金属は多種多様な安定した配位化合物を形成し、その中で中心となる金属原子またはイオンはルイス酸として働き、1対以上の電子を受け入れます。また、多くの異なる分子やイオンが、金属中心に孤立した電子対を提供し、ルイス塩基として機能しています。
遷移元素の特性
遷移金属は、幅広い化学的挙動を示します。強力な還元剤となるものもあれば、反応性が非常に低いものもあります。例えば、ランタノイドはいずれも安定した3+の水溶性イオンとなります。このような酸化の駆動力は、Be2+やMg2+を生成するBeやMgなどのアルカリ土類金属の場合と同様です。一方、白金や金のような物質は、はるかに高い還元力を持っています。そのため、酸化されにくく、回路や宝飾品の材料として有用です。
Cr3+、Fe3+、Co2+などの軽いdブロック元素のイオンは、水の中で安定な水和イオンとなります。しかし、これらのすぐ下の周期のイオン(Mo3+、Ru3+、Ir2+)は不安定で、空気中の酸素と容易に反応します。重いdブロック元素が形成する単純で水に安定なイオンの大半は、MoO42−や ReO4−などのオキシ陰イオンです。
ルテニウム、オスミウム、ロジウム、イリジウム、パラジウム、プラチナは白金族金属です。複雑なことに、これらは水中で安定した単純な陽イオンとなり、第2、第3遷移系列の初期の元素とは異なり、安定したオキシ陰イオンを生成しません。
dおよびfブロック元素は、いずれも非金属と反応して二元的な化合物を形成します。これらの元素はハロゲンと反応して、酸化状態が+1から+6までの様々なハロゲン化物を形成します。加熱すると、酸素はパラジウム、白金、銀、金を除くすべての遷移元素と反応します。後者の金属の酸化物は、他の反応物を用いて生成することもできますが、加熱すると分解します。fブロック元素、第3族元素、銅を除く第1遷移系列の元素は、酸の水溶液と反応して水素ガスと対応する塩の水溶液を生成します。
遷移金属は、幅広い酸化状態の化合物を形成します。第一遷移系列の元素で観察される酸化状態の一部をTable 1に示します。第一遷移系列を左から右に見ていくと、共通する酸化状態の数が最初に増加し、表の中央部で最大となり、その後減少します。表中の値は典型的な値であるため、表外の価数を持つ化合物についても新たに合成する試みがなされています。例えば、2014年には新たな酸化状態であるイリジウム(+9)の合成に成功しています。
| 21Sc | 22Ti | 23V | 24Cr | 25Mn | 26Fe | 27Co | 28Ni | 29Cu | 30Zn |
| +1 | |||||||||
| +2 | +2 | +2 | +2 | +2 | +2 | +2 | +2 | ||
| +3 | +3 | +3 | +3 | +3 | +3 | +3 | +3 | +3 | |
| +4 | +4 | +4 | +4 | ||||||
| +5 | |||||||||
| +6 | +6 | +6 | |||||||
| +7 |
Table 1. 第一遷移系列の遷移金属は、様々な酸化状態の化合物を形成することができる。
スカンジウムからマンガンまでの元素(第1遷移系列の前半)では、価電殻のs軌道とd軌道の両方の電子をすべて失った状態が最も高い酸化状態に相当します。例えば、チタン(IV)イオンは、チタン原子が2つの3dと2つの4sの電子を失ったときに形成されます。これらの最も高い酸化状態は、スカンジウム、チタン、バナジウムの最も安定した形態です。しかし、金属からすべての価電子を取り除き続けることはできません。鉄は、+2から+6までの酸化状態を形成することが知られており、鉄(II)と鉄(III)が最も一般的です。第一遷移系列の元素のほとんどは、水中で安定な2+または3+の電荷を持つ陽イオンとなり、また、第1遷移系列の初期の元素は空気中で容易に酸化されます。
第2、第3遷移系列の元素は、一般に第1遷移系列の元素よりも高い酸化状態で安定します。一般に、原子半径は周期が下がるほど大きくなるため、第2、第3遷移系列のイオンは第1遷移系列のイオンよりも大きくなると考えられます。原子核から遠い軌道から電子を取り除くことは、原子核に近い軌道から電子を取り除くことよりも容易です。例えば、第6族のモリブデンやタングステンは、水溶液中ではほとんどの場合で+6の酸化状態をとる。6族の中で最も軽いクロムは、水中では安定したCr3+イオンを形成し、空気のないところでは、より安定性の低いCr2+イオンを形成します。クロムの酸化状態が最も高い硫化物はCr2S3であり、Cr3+イオンを含んでいます。モリブデンとタングステンは、金属の酸化状態が+4と+6の硫化物を形成します。
遷移金属が示す多様な特性は、その複雑な原子価殻に起因します。通常1つの酸化状態を示す典型金属とは異なり、遷移金属の原子価殻構造は、数種類の安定した酸化状態を示します。また、これらの元素の電子遷移は、可視光スペクトルの光子の吸収に対応するため、カラフルな化合物となります。このように、遷移金属は豊かで魅力的な化学反応を示します。
上記の文章は以下から引用した。Openstax, Chemistry 2e, Chapter 19.1 Occurrence, Preparation, and Properties of Transition Metals and Their Compounds.
