2.2:
Particelle subatomiche
2.2:
Particelle subatomiche
Dalton era solo parzialmente corretto sulle particelle che compongono la materia. Tutta la materia è composta da atomi, e gli atomi sono composti da tre particelle subatomiche più piccole: protoni, neutroni ed elettroni. Queste tre particelle rappresentano la massa e la carica di un atomo.
La scoperta dell’elettrone
Il primo indizio sulla struttura subatomica arrivò alla fine del XIX secolo quando J.J. Thomson scoprì l’elettrone usando un tubo a raggi catodici. Questo apparecchio consisteva in un tubo di vetro sigillato, dal quale era stata rimossa quasi tutta l’aria, e che conteneva due elettrodi metallici. Quando l’alta tensione è stata applicata attraverso gli elettrodi, tra di loro è apparso un raggio visibile chiamato raggio catodico. Questo fascio è stato deviato verso la carica positiva e lontano dalla carica negativa, ed è stato prodotto allo stesso modo con proprietà identiche quando sono stati utilizzati metalli diversi per gli elettrodi. In esperimenti simili, il raggio è stato simultaneamente deviato da un campo magnetico applicato. Le misurazioni dell’estensione della deflessione e dell’intensità del campo magnetico permisero a Thomson di calcolare il rapporto carica-massa delle particelle di raggi catodici. I risultati di queste misurazioni indicavano che queste particelle erano molto più leggere degli atomi. Sulla base delle sue osservazioni, Thomson propose quanto segue:
- Le particelle sono attratte da cariche positive (+) e respinte da cariche negative (−), quindi devono essere addebitate negativamente (come le cariche respingono e a differenza delle cariche attraggono);
- Le particelle sono meno massicce degli atomi e indistinguibili, indipendentemente dal materiale sorgente, quindi devono essere costituenti subatomici fondamentali di tutti gli atomi.
La particella di raggi catodici di Thomson è un elettrone, una particella subatomica carica negativamente con una massa superiore a 1000× inferiore a quella di un atomo. Il termine “elettrone” fu coniato nel 1891 dal fisico irlandese George Stoney, da “ione elettrico”.
Nel 1909, Robert A. Millikan ha calcolato la carica di un elettrone con i suoi esperimenti di “goccia d’olio”. Millikan creò microscopiche goccioline di olio, che potevano essere ricaricate elettricamente per attrito mentre si formavano o usando i raggi X. Queste goccioline inizialmente caddero a causa della gravità, ma il loro progresso verso il basso poteva essere rallentato o addirittura invertito da un campo elettrico più in basso nell’apparato. Regolando la resistenza del campo elettrico ed effettuando misurazioni accurate e calcoli appropriati, Millikan è stato in grado di determinare la carica sulle singole gocce di 1,6 × 10−19 C (coulomb). Millikan concluse che questo valore deve quindi essere la carica fondamentale di un singolo elettrone. Poiché la carica di un elettrone era ora nota a causa della ricerca di Millikan — e il rapporto carica-massa era già noto a causa della ricerca di Thomson (1,759 × 1011 C/kg) — la massa dell’elettrone era determinata in 9,107 × 10−31 kg.
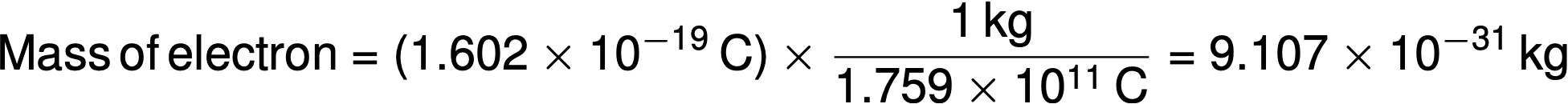
Modello nucleare di Rutherford
Gli scienziati avevano ora stabilito che l’atomo non era indivisibile come Dalton aveva creduto, e a causa del lavoro di Thomson, Millikan e altri, la carica e la massa delle particelle subatomiche negative – gli elettroni – erano note. Gli scienziati sapevano che la carica complessiva di un atomo era neutra. Tuttavia, la parte carica positivamente di un atomo non era ancora ben compresa. Nel 1904 Thomson propose il modello di “plum pudding” degli atomi, che descriveva una massa carica positivamente con una quantità uguale di carica negativa sotto forma di elettroni incorporati in esso, poiché tutti gli atomi sono elettricamente neutri. Un modello concorrente era stato proposto nel 1903 da Hantaro Nagaoka, che postulò un atomo simile a Saturno, costituito da una sfera carica positivamente circondata da un alone di elettroni.
Il successivo grande sviluppo nella comprensione dell’atomo venne da Ernest Rutherford. Eseguì una serie di esperimenti utilizzando un fascio di particelle alfa ad alta velocità e cariche positivamente (particelle α) che furono prodotte dal decadimento radioattivo del radio. Ha puntato un fascio di particelle α su un pezzo molto sottile di lamina d’oro ed ha esaminato la dispersione risultante delle particelle di α usando uno schermo luminescente che brillava brevemente quando colpito da una particella α. Osservò che la maggior parte delle particelle passava attraverso il foglio senza essere deviata affatto. Tuttavia, alcuni furono leggermente deviati, e un numero molto piccolo fu deviato quasi dritto verso la sorgente.
Da questo, Rutherford dedudue poi quanto segue: Poiché la maggior parte delle particelle di α in rapido movimento passavano attraverso gli atomi d’oro non indifesi, devono aver viaggiato attraverso uno spazio essenzialmente vuoto all’interno dell’atomo. Le particelle alfa sono cariche positivamente, quindi le deviazioni sorsero quando incontrarono un’altra carica positiva (come le cariche si respingono a vicenda). Poiché come le cariche si respingono a vicenda, le poche particelle di α cariche positivamente che hanno cambiato bruscamente tracciato devono aver colpito, o avvicinato da vicino, un altro corpo che aveva anche una carica altamente concentrata e positiva. Poiché le deformazioni si verificavano una piccola frazione del tempo, questa carica occupava solo una piccola quantità di spazio nella lamina d’oro.
Analizzando una serie di esperimenti, Rutherford trasse due importanti conclusioni:
- Il volume occupato da un atomo deve consistere in una grande quantità di spazio vuoto.
- Un corpo piccolo, relativamente pesante, caricato positivamente, il nucleo, deve essere al centro di ogni atomo.
Questa analisi portò Rutherford a proporre un modello in cui un atomo consiste in un nucleo molto piccolo e caricato positivamente, in cui si concentra la maggior parte della massa dell’atomo, circondato dagli elettroni caricati negativamente in modo che l’atomo sia elettricamente neutro. Dopo molti altri esperimenti, Rutherford scoprì anche che i nuclei di altri elementi contengono il nucleo di idrogeno come un “elemento costitutivo”, e chiamò questa particella più fondamentale il protone, la particella subatomica carica positivamente trovata nel nucleo.
La struttura di un atomo
I protoni si trovano nel nucleo di un atomo e hanno una carica positiva. Il numero di protoni è uguale al numero atomico sulla tavola periodica e determina l’identità dell’elemento. Neutroni si trovano anche nel nucleo. Non hanno carica, ma hanno la stessa massa dei protoni e quindi contribuiscono alla massa atomica di un atomo. Gli elettroni orbitano attorno al nucleo in nuvole. Hanno una carica negativa e una massa trascurabile, quindi contribuiscono alla carica complessiva di un atomo, ma non alla sua massa.
Neutroni
Il nucleo era noto per contenere quasi tutta la massa di un atomo, con il numero di protoni che forniva solo la metà, o meno, di quella massa. Sono state avanzate diverse proposte per spiegare cosa costituiva la massa rimanente, inclusa l’esistenza di particelle neutre nel nucleo. Fu solo nel 1932 che James Chadwick trovò prove di neutroni, particelle subatomiche non cariche con una massa approssimativamente uguale a quella dei protoni.
L’esistenza del neutrone spiegò anche gli isotopi: differiscono in massa perché hanno un numero diverso di neutroni, ma sono chimicamente identici perché hanno lo stesso numero di protoni.
Unità di massa atomica (amu) e unità di carica fondamentale (e)
Il nucleo contiene la maggior parte della massa di un atomo perché protoni e neutroni sono molto più pesanti degli elettroni, mentre gli elettroni occupano quasi tutto il volume di un atomo. Il diametro di un atomo è dell’ordine di 10−10 m, mentre il diametro del nucleo è di circa 10−15 m — circa 100.000 volte più piccolo. Gli atomi – e i protoni, i neutroni e gli elettroni che li compongono – sono estremamente piccoli. Per esempio, un atomo di carbonio pesa meno di 2 × 10−23 g, e un elettrone ha una carica inferiore a 2 × 10−19 C. Quando si descrivono le proprietà di piccoli oggetti come gli atomi, vengono utilizzate unità di misura opportunamente piccole, come l’unità di massa atomica (amu) e l’unità fondamentale di carica (e). L’amu è definita per quanto riguarda l’isotopo più abbondante del carbonio, i cui atomi sono assegnati masse esattamente di 12 amu. Quindi, un’amu è esattamente 1/12 della massa di un atomo di carbonio-12: 1 amu = 1,6605 × 10−24 g. Il Dalton (Da) e l’unità di massa atomica unificata (u) sono unità alternative equivalenti all’amu.
L’unità fondamentale di carica (chiamata anche carica elementare) è uguale alla grandezza della carica di un elettrone con e = 1,602 × 10−19 C. Un protone ha una massa di 1,0073 amu e una carica di 1+. Un neutrone è una particella leggermente più pesante con una massa 1.0087 amu e una carica pari a zero; come suggerisce il nome, è neutro. L’elettrone ha una carica di 1− ed è una particella molto più leggera con una massa di circa 0,00055 amu. Come riferimento, ci vorrebbero circa 1800 elettroni per eguagliare la massa di un protone. Le proprietà di queste particelle fondamentali sono riassunte nella tabella seguente.
| Particella subatomica | Carica (C) | Carica unitaria | Massa (g) | Messa (amu) |
| Elettrone | −1.602 × 10−19 | 1− | 0,00091 × 10−24 | 0.00055 |
| Protone | 1.602 × 10−19 | 1+ | 1.67262 × 10−24 | 1.00727 |
| Neutrone | 0 | 0 | 1.67493 × 10−24 | 1.00866 |
Questo testo è adattato da Openstax, Chemistry 2e, Section 2.2: Evolution of Atomic Theory e Section 2.3: Atomic Structure and Symbolism.
