4.3:
反应收率
A subscription to JoVE is required to view this content. Sign in or start your free trial.
JoVE Core
Chemistry
Reaction Yield
在化学反应中,理论产量是指一 个生成物从限量反应物中 产生百分之百转换率的量。细想以下例子:假如有80个玉米颗粒被 加热成爆米花。并且假设所有的颗粒都爆开,那么理论产量就是80片。但是,如果只有50颗爆开,实际产量 就会只有50颗。因此,实际产量就是生成物实际产出的数。实际产量和理论产量的比率 乘以100后会得到理论产率,也就是,在这个例子当中,为62.5%在很多化学反应当中,因化学计算而产生的理论产量 会比实际获得的产量大很多。因为通常,部分的反应物 会失去副反应;有的生成物 会失去可逆反应;或是有的生成物 很难不因为汇集而失去一些产能。来想想燃烧的镁吧。当一片镁金属被点燃,它会和空气中的氧气结合形成氧化镁。这个化学反应包含了2莫耳的镁 和1莫耳的氧来形成2莫耳的氧化镁。现在,假设有63.4公克的氧化镁 和50.7公克的氧,那会产生多少氧化镁呢? 为了去计算理论产量,首先 各反应物的重量会被莫 耳质量转化成 相对应的莫耳数。接着,用莫耳比,也就是反应物镁和氧的莫耳数 去转化成生成物氧化镁的莫耳数。当镁在限制反应物中得到一 定数量的生成物时,理论产量就会是 2.6莫耳。转换成重量的话,就是105公克的理论产量。不过,当反应完成后,生成物的实际产量只有 80公克。也就是说,氧化镁的理论产率是 76.2%
4.3:
反应收率
反应的理论产率是基于平衡化学方程式的化学计量估计形成的产物的量。理论产率假设限量反应物完全转化为所需产物。通过反应获得的产物量称为实际产率,它可能小于或(很少)等于理论产率。
百分比产率
在化学反应的情况下,产物的实际产率通常小于基于反应化学计量法预测的理论产率。当在给定的一组条件下进行反应时,由于多种原因,预计不可避免的质量损失。有些反应自然效率低下,通过副反应生成其他不良产物。其他的由于其可逆的性质而不完整,并伴随着反应物和产物之间的平衡状态。有时,产物质量的损失是由于在纯化技术(例如结晶,蒸馏,过滤和色谱分离)过程中从反应混合物中回收的所需产物得不到充分的吸收。在遇到产品损失的情况下,使用百分比产率来衡量达到反应理论收率的程度。
计算百分比产率
考虑将一氧化氮燃烧成二氧化氮。
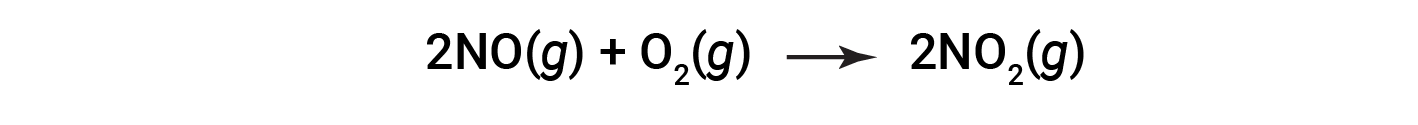
反应的实际产率为180克。知道一氧化氮是限量反应物,基于NO和NO 2 的化学计量,可获得理论产率的摩尔数。首先,NO的质量转换为NO的摩尔数。然后,采用NO:NO 2 的化学计量比(1:1),这表明5摩尔NO将形成5摩尔NO 2 。第三,NO 2 的摩尔转化为质量。

最后一步,将根据实际产率与理论产率之比计算百分比产率。
