5.9:
Effusione e diffusione
5.9:
Effusione e diffusione
Sebbene le molecole gassose viaggino a velocità tremende (centinaia di metri al secondo), si scontrano con altre molecole gassose e viaggiano in molte direzioni diverse prima di raggiungere il bersaglio desiderato. A temperatura ambiente, una molecola gassosa sperimenterà miliardi di collisioni al secondo. Il percorso libero medio è la distanza media che una molecola percorre tra collisioni. Il percorso libero medio aumenta con la pressione decrescente; in generale, il percorso libero medio per una molecola gassosa sarà centinaia di volte il diametro della molecola
In generale, quando un campione di gas viene introdotto in una parte di un contenitore chiuso, le sue molecole si disperdono molto rapidamente in tutto il contenitore; questo processo attraverso il quale le molecole si disperdono nello spazio in risposta alle differenze di concentrazione è chiamato diffusione. Gli atomi o le molecole gassose non sono ovviamente a conoscenza di alcun gradiente di concentrazione; si muovono semplicemente casualmente – regioni di maggiore concentrazione hanno più particelle rispetto alle regioni a concentrazioni più basse, e quindi avviene un movimento netto di specie da aree ad alta a bassa concentrazione. In un ambiente chiuso, la diffusione si tradurrà in concentrazioni uguali di gas in tutto. Gli atomi gassosi e le molecole continuano a muoversi, ma poiché le loro concentrazioni sono le stesse in entrambi i bulbi, le velocità di trasferimento tra i bulbi sono uguali (non si verifica alcun trasferimento netto di molecole). La quantità di gas che passa attraverso una certa area per unità di tempo è il tasso di diffusione.
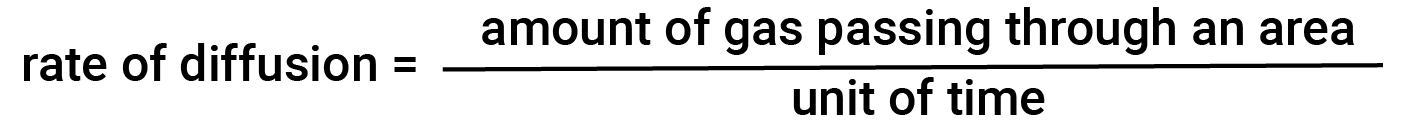
Il tasso di diffusione dipende da diversi fattori: il gradiente di concentrazione (l’aumento o la diminuzione della concentrazione da un punto all’altro), la quantità di superficie disponibile per la diffusione e la distanza che le particelle di gas devono percorrere.
Un processo che coinvolge il movimento di specie gassose simile alla diffusione è l’effusione, la fuga di molecole di gas attraverso un piccolo foro, come un foro stenopeica in un palloncino nel vuoto. Sebbene i tassi di diffusione ed effusione dipendano entrambi dalla massa molare del gas in questione, i loro tassi non sono uguali; tuttavia, i rapporti dei loro tassi sono gli stessi.
Se una miscela di gas viene posta in un contenitore con pareti porose, i gas effuse attraverso le piccole aperture nelle pareti. I gas più leggeri passano attraverso le piccole aperture più rapidamente (ad una velocità più alta) rispetto a quella più pesante. Nel 1832, Thomas Graham studiò i tassi di effusione di diversi gas e formulò la legge di effusione di Graham: Il tasso di effusione di un gas è inversamente proporzionale alla radice quadrata della massa delle sue particelle:

Ciò significa che se due gas, A e B, sono alla stessa temperatura e pressione, il rapporto dei loro tassi di effusione è inversamente proporzionale al rapporto tra le radici quadrate delle masse delle loro particelle:

La relazione indica che il gas più leggero ha un tasso di effusione più elevato.
Ad esempio, un palloncino di gomma riempito di elio si sgonfia più velocemente di uno pieno d’aria perché la velocità di effusione attraverso i pori della gomma è più veloce per gli atomi di elio più leggeri che per le molecole d’aria.
Questo testo è adattato da Openstax, Chimica 2e, Sezione 9.4: Effusione e diffusione dei gas.
