5.9:
Efusão e Difusão
5.9:
Efusão e Difusão
Embora moléculas gasosas viajem a velocidades tremendas (centenas de metros por segundo), elas colidem com outras moléculas gasosas e viajam em muitas direções diferentes antes de alcançar o alvo desejado. À temperatura ambiente, uma molécula gasosa experimentará mil milhões de colisões por segundo. O caminho livre médio é a distância média que uma molécula percorre entre colisões. O caminho livre médio aumenta com a diminuição da pressão; no geral, o caminho livre médio para uma molécula gasosa será centenas de vezes o diâmetro da molécula
No geral, quando uma amostra de gás é introduzida em uma parte de um recipiente fechado, as suas moléculas dispersam-se muito rapidamente por todo o recipiente; este processo pelo qual as moléculas se dispersam no espaço em resposta às diferenças de concentração é chamado de difusão. Os átomos ou moléculas gasosos são, naturalmente, inconscientes de qualquer gradiente de concentração; eles simplesmente movem-se aleatoriamente — zonas de maior concentração têm mais partículas do que zonas de menor concentração, e ocorre então um movimento líquido de espécies de zonas de alta para baixa concentração. Em um ambiente fechado, a difusão acabará por resultar em concentrações iguais de gás por todo o lado. Os átomos e as moléculas gasosos continuam a mover-se, mas como as suas concentrações são as mesmas, as taxas de transferência são iguais (não ocorre transferência líquida de moléculas). A quantidade de gás que passa por uma área por unidade de tempo é a taxa de difusão.
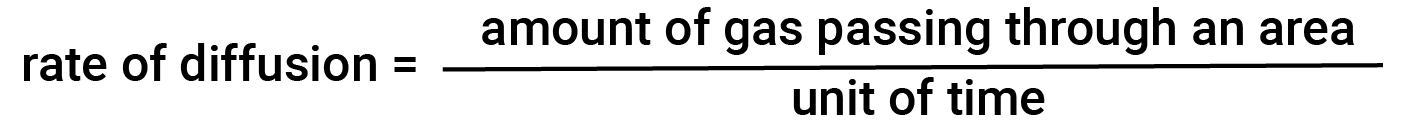
A taxa de difusão depende de vários factores: o gradiente de concentração (o aumento ou diminuição da concentração de um ponto para outro), a quantidade de área de superfície disponível para difusão, e a distância que as partículas de gás devem percorrer.
Um processo que envolve o movimento de espécies gasosas semelhante à difusão é a efusão, a fuga de moléculas de gás através de um pequeno buraco, como um furo em um balão em um vácuo. Embora as taxas de difusão e efusão dependam da massa molar do gás envolvido, as suas taxas não são iguais; no entanto, as relações das suas taxas são as mesmas.
Se uma mistura de gases for colocada em um recipiente com paredes porosas, os gases são libertados através das pequenas aberturas nas paredes. Os gases mais leves passam pelas pequenas aberturas mais rapidamente (a uma taxa mais alta) do que os mais pesados. Em 1832, Thomas Graham estudou as taxas de efusão de diferentes gases e formulou a lei de efusão de Graham: A taxa de efusão de um gás é inversamente proporcional à raiz quadrada da massa das suas partículas:

Isto significa que, se dois gases, A e B, estiverem à mesma temperatura e pressão, a razão das suas taxas de efusão é inversamente proporcional à razão das raízes quadradas das massas das suas partículas:

A relação indica que o gás mais leve tem uma maior taxa de efusão.
Por exemplo, um balão de borracha cheio de hélio esvazia mais rapidamente do que um balão cheio de ar, porque a taxa de efusão através dos poros da borracha é mais rápida para os átomos de hélio mais leves do que para as moléculas de ar.
Este texto é adaptado de Openstax, Chemistry 2e, Section 9.4: Effusion and Diffusion of Gases.
