5.9:
분출과 확산
5.9:
분출과 확산
기체 분자는 엄청난 속도(초당 수백 미터)로 이동하지만, 다른 기체 분자와 충돌하여 원하는 목표에 도달하기 전에 여러 방향으로 이동합니다. 실온에서 기체 분자는 초당 수십억 개의 충돌을 경험하게 됩니다. 평균 자유 경로는 분자가 충돌 사이에 이동하는 평균 거리입니다. 평균 무료 경로는 압력 감소와 함께 증가; 일반적으로, 기체 분자에 대한 평균 자유 경로는 분자의 직경의 수백 배가 될 것입니다
일반적으로, 가스 샘플이 밀폐 된 용기의 한 부분에 도입될 때, 그 분자는 매우 빠르게 용기 전체에 분산; 분자가 농도의 차이에 대응하여 공간에서 분산되는 이 과정은 확산이라고 합니다. 기체 원자 또는 분자는, 당연히, 어떤 농도 그라데이션을 인식하지 못합니다; 그들은 단순히 무작위로 이동 – 높은 농도의 영역은 낮은 농도의 영역보다 더 많은 입자를 가지고, 그래서 높은 농도 지역에서 낮은 농도 영역으로 종의 그물 이동이 일어난다. 폐쇄된 환경에서 확산은 궁극적으로 전체적으로 동일한 농도의 가스를 발생시합니다. 기체 원자와 분자는 계속 움직이지만, 두 전구 모두에서 농도가 동일하기 때문에 전구 사이의 전달 속도는 동일합니다 (분자의 순 전달은 발생하지 않습니다). 단위 시간당 일부 영역을 통과하는 가스의 양은 확산의 속도입니다.
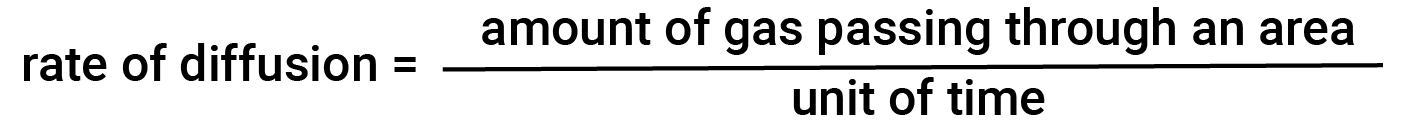
확산 속도는 농도 그라데이션(한 지점에서 다른 지점으로 농도의 증가 또는 감소), 확산에 사용할 수 있는 표면적의 양 및 가스 입자가 이동해야 하는 거리 등 여러 가지 요인에 따라 달라집니다.
확산과 유사한 기체 종의 이동을 포함하는 과정은 유출, 진공으로 풍선에 핀홀과 같은 작은 구멍을 통해 가스 분자의 탈출이다. 확산 및 삼혈 속도 모두 관련된 가스의 어금니 질량에 의존하지만, 그들의 속도는 동일하지 않습니다; 그러나, 그들의 비율의 비율은 동일합니다.
다공성 벽이 있는 용기에 가스가 혼합되어 있으면 가스가 벽의 작은 구멍을 통해 흘러들어오게 됩니다. 가벼운 가스는 무거운 개구부보다 더 빠르게(더 높은 속도로) 작은 구멍을 통과합니다. 1832년, 토마스 그레이엄은 다른 가스의 포혈 비율을 연구하고 그레이엄의 포혈 법칙을 공식화했습니다: 가스의 유출 속도는 입자 덩어리의 제곱근에 반비례합니다.

즉, 두 개의 가스인 A와 B가 동일한 온도와 압력에 있는 경우, 그들의 유출 속도의 비율은 입자질량의 제곱 뿌리의 비율에 반비례한다는 것을 의미합니다.

관계는 가벼운 가스가 더 높은 유출 속도를 가지고 있음을 나타냅니다.
예를 들어, 헬륨으로 채워진 고무 풍선은 고무의 모공을 통한 포혈 속도가 공기 분자보다 더 가벼운 헬륨 원자에 대해 더 빠르기 때문에 공기가 채워진 것보다 빠르게 수축됩니다.
