5.10:
現実の気体 - 理想気体の状態方程式からの逸脱
5.10:
現実の気体 - 理想気体の状態方程式からの逸脱
これまで、理想気体の法則である PV = nRT は、反応化学量論、実験的および分子式の問題から、気体の密度とモル質量の決定まで、さまざまな種類の問題に適用されてきました。 しかし、気体の挙動が非理想的であることが多く、その圧力、体積、および温度の間で観測された関係が、気体の法則によって正確に記述されていないことを意味します。
運動分子論によると、理想気体の粒子は、互いに引力や斥力を示すことはありません。 容器の容量と比較して、気体の体積は無視できると想定されています。 室温および 1 atm 以下では、理想気体の状態方程式で示されているように、気体は理想的な挙動に従います。
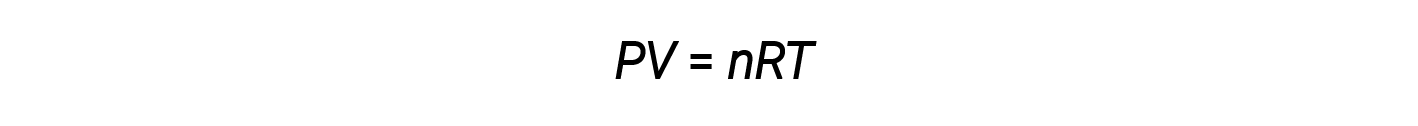
ただし、圧力が高い場合や温度が低い場合は、理想気体の法則からの逸脱が生じます。つまり、圧力、体積、および温度の間で観察された関係が正確に守られていないことを意味します。
理想気体の式を再配置してnを求めると :
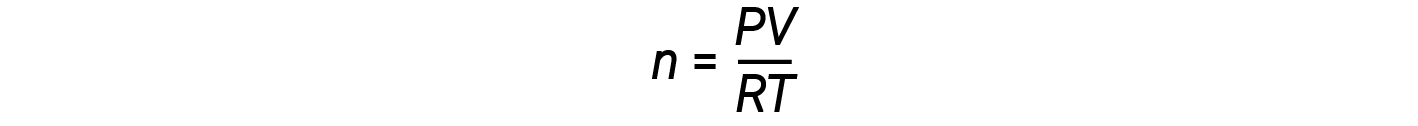
1 モルの理想気体の 場合、圧力に関係なく PV/RT 比は 1 です。 この比率が 1 から逸脱すると、非理想的な動作だということになります。
理想気体の法則は比較的高い圧力での気体の挙動をうまく説明できません。 つまり、この比率は低圧時にのみ 1 となります。 圧力が上昇すると、 PV/RTは 1 から外れ始め、その外れ方は均一ではありません。 高圧では、理想的な挙動からの剥離が大きくなり、それは気体ごとに異なります。 つまり、現実の気体は、高圧下で理想的な挙動を示しません。 ただし、圧力が低い場合(通常は 10 atm 未満)、理想的な挙動からの逸脱は少なく、理想気体の状態方程式を使用できます。
仮定の理想気体粒子は大きな体積を持たず、互いに引き合うことも反発することもありません。 一般に、現実の気体は比較的低い圧力および高い温度ではこの挙動に近似します。 しかし、高圧下では、気体分子が互いに接近して密集し、分子間の空きスペースが減少します。 高い圧力では、気体分子自体の体積は、気体が占める総体積と比較して大きくなります。 このため、気体は高圧になると圧縮性が低下し、圧力が上昇するにつれて体積は減少し続けるが、ボイルの法則で予測されるような比例的なものではありません。
比較的低い圧力では、気体分子は ( 平均して ) 離れているため、実質的に互いに引き合ったりはせず、理想気体粒子のような挙動を示します。 しかし、圧力が高いほど、引力も無視できなくなります。 この力は分子を少しずつ近くに引き寄せ、圧力をわずかに下げたり(体積が一定の場合)、体積を減らしたりする(一定の圧力の場合)。 この変化は低温になるほど顕著になるが、これは分子の引力に対するKEが低いため、分子同士が衝突してもこの引力に打ち勝つ効果が低いためです。
気体の挙動を理想気体の法則よりもよく近似した方程式がいくつかあります。 これらのうち最初で最もシンプルなものは、 1879 年にオランダの科学者 ヨハネス・ファン・デル・ワールスによって開発されたものです。 ファン・デル・ワールスの方程式は、理想気体の法則に、気体分子の体積と分子間の引力を表す2つの項目を加えることで、理想気体の法則を改良したものです。
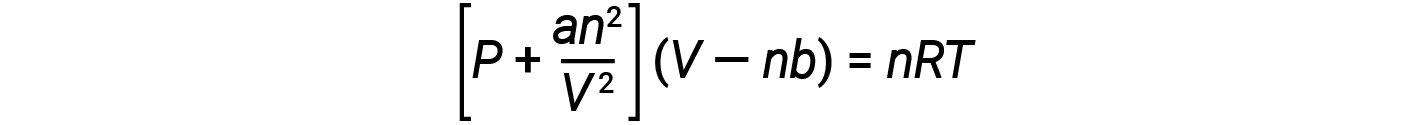
定数 a は特定の気体の分子間引力の強さに対応し、定数 bは特定の気体の分子の大きさに対応します。 理想気体の法則における圧力条件に対する補正はan2/V2であり、体積に対する補正はnbです。 V が比較的大きく n が比較的小さい場合、これらの補正条件はどちらも無視できる程度になり、 ファン・デル・ワールスの式は理想気体の法則、 PV = NRT となることに注意してください。 このような状態は、相対的に少ない分子数で相対的に大きな体積を占めている気体、すなわち相対的に低い圧力の気体に相当します。
低圧下では、モル体積b よりも分子間引力 a の補正が重要です。高圧下や小さな体積では、分子自体は圧縮できず、総体積のかなりの割合を占めることになるため、分子の体積の補正が重要となります。 ある中間の圧力では、 2 つの補正は相反する影響を及ぼすため、気体は小さな圧力の範囲でPV = nRTの関係に従うように見えます。
厳密に言えば、気体分子間の分子間引力が無視でき、気体分子自体が全体積のかなりの部分を占めていない場合に、理想気体の方程式がうまく機能します。 これらの条件が満たされるのは、低圧かつ高温の条件下です。 このような条件では、気体は理想的な振る舞いをすると言われ、気体の法則からの逸脱は無視できるほど小さいが、実際にはそうではないことが多いです。
このテキストは 、 Openstax, Chemistry 2e, Section 9.2: Non-Ideal Gas Behavior から引用したものです。</p
