7.5:
Il modello di Bohr
7.5:
Il modello di Bohr
Seguendo il lavoro di Ernest Rutherford e dei suoi colleghi all’inizio del XX secolo, l’immagine di atomi costituiti da minuscoli nuclei densi circondati da elettroni più leggeri e ancora più piccoli che si muovevano continuamente intorno al nucleo era ben consolidata. Questa immagine è stata chiamata modello planetario poiché immaginava l’atomo come un “sistema solare” in miniatura con gli elettroni che orbitavano attorno al nucleo come pianeti orbitanti attorno al Sole. L’atomo più semplice è l’idrogeno, costituito da un singolo protone come nucleo attorno al quale si muove un singolo elettrone. La forza elettrostatica che attrae l’elettrone verso il protone dipende solo dalla distanza tra le due particelle. Questa descrizione meccanica classica dell’atomo è incompleta, tuttavia, poiché un elettrone che si muove in un’orbita ellittica sta accelerando (cambiando direzione) e, secondo l’elettromagnetismo classico, dovrebbe emettere continuamente radiazione elettromagnetica. Questa perdita di energia orbitale dovrebbe far diventare l’orbita dell’elettrone sempre più piccola fino a quando non si spirale nel nucleo, il che implica che gli atomi sono intrinsecamente instabili.
Nel 1913, Niels Bohr tentò di risolvere il paradosso atomico ignorando la previsione dell’elettromagnetismo classico che l’elettrone orbitante nell’idrogeno avrebbe emesso continuamente luce. Invece, incorporò la descrizione della meccanica classica delle idee di quantizzazione dell’atomo ï1/4 Planck e la scoperta di Einstein che la luce consiste di fotoni la cui energia è proporzionale alla loro frequenza. Bohr presumeva che l’elettrone orbitante attorno al nucleo normalmente non avrebbe emesso alcuna radiazione (l’ipotesi dello stato stazionario), ma avrebbe emesso o assorbito un fotone se si fosse spostato in un’orbita diversa. L’energia assorbita o emessa rifletterebbe le differenze nelle energie orbitali secondo questa equazione:
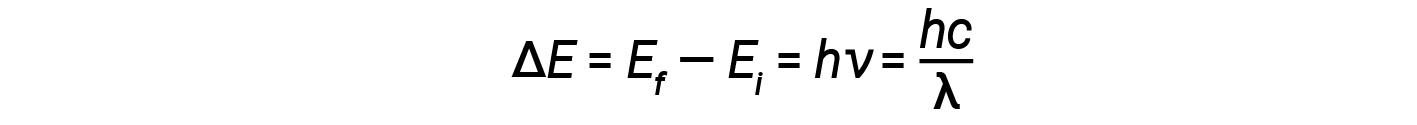
Qui, h è la costante di Planck e Ei ed Ef sono rispettivamente le energie orbitali iniziali e finali. Il valore assoluto della differenza di energia viene utilizzato poiché le frequenze e le lunghezze d’onda sono sempre positive. Invece di permettere valori continui di energia, Bohr assunse che le energie di questi orbitali elettronici fossero quantizzate.
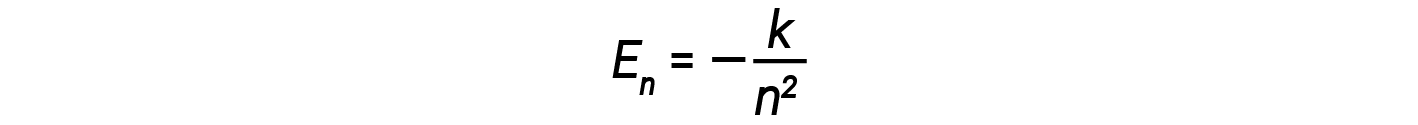
In questa espressione, k è una costante che comprende costanti fondamentali come la massa e la carica degli elettroni e la costante di Planck. L’inserimento dell’espressione per le energie dell’orbita nell’equazione per ΔE dà
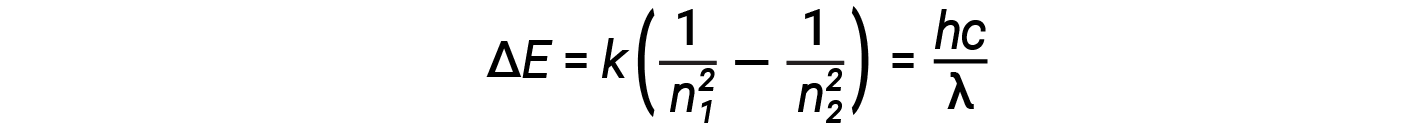
Una delle leggi fondamentali della fisica è che la materia è più stabile con la più bassa energia possibile. Così, l’elettrone in un atomo di idrogeno di solito si muove nell’orbita n = 1, l’orbita in cui ha l’energia più bassa. Quando l’elettrone si trova in questa orbita a più bassa energia, si dice che l’atomo si trova nel suo stato elettronico di terra (o semplicemente nello stato del suolo). Se l’atomo riceve energia da una sorgente esterna, è possibile che l’elettrone si sposti in un’orbita con un valore n più alto e l’atomo si trova ora in uno stato elettronico eccitato (o semplicemente uno stato eccitato) con energia più alta. Quando una transizione elettronica avviene da uno stato eccitato (orbita ad alta energia) a uno stato meno eccitato, o stato fondamentale, la differenza di energia viene emessa come fotone. Allo stesso modo, se un fotone viene assorbito da un atomo, l’energia del fotone sposta un elettrone da un’orbita ad energia inferiore fino a una più eccitata. Possiamo mettere in relazione l’energia degli elettroni negli atomi con ciò che abbiamo imparato in precedenza sull’energia. La legge di conservazione dell’energia dice che non possiamo né creare né distruggere energia. Quindi, se è necessaria una certa quantità di energia esterna per eccitare un elettrone da un livello di energia all’altro, quella stessa quantità di energia sarà liberata quando l’elettrone tornerà al suo stato iniziale.
Poiché il modello di Bohr riguardava un solo elettrone, poteva anche essere applicato agli ioni uni elettroni He+, Li2+, Be3+e così via, che differiscono dall’idrogeno solo nelle loro cariche nucleari, e quindi atomi e ioni un elettrone sono collettivamente indicati come atomi simili all’idrogeno.
Questo testo è adattato da Openstax, Chimica 2e, Sezione 6.2: Il modello Bohr.
