7.5:
O Modelo de Bohr
7.5:
O Modelo de Bohr
Após o trabalho de Ernest Rutherford e seus colegas no início do século XX, a imagem dos átomos consistindo de pequenos núcleos densos cercados por eletrões mais leves e até mesmo mais pequenos que se movimentam continuamente à volta do núcleo estava bem estabelecida. Esta imagem foi chamada de modelo planetário, uma vez que retratava o átomo como um “sistema solar” em miniatura, com os eletrões a orbitar o núcleo como planetas a orbitar o sol. O átomo mais simples é o hidrogénio, que consiste em um único protão como núcleo à volta do qual um único eletrão se move. A força eletrostática que atrai o eletrão para o protão depende apenas da distância entre as duas partículas. Esta descrição clássica da mecânica do átomo está incompleta, no entanto, uma vez que um eletrão que se move em órbita elíptica estaria a acelerar (mudando de direção) e, de acordo com o eletromagnetismo clássico, deveria emitir continuamente radiação eletromagnética. Esta perda na energia orbital deveria resultar na diminuição contínua da órbita dos eletrões até entrar em espiral até ao núcleo, o que implica que os átomos são inerentemente instáveis.
Em 1913, Niels Bohr tentou resolver o paradoxo atómico ignorando a previsão do eletromagnetismo clássico de que o eletrão em órbita do hidrogénio emitiria continuamente luz. Em vez disso, incorporou a descrição da mecânica clássica do átomo - as ideias de quantização de Planck e a descoberta de Einstein de que a luz consiste em fotões cuja energia é proporcional à sua frequência. Bohr assumiu que o eletrão que orbita o núcleo normalmente não emitiria nenhuma radiação (a hipótese do estado estacionário), mas emitiria ou absorveria um fotão se mudasse para uma órbita diferente. A energia absorvida ou emitida refletiria diferenças nas energias orbitais de acordo com esta equação:
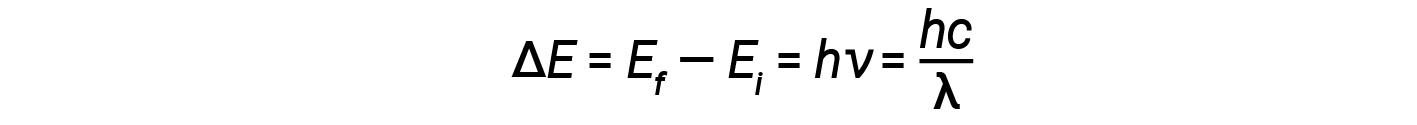
Aqui, h é a constante de Planck e Ei e Ef são as energias orbitais inicial e final, respectivamente. O valor absoluto da diferença de energia é utilizado uma vez que as frequências e os comprimentos de onda são sempre positivos. Em vez de permitir valores contínuos de energia, Bohr assumiu que as energias dessas orbitais de eletrões eram quantizadas.
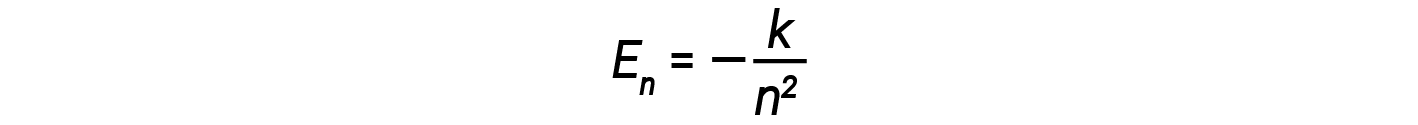
Nesta expressão, k é uma constante que compreende constantes fundamentais como a massa e carga do eletrão e a constante de Planck. Inserindo a expressão para as energias de órbita na equação de ΔE obtemos
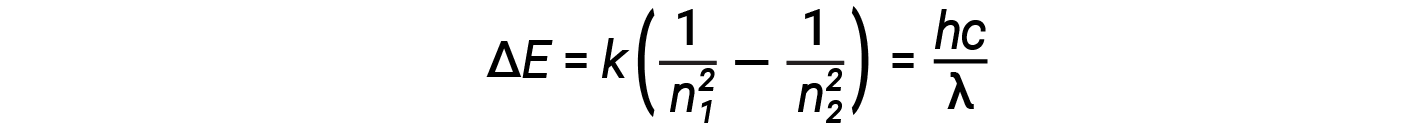
Uma das leis fundamentais da física é que a matéria é mais estável com a menor energia possível. Assim, o eletrão em um átomo de hidrogénio move-se geralmente na órbita n = 1, a órbita em que tem a energia mais baixa. Quando o eletrão está nesta órbita de energia mais baixa, diz-se que o átomo está no seu estado eletrónico fundamental (ou simplesmente estado fundamental). Se o átomo receber energia de uma fonte externa, é possível que o eletrão se mova para uma órbita com um valor n superior, ficando o átomo então em um estado eletrónico excitado (ou simplesmente um estado excitado) com maior energia. Quando ocorre uma transição de eletrão de um estado excitado (órbita de energia mais alta) para um estado menos excitado, ou estado fundamental, a diferença de energia é emitida como um fotão. Da mesma forma, se um fotão for absorvido por um átomo, a energia do fotão move um eletrão de uma órbita de energia inferior para uma órbita mais excitada. Podemos relacionar a energia dos eletrões nos átomos com o que aprendemos anteriormente sobre a energia. A lei da conservação da energia diz que não podemos nem criar nem destruir a energia. Assim, se uma determinada quantidade de energia externa for necessária para excitar um eletrão de um nível de energia para outro, essa mesma quantidade de energia será libertada quando o eletrão retornar ao seu estado inicial.
Como o modelo de Bohr envolvia apenas um único eletrão, ele também poderia ser aplicado aos iões com um único eletrão He+, Li2+, Be3+, e assim por diante, que diferem do hidrogénio apenas nas suas cargas nucleares, pelo que os átomos e iões de eletrão único são colectivamente referidos como átomos hidrogenóides.
Este texto é adaptado de Openstax, Chemistry 2e, Section 6.2: The Bohr Model.
