8.1:
원소의 주기율적 분류
8.1:
원소의 주기율적 분류
주기적인 표는 동일한 화학 적 특성을 가진 요소가 주기적으로 재발하도록 원자 수를 증가시키는 원자수를 정렬합니다. 그들의 전자 구성이 표에 추가되면, 이들 요소의 외부 쉘에서 유사한 전자 구성의 주기적인 재발이 관찰된다. 그들은 원자의 외부 껍질에 있기 때문에, 원자 전자는 화학 반응에서 가장 중요한 역할을한다. 외부 전자는 원자에서 전자의 가장 높은 에너지를 가지고 있으며 코어 전자보다 더 쉽게 분실되거나 공유됩니다. Valence 전자는 또한 요소의 일부 물리적 특성에 결정적인 인자.
가로 행을 기간이라고 합니다. 기간에 걸쳐, 각 연속 소자핵에 추가 양성자와 원자 껍질에 추가 전자가 있다. 세로 열은 그룹입니다. 임의의 한 그룹(또는 컬럼)의 원소는 동일한 수의 원자성 전자를 가지고 있습니다(그림 1); 알칼리 금속 리튬과 나트륨은 각각 하나의 원자 성 전자를 가지고, 알칼리 성 지구 금속 베릴륨과 마그네슘은 각각 두 가지를 가지고 있으며, 할로겐 불소와 염소각각 7 개의 원자 성 전자를 가지고 있습니다. 요소가 반응하는 방식을 정의하는 것은 원자 전자의 손실, 이득 또는 공유입니다. 동일한 그룹의 원소 들 간의 화학 적 특성의 유사성은 동일한 수의 원자 성 전자를 가지고 있기 때문에 발생합니다.
그들의 원자 구조의 어떤 아이디어도 유효하기 훨씬 전에, 원소의 화학적 행동에 기초하여 주기적인 표가 개발되었다는 것을 기억하는 것이 중요합니다. 이제 주기적인 테이블의 배열이 이해됩니다. 원자가 동일한 수의 원자 전자를 가진 원소는 동일한 그룹에 있습니다. 그림 1의 컬러 섹션은 채워지는 궤도로 분류된 요소의 세 가지 범주를 보여 준다.
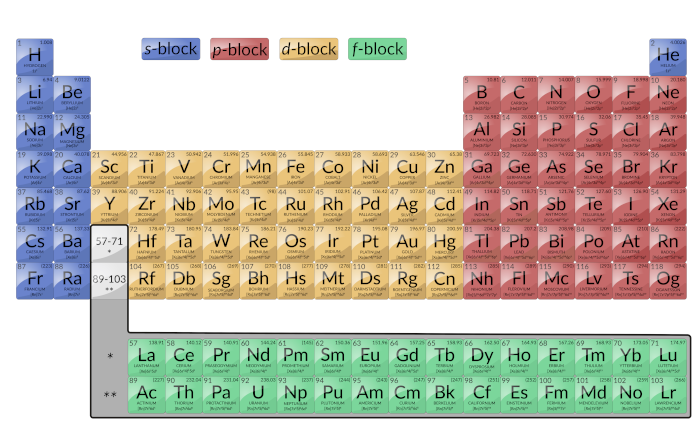
그림 1: 주기적인 테이블의 이 버전은 각 요소의 구성을 보여줍니다. 각 그룹 아래로 구성이 종종 유사합니다.
주요 그룹 요소를 대표 요소라고 도합니다. 이들은 추가된 마지막 전자가 도 1에 파란색과 빨간색으로 표시된 가장 바깥쪽 껍질에 있는 s 또는 p 궤도를 입력하는 원소입니다. 이 범주에는 금속이 아닌 모든 요소뿐만 아니라 금속 및 많은 금속이 포함됩니다. 주요 그룹 요소의 원자 성 전자는 가장 높은 n 레벨을 가진 전자입니다. 예를 들어, 갈륨(Ga, 원자번호 31)은 전자 구성 [Ar]4s23d104p1을가지며, 이는 3개의 발렌스 전자(밑줄)를 함유하고 있다. 완전히 채워진 d 궤도는 원자성, 전자가 아닌 코어로 계산됩니다.
두 개의 맨 왼쪽 열은 s-블록으로구성되며 6개의 극우 열은 p-block을구성합니다. p-블록의 일부인 고귀한 가스는 모두 헬륨을 제외한 8개의 원자성 전자를 가지고 있으며, 이는 2개가 있습니다. 이러한 요소는 매우 안정적이고 비활성적입니다.
전이 요소 또는 전이 금속: 이들은 마지막 전자가 D 궤도에 들어가는 금속 원소입니다. 이러한 원소에서 의 원자 전자 (마지막 고귀한 가스 구성 후 추가)는 ns 및(n – 1) d 전자를 포함한다. 전환 요소의 공식 IUPAC 정의는 부분적으로 채워진 d 궤도를 가진 것을 지정합니다. 따라서 완전히 채워진 궤도(Zn, Cd, Hg, 그림 1의 Cu, Ag 및 Au)가 있는 요소는 기술적으로 전환 요소가 아닙니다. 그러나 이 용어는 전체 d 블록(그림 1의 노란색으로 지정)을 참조하는 데 자주 사용됩니다.
d-블록은10개의 열로 구성됩니다. 각 행을 채우는 d 궤도의 주 양자 수는 행 번호에서 1을 뺀 것과 같습니다. 네 번째 행에서는 3d 궤도가 5열,4d 궤도 채우기 등3d 궤도를 채웁니다.
내부 전환 요소: 그림 1에 녹색으로 표시됩니다. 내부 전이 요소의 원자 쉘은(n – 2)f,(n – 1)d및 ns 서브쉘로 구성된다. 내부 전이 요소는 마지막 전자가 f 궤도에 들어갈 때 f-블록을구성합니다. 각 행을 채우는 f 궤도의 주 양자 수는 행 번호 에서 2를 뺀 것과 같습니다. 여섯 번째 줄에서4f 궤도가 채워지고 7열에서는5f 궤도가 채워지게 됩니다. 두 가지 내부 전환 시리즈가 있습니다.
- 란탄 시리즈: 라탄디드(La)를 통해 루테튬(루)
- 액티니드 시리즈: actinide (Ac) 통해 법률(Lr)
라타늄과 액티늄은 시리즈의 다른 구성원과 유사하기 때문에 F 전자가없는 전환 금속임에도 불구하고 시리즈의 이름을 포함하고 사용하는 데 사용됩니다.
