8.1:
Classificazione periodica degli elementi
8.1:
Classificazione periodica degli elementi
La tavola periodica dispone gli atomi in base all’aumento del numero atomico in modo che gli elementi con le stesse proprietà chimiche si ripetano periodicamente. Quando le loro configurazioni di elettroni vengono aggiunte alla tabella, si osserva una ricorrenza periodica di configurazioni di elettroni simili nei gusci esterni di questi elementi. Poiché si trovano nei gusci esterni di un atomo, gli elettroni di valenza svolgono il ruolo più importante nelle reazioni chimiche. Gli elettroni esterni hanno la più alta energia degli elettroni in un atomo e sono più facilmente persi o condivisi rispetto agli elettroni del nucleo. Gli elettroni di valenza sono anche il fattore determinante in alcune proprietà fisiche degli elementi.
Le righe orizzontali sono note come punti. In un periodo, ogni elemento consecutivo ha un protone aggiuntivo nel nucleo e un elettrone aggiuntivo al guscio di valenza. Le colonne verticali sono gruppi. Gli elementi di un gruppo (o colonna) hanno lo stesso numero di elettroni di valenza (Figura 1); i metalli alcalini litio e sodio hanno ciascuno un solo elettrone di valenza, i metalli alcalini della terra berillio e magnesio ciascuno ne hanno due, e gli alogeni fluoro e cloro hanno ciascuno sette elettroni di valenza. È la perdita, il guadagno o la condivisione degli elettroni di valenza che definisce il modo in cui gli elementi reagiscono. La somiglianza nelle proprietà chimiche tra gli elementi dello stesso gruppo si verifica perché hanno lo stesso numero di elettroni di valenza.
È importante ricordare che la tavola periodica è stata sviluppata sulla base del comportamento chimico degli elementi, ben prima che fosse disponibile qualsiasi idea della loro struttura atomica. Ora si comprende la disposizione della tavola periodica; gli elementi i cui atomi hanno lo stesso numero di elettroni di valenza sono nello stesso gruppo. Le sezioni colorate della Figura 1 mostrano le tre categorie di elementi classificati dagli orbitali riempiti.
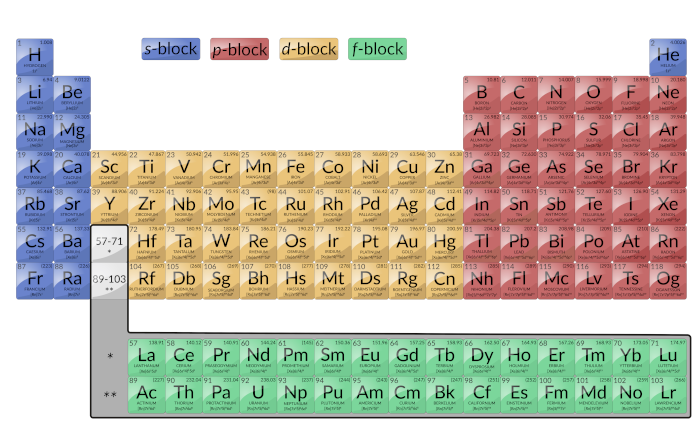
Figura 1: questa versione della tabella periodica mostra la configurazione di ogni elemento. Si noti che in ogni gruppo, la configurazione è spesso simile.
Gli elementi principali del gruppo sono talvolta chiamati elementi rappresentativi. Questi sono gli elementi in cui l’ultimo elettrone aggiunto entra in un orbitale s o p nel guscio più esterno, mostrato in blu e rosso nella Figura 1. Questa categoria comprende tutti gli elementi non metallici, così come i metalloidi e molti metalli. Gli elettroni di valenza per gli elementi del gruppo principale sono quelli con il più alto livello n. Ad esempio, il gallio (Ga, numero atomico 31) ha la configurazione elettronica [Ar]4s23d104p1, che contiene tre elettroni di valenza (sottolineati). Gli orbitali d completamente riempiti contano come elettroni nucleo, non valenza.
Le due colonne di estrema sinistra comprendono il blocco se le sei colonne di estrema destra costituiscono il blocco p. I gas nobili, che fanno parte del blocco p,hanno tutti otto elettroni di valenza ad eccezione dell’elio, che ne ha due. Questi elementi sono altamente stabili e non reattivi.
Elementi di transizione o metalli di transizione: Si tratta di elementi metallici in cui l’ultimo elettrone aggiunto entra in un orbitale d. Gli elettroni di valenza (quelli aggiunti dopo l’ultima configurazione di gas nobile) in questi elementi includono gli elettroni ns e (n – 1) d. La definizione ufficiale IUPAC degli elementi di transizione specifica quelli con orbitali d parzialmente riempiti. Quindi, gli elementi con orbitali completamente riempiti (Zn, Cd, Hg, così come Cu, Ag e Au nella Figura 1) non sono elementi tecnicamente di transizione. Tuttavia, il termine è spesso usato per riferirsi all’intero blocco d (giallo colorato nella figura 1).
Il blocco dè costituito da 10 colonne. Il numero quantico principale degli orbitali d che si riempiono attraverso ogni riga è uguale al numero di riga meno uno. In quarta fila, gli orbitali3d riempiono, in quinta fila, 4d orbitali si riempiono, e così via.
Elementi di transizioneinterna: sono visualizzati in verde nella figura 1. I gusci di valenza degli elementi di transizione interni sono costituiti dalle sottoshell (n – 2)f, (n – 1)d e ns. Gli elementi di transizione interna costituiscono f-block poiché l’ultimo elettrone entra in un orbitale f. Il numero quantico principale degli orbitali f che si riempiono attraverso ogni riga è uguale al numero di riga meno due. In sesta fila, gli orbitali 4f riempiono, e in settima fila, gli orbitali 5f riempiono. Ci sono due serie di transizione interiore:
- La serie di lantanidi: lantanide (La) attraverso lutezio (Lu)
- La serie actinide: actinide (Ac) attraverso lawrencium (Lr)
Il lantanio e l’attinio, a causa delle loro somiglianze con gli altri membri della serie, sono inclusi e usati per nominare la serie, anche se sono metalli di transizione senza elettroni f.
Questo testo è adattato da OpenStax Chemistry 2e, Sezione 6.4: Struttura elettronica degli atomi.
