8.1:
Classificação Periódica dos Elementos
8.1:
Classificação Periódica dos Elementos
A tabela periódica organiza átomos com base no aumento do número atómico para que elementos com as mesmas propriedades químicas ocorram periodicamente. Quando as configurações eletrónicas são adicionadas à tabela, observa-se uma recorrência periódica de configurações eletrónicas semelhantes nas camadas exteriores desses elementos. Como estão nas camadas exteriores de um átomo, os eletrões de valência desempenham o papel mais importante nas reações químicas. Os eletrões exteriores têm a energia mais elevada dos eletrões em um átomo e são mais facilmente perdidos ou partilhados do que os eletrões centrais. Os eletrões de valência são também o factor determinante em algumas propriedades físicas dos elementos.
As linhas horizontais são conhecidas como períodos. Ao longo de um período, cada elemento consecutivo tem um protão adicional no núcleo e um eletrão adicional na camada de valência. As colunas verticais são grupos. Os elementos de qualquer grupo (ou coluna) têm o mesmo número de eletrões de valência (Figura 1); os metais alcalinos lítio e sódio têm cada um apenas um eletrão de valência, os metais alcalinoterrosos berílio e magnésio têm cada um dois, e os halogénios fluorino e cloro têm cada um sete eletrões de valência. É a perda, ganho, ou partilha de eletrões de valência que define como os elementos reagem. A semelhança nas propriedades químicas entre elementos do mesmo grupo ocorre porque têm o mesmo número de eletrões de valência.
É importante lembrar que a tabela periódica foi desenvolvida com base no comportamento químico dos elementos, bem antes de qualquer idéia da sua estrutura atómica estar disponível. Agora, compreende-se o arranjo da tabela periódica; elementos cujos átomos têm o mesmo número de eletrões de valência estão no mesmo grupo. As secções coloridas da Figura 1 mostram as três categorias de elementos classificados pelas orbitais que estão a ser preenchidas.
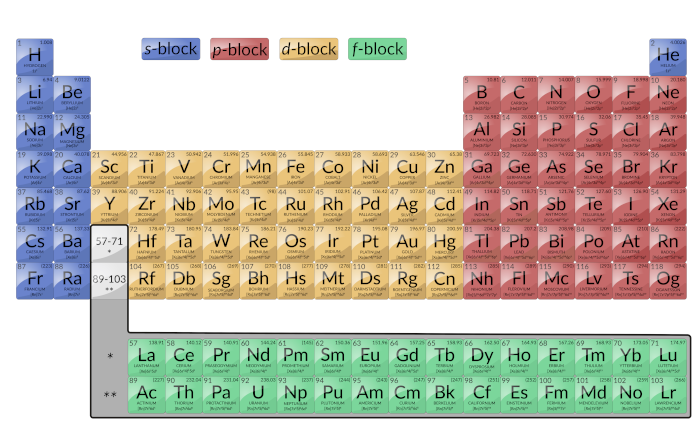
Figura 1: Esta versão da tabela periódica mostra a configuração de cada elemento. Observe que em cada grupo, a configuração é frequentemente semelhante.
Os elementos do grupo principal são por vezes chamados de elementos representativos. Estes são os elementos onde o último eletrão adicionado entra em uma orbital s ou p na camada mais externa, mostrado em azul e vermelho na Figura 1. Esta categoria inclui todos os elementos não-metálicos, bem como os metalóides e muitos metais. Os eletrões de valência para os elementos do grupo principal são aqueles de maior nível n. Por exemplo, o gálio (Ga, número atómico 31) tem a configuração eletrónica [Ar]4s23d104p1, que contém três eletrões de valência (sublinhados). As orbitais d completamente cheias contam como eletrões centrais, não de valência.
As duas colunas da extrema-esquerda compreendem o bloco s e as seis colunas da extrema-direita constituem o bloco p. Os gases nobres, que fazem parte do bloco p, têm todos oito eletrões de valência, excepto o hélio, que tem dois. Estes elementos são altamente estáveis e não reativos.
Elementos de transição ou metais de transição: Este são elementos metálicos nos quais o último eletrão adicionado entra em uma orbital d. Os eletrões de valência (os adicionados após a última configuração de gás nobre) nestes elementos incluem os eletrões d ns e (n – 1). A definição oficial do IUPAC de elementos de transição especifica aqueles com orbitais d parcialmente cheias. Assim, os elementos com orbitais completamente cheias (Zn, Cd, Hg, bem como Cu, Ag, e Au na Figura 1) não são tecnicamente elementos de transição. No entanto, o termo é frequentemente utilizado para referir todo o bloco d (colorido a amarelo na Figura 1).
O bloco d é composto por 10 colunas. O número quântico principal das orbitais d que se enchem a cada linha é igual ao número da linha menos um. Na quarta linha, as orbitais 3d são preenchidas, na quinta linha, as orbitais 4d são preenchidas, e assim por diante.
Elementos de Transição Interna: Eles são mostrados a verde na Figura 1. As camadas de valência dos elementos de transição interna são constituídas pelas subcamadas (n – 2)f, (n – 1)d, e ns. Os elementos de transição interna constituem o bloco f à medida que o último eletrão entra em uma orbital f. O número quântico principal das orbitais f que se enchem em cada linha é igual ao número da linha menos dois. Na sexta linha, as orbitais 4f</em enchem, e na sétima linha, as orbitais 5f</em enchem. Existem duas séries de transição interna:
- A série dos lantanídeos: Lantanídeo (La) até lutécio (Lu)
- A série dos actinídeos: Actinídeo (Ac) até laurêncio (Lr)
Lantânio e actínio, devido às suas semelhanças com os outros membros das séries, são incluídos e utilizados para dar nome às séries, mesmo sendo metais de transição sem eletrões f.
Este texto é adaptado de OpenStax Chemistry 2e, Section 6.4: Electronic Structure of Atoms.
