8.5:
전자 친화도
8.5:
전자 친화도
전자 친화성(EA)은 음이온(negative ion)을 형성하기 위해 기체 원자에 전자를 첨가하기 위한 에너지 변화이다.
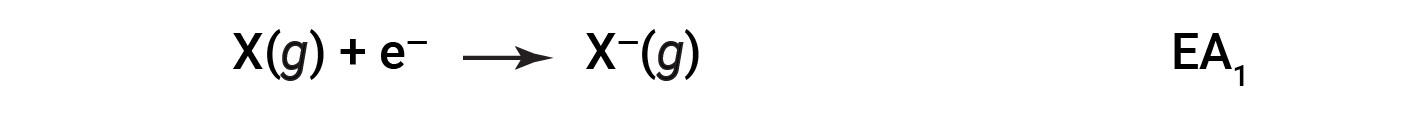
이 과정은 요소에 따라 내열성 또는 외형일 수 있습니다. 이러한 요소의 대부분은 EA의 음수 값을 가지며, 이는 기체 원자가 전자를 받아들일 때 에너지가 방출된다는 것을 의미합니다. 그러나 일부 요소의 경우 원자가 음전하가 되기 위해서는 에너지가 필요하며 EA의 가치는 양수입니다. 이온화 에너지와 마찬가지로 후속 EA 값은 더 많은 충전으로 이온을 형성하는 것과 관련이 있습니다. 두 번째 EA는 2– 이온 등을 형성하기 위해 애니메이션에 전자를 추가하는 것과 관련된 에너지입니다.
예측할 수 있듯이 원자의 효과적인 핵 전하가 증가함에 따라 일련의 원자에 전자를 추가하는 것이 더 쉬워집니다. 우리가 기간 동안 왼쪽에서 오른쪽으로 이동으로, EA는 더 부정적인되는 경향이있다. 그룹 2(2A), 그룹 15(5A), 그룹 18(8A)의 요소 들 사이에서 발견되는 예외는 이들 그룹의 전자 구조에 기초하여 이해될 수 있다. 고귀한 가스, 그룹 18 (8A)은 완전히 채워진 껍질을 가지고 있으며 들어오는 전자를 더 높은 n 레벨로 추가해야하므로 하기가 더 어렵습니다. 그룹 2(2A)는 채워진 ns 서브쉘을 가지고 있으므로 다음 전자첨가는 더 높은 에너지 NP로들어오므로, 다시 관찰된 EA 값은 추세가 예측하는 것과 같이 되지 않습니다. 마지막으로, 그룹 15 (5A)는 반 채워진 NP 서브쉘을 가지며, 다음 전자는 기존 NP 전자와 결합되어야 한다. 이러한 모든 경우 전자 구성의 초기 상대적 안정성은 EA의 추세를 방해합니다.
하나는 각 그룹의 상단에 원자가 가장 부정적인 EA를 가질 것으로 예상 할 수있다; 그들의 첫 번째 이온화 잠재력은 이러한 원자가 가장 큰 효과적인 핵 요금을 가지고 있음을 시사한다. 그러나 그룹을 아래로 이동하면 그룹의 두 번째 요소가 가장 부정적인 EA를 가장 많이 가지고 있음을 알 수 있습니다. 이는 n =2 쉘의 작은 크기와 그로 인한 큰 전자-전자 반발에 기인할 수 있다. 예를 들어 EA 값이 -348kJ/mol인 염소는 주기표의 모든 요소 중 가장 높은 값을 가지게 됩니다. 불소의 EA는 -322 kJ/mol입니다. 불소 원자에 전자를 추가하여 불소 음피온(F-)을 형성할 때, 우리는 n = 2 쉘에 전자를 추가합니다. 전자는 핵에 끌리지만, 이미 이 작은 원자 껍질에 존재하는 다른 전자로부터 상당한 반발이 있다. 염소 원자는 원자 껍질에서 동일한 전자 구성을 가지고 있지만, 입력 전자는 n = 3 쉘로 들어가기 때문에, 공간의 상당히 큰 영역을 차지하고 전자 전자 반발이 감소된다. 입력 전자는 많은 반발을 경험하지 않으며 염소 원자는 추가 전자를 더 쉽게 받아 들여더 부정적인 EA를 초래합니다.
