8.5: Afinidade Eletrónica
A afinidade eletrónica (EA) é a mudança de energia para adicionar um eletrão a um átomo gasoso para formar um anião (ião negativo).
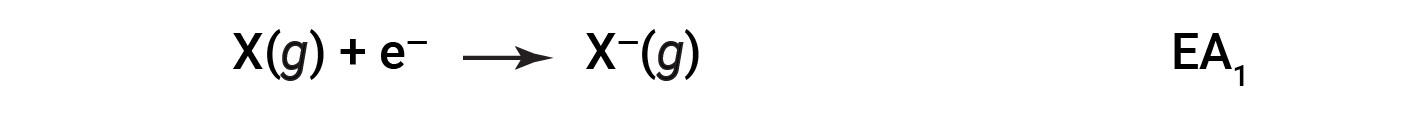
Este processo pode ser endotérmico ou exotérmico, dependendo do elemento. Muitos destes elementos têm valores negativos de EA, o que significa que a energia é libertada quando o átomo gasoso aceita um eletrão. No entanto, para alguns elementos, é necessária energia para que o átomo se torne negativamente carregado, e o valor da sua EA é positivo. Assim como com a energia de ionização, valores de EA subsequentes estão associados à formação de iões com mais carga. A segunda EA é a energia associada à adição de um eletrão a um anião para formar um ião 2–, e assim por diante.
Como se pode prever, torna-se mais fácil adicionar um eletrão por uma série de átomos à medida que a carga nuclear efetiva dos átomos aumenta. À medida que vamos da esquerda para a direita ao longo de um período, as EAs tendem a tornar-se mais negativas. As excepções encontradas entre os elementos do grupo 2 (2A), grupo 15 (5A) e grupo 18 (8A) podem ser entendidas com base na estrutura eletrónica desses grupos. Os gases nobres, grupo 18 (8A), têm uma camada completamente cheia, e o eletrão que entra deve ser adicionado a um nível n mais alto, o que é mais difícil de fazer. O grupo 2 (2A) tem uma subcamada ns cheia, pelo que o eletrão adicionado a seguir entra na np com maior energia, e então, novamente, o valor de EA observado não é como a tendência prediria. Por fim, o grupo 15 (5A) tem uma subcamada np semi-cheia, e o eletrão seguinte tem de ser emparelhado com um eletrão np existente. Em todos estes casos, a estabilidade relativa inicial da configuração eletrónica perturba a tendência na EA.
Pode-se esperar que o átomo no topo de cada grupo tenha a EA mais negativa; os seus primeiros potenciais de ionização sugerem que esses átomos têm as maiores cargas nucleares efetivas. No entanto, à medida que nos deslocamos para baixo, vemos que o segundo elemento do grupo tem, na maioria das vezes, a EA mais negativa. Isto pode ser atribuído ao pequeno tamanho da camada n = 2 e às grandes repulsões eletrão-eletrão resultantes. Por exemplo, o cloro, com um valor de EA de –348 kJ/mol, tem o valor mais elevado de qualquer elemento na tabela periódica. A EA do flúor é de –322 kJ/mol. Quando adicionamos um eletrão a um átomo de flúor para formar um anião fluoreto (F–), adicionamos um eletrão à camada n = 2. O eletrão é atraído para o núcleo, mas há também uma repulsão significativa dos outros eletrões já presentes nesta pequena camada de valência. O átomo de cloro tem a mesma configuração eletrónica na camada de valência, mas uma vez que o eletrão que entra vai para a camada n = 3, ele ocupa uma região consideravelmente maior do espaço e as repulsões de eletrão-eletrão são reduzidas. O eletrão que entra não experiencia tanta repulsão, e o átomo de cloro aceita um eletrão adicional mais prontamente, resultando em uma EA mais negativa.
Este texto é adaptado de OpenStax Chemistry 2e, Section 6.5: Periodic Variations in Element Properties.


