10.3:
Previsione della geometria molecolare
10.3:
Previsione della geometria molecolare
Teoria VSEPR per la determinazione delle geometrie della coppia di elettroni
La seguente procedura utilizza la teoria VSEPR per determinare le geometrie della coppia di elettroni e le strutture molecolari:
- Scrivi la struttura di Lewis della molecola o dello ione poliatomico.
- Contare il numero di gruppi di elettroni (coppie solitarie e legami) attorno all’atomo centrale. Un legame singolo, doppio o triplo conta come una regione di densità elettronica.
- Identificare la geometria della coppia elettrone in base al numero di gruppi di elettroni: lineare, planare trigonale, tetraedrica, bipirramidale trigonale o ottaedrica (come illustrato nella figura 1, prima colonna).
- Usa il numero di coppie solitarie per determinare la struttura molecolare. Se è possibile più di una disposizione di coppie solitarie e legami chimici, scegli quella che minimizza le repulsioni, ricordando che le coppie solitarie occupano più spazio di più legami, che occupano più spazio dei singoli legami. Negli arrangiamenti bipirramidali trigonali, la repulsione è minimizzata quando ogni coppia solitaria si trova in una posizione equatoriale. In una disposizione ottaedrale con due coppie solitarie, la repulsione è minimizzata quando le coppie solitarie si trovano sui lati opposti dell’atomo centrale.
Le strutture molecolari sono identiche alle geometrie della coppia elettrone quando non sono presenti coppie solitarie. Per un particolare numero di coppie di elettroni, le strutture molecolari per una o più coppie solitarie sono determinate in base alle modifiche della corrispondente geometria della coppia elettrone.
Previsione delle strutture molecolari mediante la teoria VSEPR
Gli esempi seguenti illustrano l’uso della teoria VSEPR per prevedere le strutture molecolari.
Vediamo come determinare la geometria della coppia di elettroni e la struttura molecolare di CO2 e BCl3.
Scriviamo la struttura di Lewis di CO2 come:
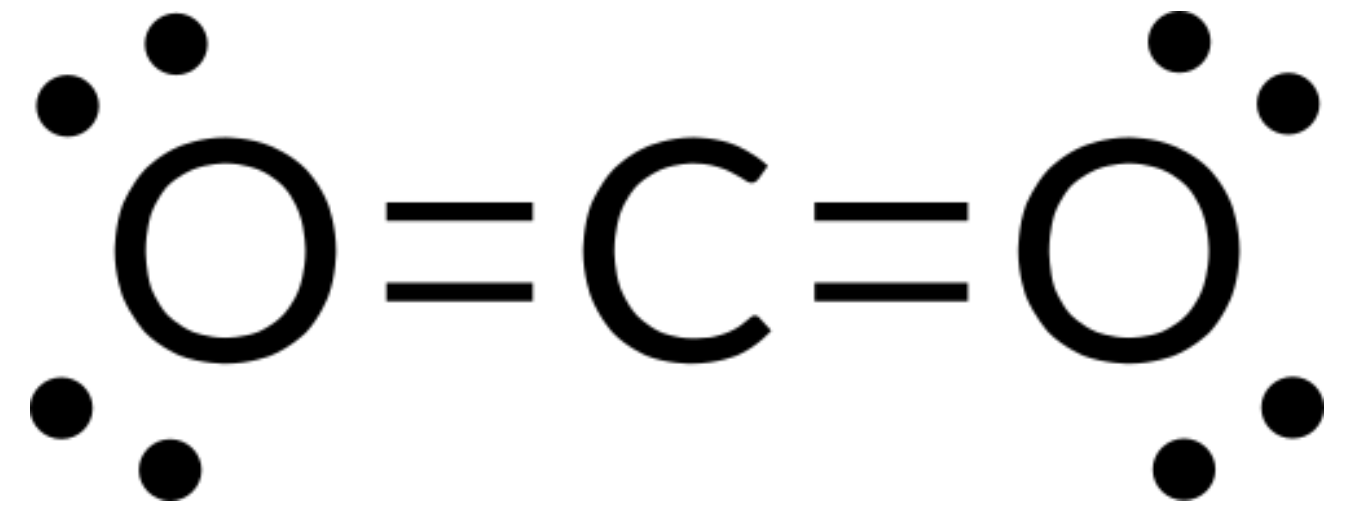
Questo ci mostra due doppi legami attorno all’atomo di carbonio: ogni doppio legame conta come un gruppo di elettroni, e non ci sono coppie solitarie sull’atomo di carbonio. Usando la teoria VSEPR, prevediamo che i due gruppi di elettroni si disponino sui lati opposti dell’atomo centrale con un angolo di legame di 180°. La geometria della coppia di elettroni e la struttura molecolare sono identiche, e lemolecole di CO 2 sono lineari.
Per prevedere la geometria della coppia elettrone e la struttura molecolare di una molecola di TeCl4, il primo passo è scrivere la struttura di Lewis di TeCl4. Indica cinque gruppi di elettroni attorno all’atomo di Te: una coppia solitaria e quattro coppie di legame:
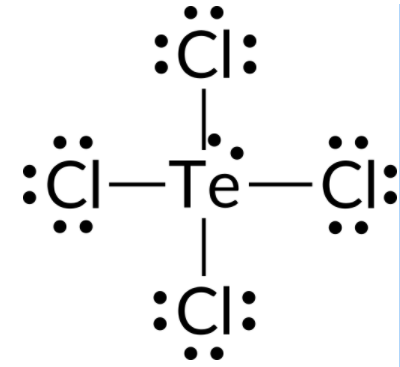
Ci aspettiamo che questi cinque gruppi di elettroni adottino una geometria trigonale bipirramidale di coppia elettrone. Per ridurre al minimo le repulsioni della coppia solitaria, la coppia solitaria occupa una delle posizioni equatoriali. La struttura molecolare è quella di un’altalena.
Questo testo è stato adattato da Openstax, Chemistry 2e, Section 7.6: Molecular Structure and Polarity.
