10.3:
预测分子几何结构
A subscription to JoVE is required to view this content. Sign in or start your free trial.
JoVE Core
Chemistry
Predicting Molecular Geometry
VSEPR 理论有助于确定电子对几何形状 和分子几何形状。使用一系列步骤来预测分子 的几何形状和键角, 例如三氯化磷。第一步是画出分子的 路易斯结构。接下来,计算中心原子上的 电子基团总数。在磷周围,有四个电子基团,即三个成键电子对和一个孤对电子。现在确定电子对几何形状。电子对几何形状是正四面体,但是,由于存在孤对电子,分子几何形状为三角锥。孤对电子将键角减小 到 109.5 度以下。使用相同的规程来预测 二氧化碳的电子对几何结构和 分子结构。二氧化碳的路易斯结构显示了碳原子周围有两个 电子基团—每个双键 都算作一个电子基团。两个电子基团将自己定向在 中心碳原子相对立的两侧,键角为 180 度。电子对几何形状和分子几何形状 是相同的,因为中心原子上没有 孤对电子,二氧化碳分子是线性的。四氯化碲的路易斯结构显示 碲原子周围有五个电子基团:即四个成键电子对和一个孤对电子。电子基团具有三角双锥几何形状。孤对电子占据其中一个赤道位置,分子呈跷跷板状。这些步骤可再次用于确定 四氯化碘阴离子的电子对几何结构 和分子结构。路易斯结构显示碘原子周围具有 六个电子基团,四个成键电子对 和两个孤电子对。电子基团呈正八面体排列。成键电子对保持在一个平面上,孤对电子位于该平面的两侧,从而最大限度地减少排斥力。分子几何形状为平面正方形。
10.3:
预测分子几何结构
用于测定电子对几何结构的 价层电子对互斥理论(VSEPR)
以下程序使用 价层电子对互斥理论(VSEPR) 确定电子对几何结构和分子结构:
- 写下分子或多原子离子离子的路易斯结构。
- 计算围绕中心原子的电子组数 (孤对和键)。 单个,双个或三键都是电子密度的一个区域。
- 根据电子组的数量识别电子对几何结构:线性、三角平面、四面体、三角对称或八面体 (如图 1 第一列所示)。
- 使用孤对的数量来确定分子结构。 如果孤对和化学键的布局可能不止一种,请选择将抑制最小化的布局,记住孤对占用的空间比多个键多,而多个键占用的空间要多。 在三角双相排列中,当每个孤对处于赤道位置时,互斥最小化。 在使用两个孤对的八面体排列中,当孤对位于中心原子的对面时,互斥最小化。
当没有孤对时,分子结构与电子对几何结构相同。 对于特定数量的电子对,一个或多个孤对的分子结构是根据相应电子对几何结构的修改确定的。
使用 价层电子对互斥理论(VSEPR) 预测分子结构
以下示例说明了使用 价层电子对互斥理论(VSEPR) 预测分子结构的情况。
让我们看看如何确定二氧化碳和 BCl3的电子对几何结构和分子结构。
我们将二氧化碳的路易斯结构写为:
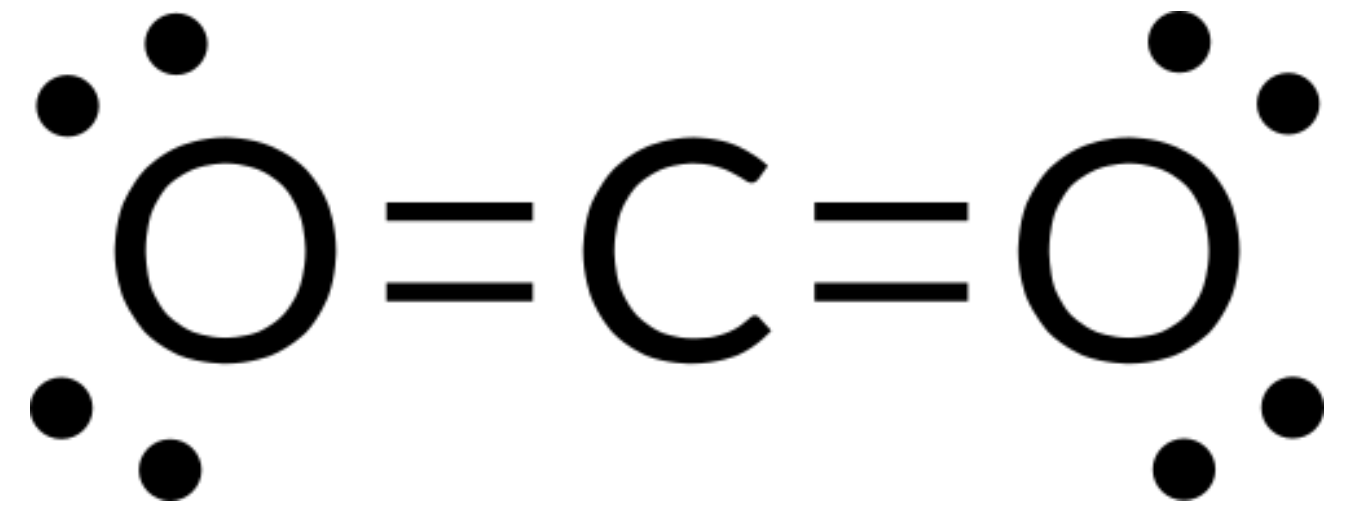
这表明碳原子周围有两个双键—每个双键都算作一个电子组,而碳原子上没有孤对。 使用 价层电子对互斥理论(VSEPR) ,我们预测这两个电子组将自己排列在中央原子的相对侧,键角度为 180°。 电子对几何结构和分子结构相同,二氧化碳分子是线性的。
为了预测 TeCl4 分子的电子对几何结构和分子结构,第一步是编写 TeCl4 的路易斯结构。 它表示 Te 原子周围有五个电子组:一个孤对和四个键对:
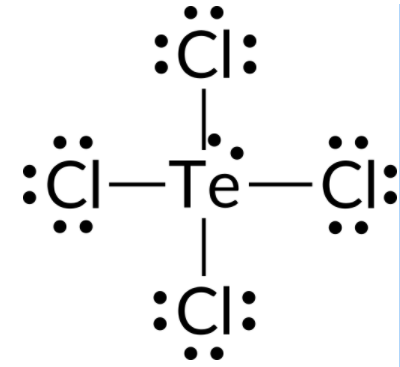
我们预计这五个电子组将采用三相双相电子对几何结构。 为了最大限度地减少孤对的反复,孤对占据了赤道的一个位置。 分子结构 是跷跷板的结构。
